异甘草酸镁注射液与还原型谷胱甘肽治疗老年脓毒症相关肝损害患者的临床疗效比较
张勇,唐韵
1.复旦大学附属华山医院静安分院药剂科,上海 200040;2.复旦大学附属华山医院静安分院急诊科,上海 200040
脓毒症是一种全身炎症反应综合征。2016年,美国胸科医师协会、欧洲危重病医学会与美国危重病医学会明确了其定义为宿主对感染的失控反应,并导致危及生命的器官功能障碍[1]。虽然脓毒症的发病机制和诊治策略已取得了一定进展,但其发病率和死亡率仍居高不下,与脓毒症相关的病死率高达15%~50%[2]。老年患者由于多病共存,机体免疫功能降低,易反复感染多种病原菌和机会致病菌,因此老年人是脓毒症高病死率的主要群体[3]。脓毒症可诱发肝功能损害,进一步增加了患者的病死率,在脓毒血症发生前或发生时提前应用肝细胞保护药物能够有效改善患者病情及预后。异甘草酸镁注射液为第4 代甘草酸制剂,具有更强地抗炎、保护肝细胞膜及改善肝功能作用[4]。但其在治疗老年脓毒症并发肝功能损害方面未见相关文献报道,本研究通过比较老年脓毒症并发肝损害患者使用甘草酸制剂(异甘草酸镁注射液)和还原型谷胱甘肽的临床疗效,为老年脓毒症患者的诊治提供新思路。
1 资料与方法
1.1 一般资料
回顾性分析2019年1月—2021年12月复旦大学附属华山医院静安分院急诊科病房收治的老年脓毒症并发肝损害患者相关资料。脓毒症诊断标准[5]:有感染或疑似感染,且床旁快速序贯器官衰竭(Se⁃quential Organ Failure Assessment,SOFA)评分≥2 分。肝功能损害诊断标准[5]:总胆红素>34 μmol /L 且谷丙转氨酶>2 倍正常上限值。纳入标准: (1)年龄≥60 岁; (2)符合上述诊断标准; (3)临床资料完整。排除标准: (1)伴有慢性肝脏疾病; (2)甘草酸或还原型谷胱甘肽使用禁忌证患者; (3)对甘草酸或其他保肝药物过敏。
最终入选117 例老年脓毒症并发肝损害患者,其中男性63 例,女性54 例;年龄60 ~101 岁,平均(83.6 ±0.8)岁。观察组(n=58)在脓毒症常规治疗的基础上联合异甘草酸镁注射液;对照组(n=59)在脓毒症常规治疗的基础上联合注射用还原型谷胱甘肽,2 组年龄、性别、急性生理与慢性健康状况Ⅱ(Acute Physiology and Chronic Health EvaluationⅡ,APACHEⅡ)评分等一般资料差异均无统计学意义(P>0.05)。见表1。
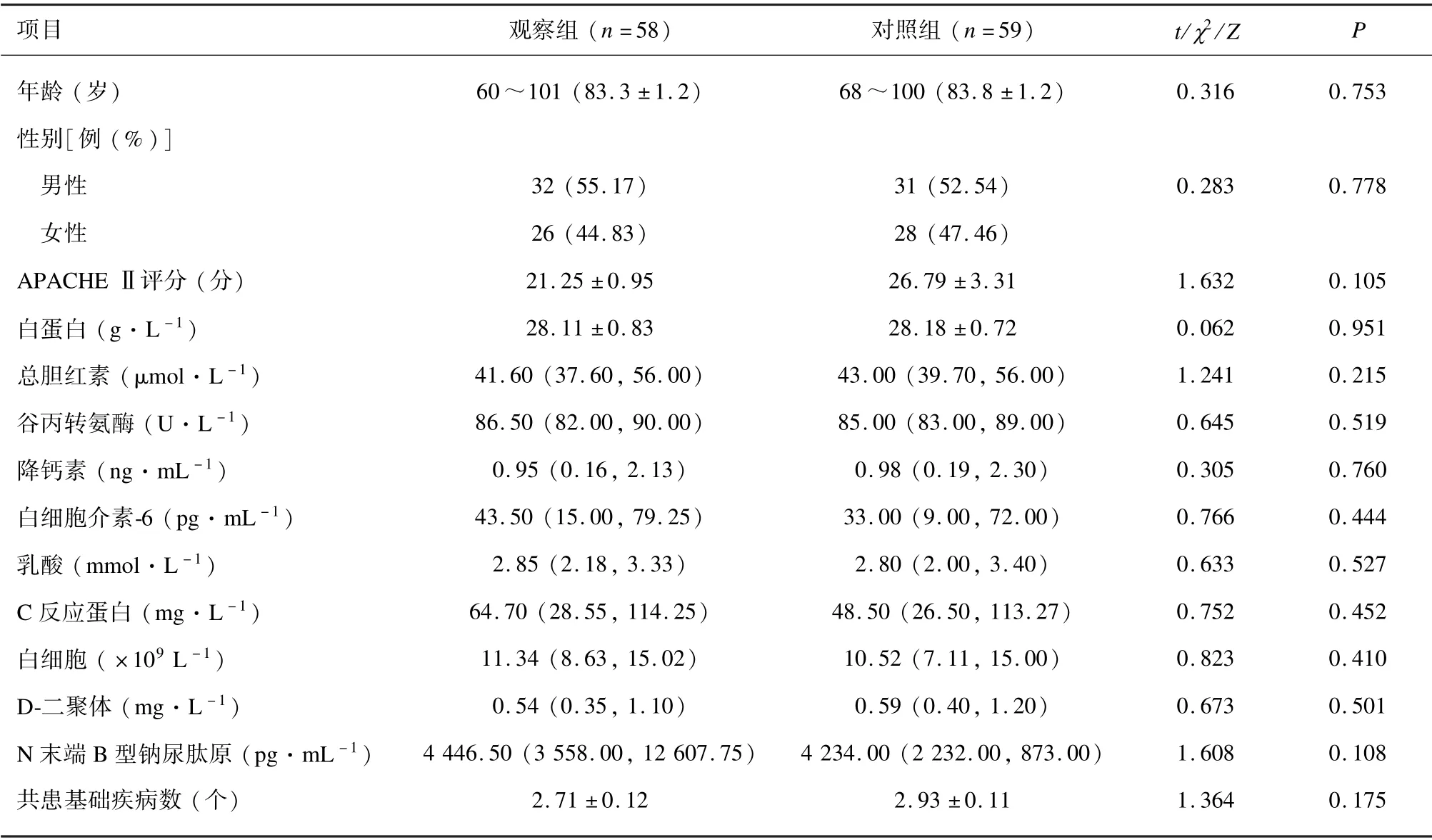
表1 2 组一般资料比较
1.2 方法
所有患者均心电监护,并给予早期液体复苏、机械通气、抗生素、血管活性药物、降糖药及营养支持等常规治疗。观察组在常规治疗的基础上,静脉滴注150 mg异甘草酸镁注射液(10 mL∶50 mg,江苏正大天晴药业集团股份有限公司,国药准字H10940190)+10%葡萄糖250 mL,每天1 次。对照组在常规治疗的基础上,静脉滴注1.2 g 注射用还原型谷胱甘肽粉剂1.2 g,上海复旦复华药业有限公司,国药准字H20052398)+生理盐水250 mL 或5%葡萄糖250 mL,每天1 次。2 组疗程均为21 d。
1.3 观察指标
(1)脓毒症指标:白细胞(white blood cell,WBC)、C 反应蛋白(C⁃reactive protein,CRP)、白细胞介素(interleukin⁃6,IL⁃6)、降钙素(procalcitonin,PCT)、血乳酸(blood lactic acid,BLA)水平; (2)肝功能指标:总胆红素(total bilirubin,TBIL)、谷丙转氨酶(glutamic⁃pyruvic transaminase,GPT); (3)心血管系统指标:D⁃二聚体(D⁃dimer,DD)、 N 末端B 型钠尿肽原(N⁃terminal pro⁃brain natriuretic peptide,NT⁃proBNP)。
1.4 不良反应和预后
记录治疗期间患者出现的皮疹、瘙痒、静脉炎、恶心、呕吐、头痛或头晕等不良反应。以出院状态为最终结局(死亡或存活),记录病情转归。
1.5 统计学分析
使用STATA 7.0 软件进行数据分析。正态分布且方差齐性的计量资料用均数±标准差(x—±s)表示,2 组间比较采用t检验;偏态分布的资料用中位数和四分位数间距表示,2 组间比较行秩和检验。计数资料以例数和百分率描述,2 组间比较行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组脓毒症指标比较
治疗前,2 组WBC、 CRP、 IL⁃6、 PCT 和BLA 水平差异无统计学意义(P>0.05)。对照组治疗前后各项脓毒症指标差异无统计学意义(P>0.05)。与治疗前比较,治疗21 d 后观察组WBC、 CRP、 IL⁃6 水平均降低(P<0.01),PCT、 BLA 水平降低(P<0.001)。2 组WBC、 CRP、 IL⁃6、 PCT 和BLA 治疗前后的差值差异有统计学意义(P<0.01)。见表2。
表2 2 组脓毒症指标比较(±s)
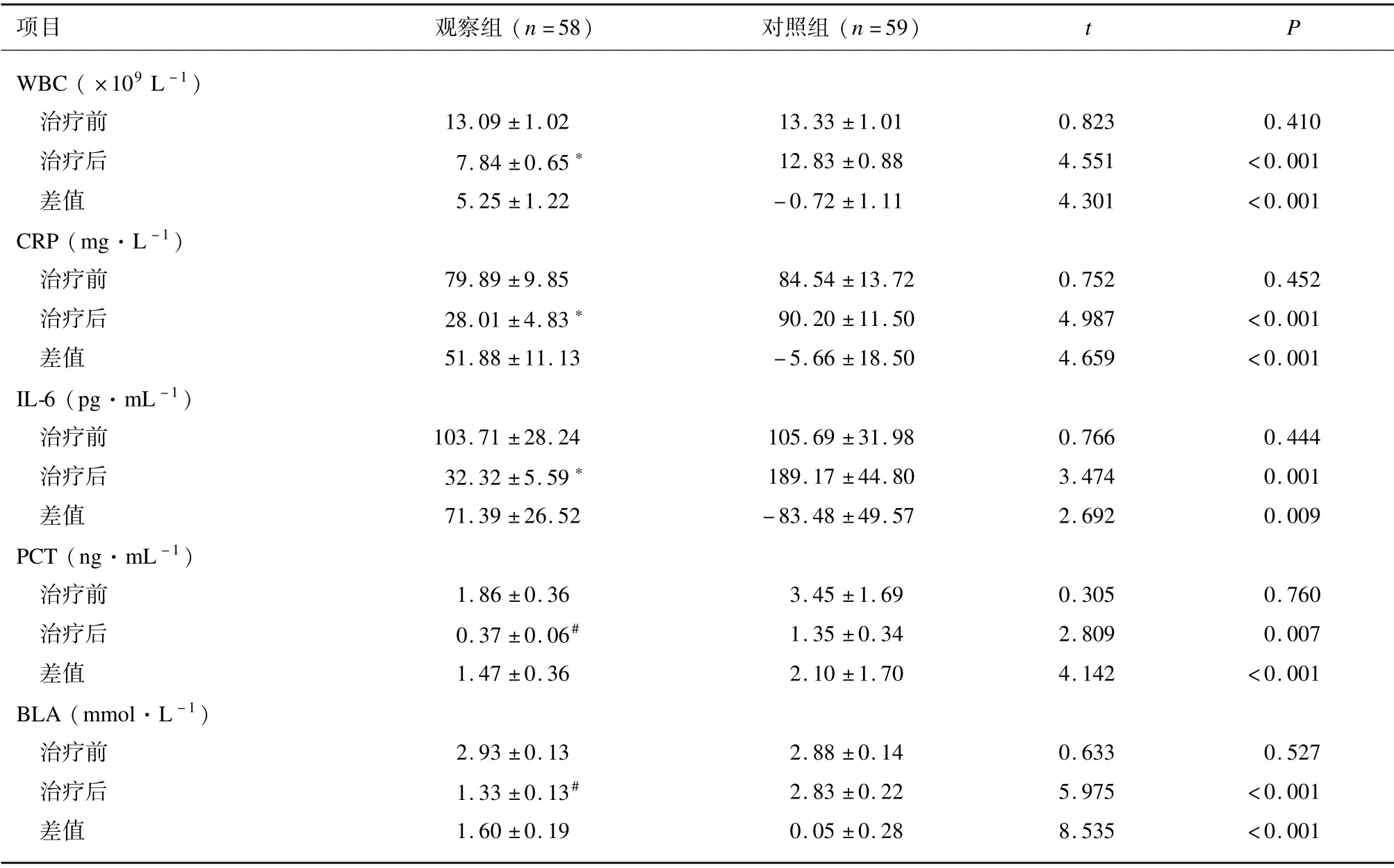
表2 2 组脓毒症指标比较(±s)
注: 与同组治疗前比较,∗P <0.01、 #P <0.001。
项目 观察组(n =58)对照组(n =59)t P WBC ( ×109 L -1)治疗前 13.09 ±1.02 13.33 ±1.01 0.823 0.410治疗后 7.84 ±0.65∗ 12.83 ±0.88 4.551 <0.001差值 5.25 ±1.22 -0.72 ±1.11 4.301 <0.001 CRP (mg·L -1)治疗前 79.89 ±9.85 84.54 ±13.72 0.752 0.452治疗后 28.01 ±4.83∗ 90.20 ±11.50 4.987 <0.001差值 51.88 ±11.13 -5.66 ±18.50 4.659 <0.001 IL⁃6 (pg·mL -1)治疗前 103.71 ±28.24 105.69 ±31.98 0.766 0.444治疗后 32.32 ±5.59∗ 189.17 ±44.80 3.474 0.001差值 71.39 ±26.52 -83.48 ±49.57 2.692 0.009 PCT (ng·mL -1)治疗前 1.86 ±0.36 3.45 ±1.69 0.305 0.760治疗后 0.37 ±0.06# 1.35 ±0.34 2.809 0.007差值 1.47 ±0.36 2.10 ±1.70 4.142 <0.001 BLA (mmol·L -1)治疗前 2.93 ±0.13 2.88 ±0.14 0.633 0.527治疗后 1.33 ±0.13# 2.83 ±0.22 5.975 <0.001差值 1.60 ±0.19 0.05 ±0.28 8.535 <0.001
2.2 2 组肝功能比较
治疗前,2 组TBIL 和GPT 水平差异无统计学意义(P>0.05)。与治疗前比较,治疗21 d 后2 组TBIL 和GPT 水平均降低(P<0.01)。2 组TBIL 和GPT 治疗前后的差值差异无统计学意义(P>0.05)。见表3。
表3 2 组肝功能比较(±s)
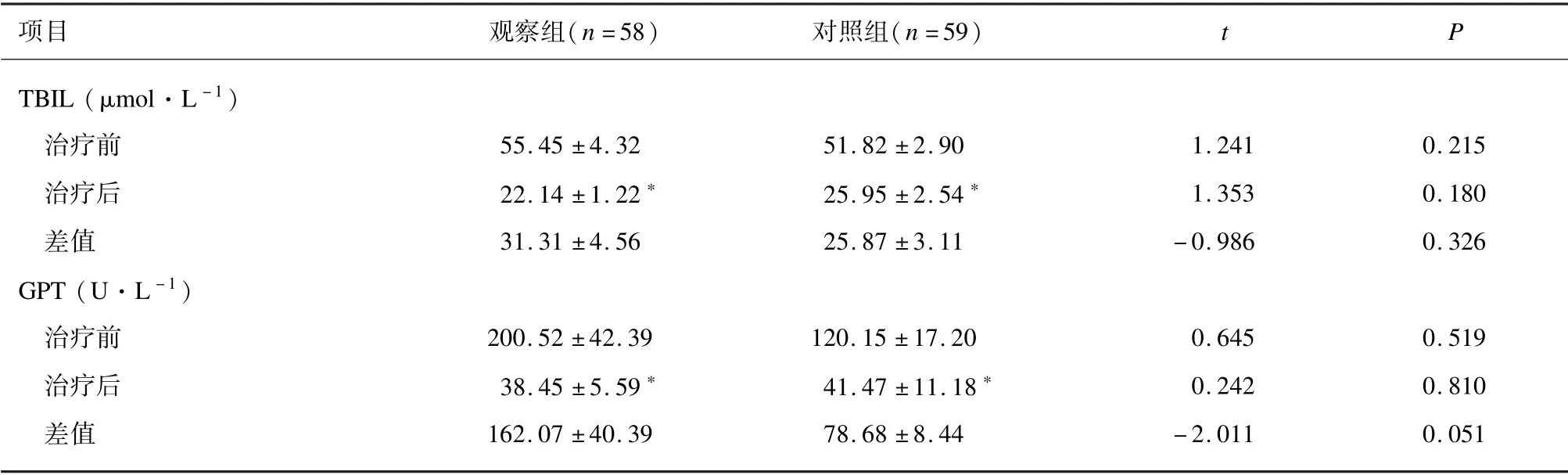
表3 2 组肝功能比较(±s)
注: 与同组治疗前比较,∗P <0.01。
项目 观察组(n =58)对照组(n =59)t P TBIL (μmol·L -1)治疗前 55.45 ±4.32 51.82 ±2.90 1.241 0.215治疗后 22.14 ±1.22∗ 25.95 ±2.54∗ 1.353 0.180差值 31.31 ±4.56 25.87 ±3.11 -0.986 0.326 GPT (U·L -1)治疗前 200.52 ±42.39 120.15 ±17.20 0.645 0.519治疗后 38.45 ±5.59∗ 41.47 ±11.18∗ 0.242 0.810差值 162.07 ±40.39 78.68 ±8.44 -2.011 0.051
2.3 2 组心血管系统指标比较
治疗前,2 组DD 和NT⁃proBNP 水平差异无统计学意义(P>0.05)。对照组治疗前后DD 和NT⁃proBNP 差异无统计学意义(P>0.05)。与治疗前比较,治疗21 d 后观察组DD (P=0.007)和NT⁃proB⁃NP (P<0.001)水平降低。2 组DD 和NT⁃proBNP治疗前后的差值差异有统计学意义(P<0.01)。见表4。
表4 2 组心血管系统指标比较(±s)
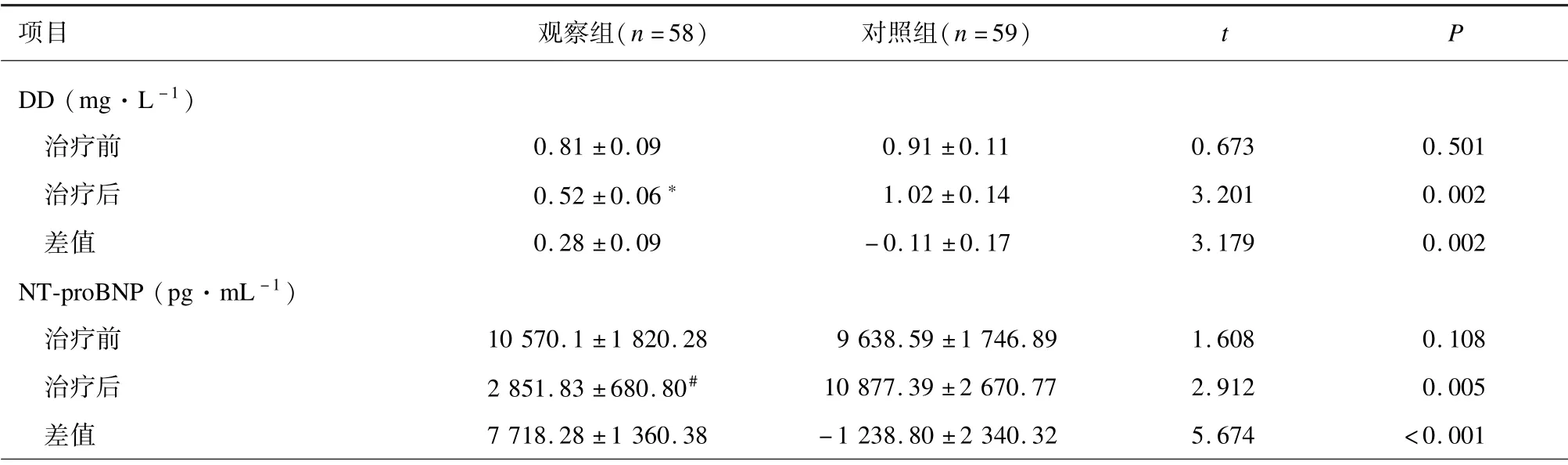
表4 2 组心血管系统指标比较(±s)
注: 与同组治疗前比较,∗P <0.01、 #P <0.001。
项目 观察组(n =58)对照组(n =59)t P DD (mg·L -1)治疗前 00 00.81 ±0.09 000 000.91 ±0.11 0.673 0.501治疗后 00 00.52 ±0.06∗ 000 001.02 ±0.14 3.201 0.002差值 00 00.28 ±0.09 0 00 -0.11 ±0.17 3.179 0.002 NT⁃proBNP (pg·mL -1)治疗前 10 570.1 ±1 820.28 9 638.59 ±1 746.89 1.608 0.108治疗后 2 851.83 ±680.80# 10 877.39 ±2 670.77 2.912 0.005差值 7 718.28 ±1 360.38 -1 238.80 ±2 340.32 5.674 <0.001
2.4 2 组不良反应及预后比较
治疗期间2 组均无皮疹、瘙痒、静脉炎、恶心、呕吐、头痛或头晕等不良事件发生。观察组死亡率8.62%(5/58),对照组死亡率23.73%(14/59),观察组预后优于对照组(t=4.908,P=0.027)。
3 讨论
脓毒症属于临床急危重症,传统治疗并不能降低脓毒症的病死率,积极防治脓毒症引发的器官损伤对降低脓毒症死亡率具有重要意义。临床上用于肝功能保护的药物主要涉及基础代谢类、肝细胞膜保护和解毒保肝。作为常用的解毒保肝药物,还原型谷胱甘肽在临床上广泛使用,而新一代甘草酸制剂异甘草酸镁注射液在老年脓毒症伴肝功能损害患者中的临床使用并不多见。有学者认为天晴甘美(异甘草酸镁)改善肝炎肝功能异常的临床疗效优于还原型谷胱甘肽,考虑异甘草酸镁具有抗炎、抗氧化效能,能够诱导干扰素产生,稳定肝细胞膜,调节免疫,促进肝细胞再生[6]。同时,天晴甘美治疗慢性乙肝的总有效率高于复方甘草酸苷制剂[4]。本次研究结果显示,异甘草酸镁和还原型谷胱甘肽能改善老年脓毒症伴肝功能损害患者的TBIL 和GPT,这与国内其他学者的研究结果一致[7]。同时2 组治疗前后TBIL 和GPT 的差值差异未见统计学意义。
血清PCT 水平能够监测细菌感染是否发生及其严重程度[8],临床中常借助PCT 进行感染类别的鉴定、感染程度和疗效的监测。而BLA 可以反映器官、组织缺氧与灌注不足,评估疾病严重程度的敏感性较高。研究发现[9],与中/高BLA 水平者相比,低BLA水平者生存率更高、病死率更低,提示BLA 水平与脓毒症病情严重程度及预后密切相关。本次研究发现,常规治疗联合异甘草酸镁注射液治疗21 d 后,PCT(t=4.064,P<0.001)和BLA(t=8.809,P<0.001)均较治疗前下降,而常规治疗联合还原型谷胱甘肽治疗后PCT 和BLA 未见明显改善(P>0.05),提示异甘草酸镁注射液除了具有肝功能保护作用外,还有抗炎、抗凋亡、阻断脓毒症炎症因子过度氧化应激等作用。既往研究显示,多种炎症因子及信号通路(包括IL⁃6、白细胞介素⁃18、肿瘤坏死因子α 及丝裂原活化蛋白激酶信号通路)参与调控脓毒症相关肝功能损害[10]。此外,高速泳动族蛋白⁃1(high⁃mobili⁃ty group box⁃1,HMGB⁃1)可能作为新的晚期炎症因子[11]引起中性粒细胞⁃内皮细胞黏附,激活CRP、补体和凝血级联反应,抑制凝血功能,导致微血栓形成[12]。腹腔注射甘草酸可降低白细胞介素水平,减少大鼠肺、肾和肝组织HMGB⁃1 的表达[13],可见甘草酸可以改善肝脏、脊髓、大脑和心脏的缺血再灌注损伤。
根据本次研究,常规治疗联合异甘草酸镁注射液治疗21 d 后,DD(t=2.769,P=0.007)和NT⁃proBNP(t=3.972,P<0.001)较治疗前降低,说明异甘草酸镁注射液能够改善机体循环系统的易凝状态,增强心肌功能,缓解心力衰竭。研究显示,脓毒症时机体表达的炎症介质IL⁃6 分泌大量急性期反应蛋白,可抑制凝血功能相关的蛋白C 通路,导致机体处于高凝状态[14]。脓毒症早期损害心脏的收缩与舒张功能,约40%~50%的脓毒症患者出现心功能不全,约7%的患者有严重的心力衰竭[15]。将甘草酸液注入脓毒症小鼠腹腔可以缓解小鼠的心衰症状,提示甘草酸通过降低血液中肿瘤坏死因子α、 IL⁃6等炎症因子的水平,抑制心脏组织中Toll 样受体4的表达,从而起到保护心脏的作用。此外,甘草酸对脓毒症诱导的多器官损伤也有良好的保护作用,可降低脓毒症的死亡率,相关机理与其独特的抗炎、抗氧化应激、抗细胞凋亡等密切相关[16]。本研究中对照组死亡率高于观察组(23.73%vs8.62%,P=0.027),且2 组均未见不良反应发生,可见脓毒症常规治疗联合异甘草酸镁注射液不仅安全有效,还有助改善患者预后。
作为回顾性研究,本次研究并未对疗效、 APAC⁃HE Ⅱ评分和SOFA 评分等预后指标进行分析,将在今后的研究中加以改进。综上所述,异甘草酸镁注射液较传统的解毒保肝药还原型谷胱甘肽具有更为安全、高效的保肝作用,能够减少炎症反应、缓解心力衰竭,对于治疗老年脓毒症引发的肝损害具有积极作用。

