康复新液联合碱性成纤维细胞生长因子治疗老年乳腺癌放疗患者放射性皮炎的临床观察
马国旗,刘彭坤,王磊
安徽医科大学附属亳州医院肿瘤科,安徽亳州 236800
乳腺癌是指女性乳腺导管上皮细胞失去正常特性而异常增生,并超过自我修复的限度进一步发生癌变的疾病。手术后放疗是目前治疗乳腺癌非常重要的治疗手段,但放射性治疗在杀灭肿瘤细胞的同时也会引起皮肤组织损害以及功能障碍。放射性皮炎不仅影响乳腺癌患者的治疗效果,加之老年患者皮肤萎缩、弹性减少、干燥起皱等问题,放疗中极有可能出现严重的皮肤损伤直接威胁到老年患者的生命安全[1]。碱性成纤维细胞生长因子(basic fibroblast growth fac⁃tor,bFGF)能刺激细胞增殖迁移,具有强烈的血管生成作用,已被证明可用于伤口愈合和骨折修复应用[2]。康复新液的主要成分是美洲大蠊干虫体乙醇提取物,含有多种多元醇、表皮生长因子、氨基酸和粘糖苷等氨基酸等活性物质,已有研究表明,康复新液具有消炎消肿、促进细胞增殖和新肉芽组织生长、加速受损组织修复、加速坏死组织脱落和提高机体免疫功能等作用[3]。老年患者伤口愈合比中青年人更慢,探索多途径多方向的防治方案对老年乳腺癌患者意义重大,目前临床治疗老年放射性皮炎中bFGF 与康复新液联合应用研究较少,本研究为探寻新型有效治疗方法,在bFGF 基础上辅以更多药理靶点的康复新液治疗老年性放射性皮炎,取得预期临床应用效果,结果如下。
1 资料与方法
1.1 一般资料
选择2017年6月—2021年2月于安徽医科大学附属亳州医院肿瘤科收治的老年乳腺癌放射性皮炎患者研究对象。纳入标准: (1)患者年龄≥60 岁;(2)经病理学检查确诊为乳腺癌,且接受放疗后并发放射性皮损; (3)生存期≥1年。符合上述所有标准的病例纳入本项研究。排除标准: (1)易过敏体质;(2)合并其他部位肿瘤或严重器官功能障碍; (3)正处于其他研究者; (4)明显手术瘢痕或皮肤出血溃烂。符合上述任意1 项者不可纳入本项研究。回顾性搜集患者临床资料,依据纳入标准纳入88 例老年乳腺癌放射性皮炎患者,并根据排除标准将7 例老年乳腺癌放射性皮炎患者排除,最终81 例老年乳腺癌放射性皮炎患者被纳入本项研究。依据放射性皮炎的治疗方式对81例患者进行分组:观察组(bFGF +康复新液治疗,37例)和对照组(bFGF 治疗,44 例)。观察组年龄60~86岁,平均(68.1 ±5.4)岁;放疗剂量45 ~55 Gy,平均:(49.36 ±2.35)Gy;放射性皮炎Ι、Ⅱ、Ⅲ级分别9 例(24.32%)、 21 例(56.76%)、 7 例(18.92%)。对照组年龄60 ~86 岁,平均(68.1 ±5.6)岁;放疗剂量45~55 Gy,平均(49.40 ±2.28)Gy;放射性皮炎Ι、Ⅱ、Ⅲ级分别10 例(22.73%)、 25 例(56.82%)、 9 例(20.45%)。2 组放疗剂量和年龄等差异无统计学意义(P>0.05),有可比性。
1.2 治疗方法
2 组患者在接受放疗前均进行常规放疗健康宣教,分发放疗期间皮肤护理手册,在进行常规护理的基础上,对照组采用外用重组人碱性成纤维细胞生长因子(bFGF 国药准字S20040053,南海朗肽制药有限公司,20000IU∗1 支/盒)对放疗期间皮炎进行治疗,每次放疗结束后估算皮损面积,按照150 IU/cm2皮损面积药物用生理盐水溶解,将溶解液置于喷雾瓶中,对准皮损部分喷洒处理,等待创面自然干燥。观察组采用bFGF +康复新液对放疗期间皮炎进行治疗,其中bFGF 治疗方式、剂量和周期等均与对照组相同,另在bFGF 使用前加用康复新液(国药准字Z51021834,四川好医生攀西药业有限责任公司,10 mL∗10 支/盒)治疗。使用0.5 ~1 支康复新液充分浸润无菌纱布,将纱布敷贴于皮损创面,适当包扎,湿敷1 h 后揭开无菌纱布,待创面干燥后使用bFGF 喷雾。前1 周早晚各1 次,1 周后改为1 次/d。
1.3 观察指标与方法
(1)疗效:治疗2 周时评估2 组皮炎治疗效果。(2)视觉模拟评分:分别于治疗前、治疗后3 d 和治疗后7 d 分别使用视觉模拟评分法(visual analogue scale,VAS)评估2 组不同时间点的疼痛程度,在纸上面划一条10 cm 的横线,横线的一端为0(表示无痛),另一端为10(表示剧痛),VAS 评分分为0 ~10 个等级,评分越高示疼痛程度越严重。(3)炎性因子及血清表皮细胞因子(epidermal growth factor,EGF)水平:分别于治疗前和治疗2 周后采集患者空腹上臂静脉血约3 ~5 mL,测得2 组治疗前后白介素6(IL⁃6)、肿瘤坏死因子(TNF⁃α)及EGF 水平。其中IL⁃6 使用酶联免疫吸附试验(ELISA)检测(检测试剂盒由合肥莱尔生物科技有限公司提供),TNF⁃α 使用ELISA 法检测(检测试剂盒由上海心语生物科技有限公司提供),EGF 使用双抗体夹心法检测(检测试剂盒由上海锐谷生物科技有限公司提供)。(4)RISRAS 评分和KPS评分:分别于治疗前和治疗2 周后分别使用放射性皮肤损伤评估量表(radiation induced skin reaction assess⁃ment scale,RISRAS)[4]和Karnofsky 功能状态评分标准(KPS 评分量表)[5]评定2 组治疗前后的皮损状况和身体健康状况,RISRAS 评分分为患者主观症状评分(总分0 ~12 分,得分越高示主观症状越严重)和医务人员专业评分(红斑、干性脱皮、湿性脱皮、坏死共4个方面,总分0 ~16 分:其中红斑计分0 ~4 分,评分越高表示皮肤状态越差;干性脱皮、湿性脱皮、坏死则由皮肤损伤占放射野的比例进行评估,0 分表示正常,1 分表示皮肤损伤占放射野比例<25%,2 分表示皮肤损伤占放射野比例为25% ~50%,3 分表示皮肤损伤占放射野比例为50% ~75%,4 分表示皮肤损伤占放射野比例>25%)进行综合评估,RISRAS 评分总分范围0 ~28 分,评分越高表示皮损状况越严重。Karnofsky 评分范围0~100 分,0 分表示死亡,100 分表示正常,无症状和体征,Karnofsky 评分越高表示身体健康状况越好。
1.4 疗效判定标准
根据《GBZ106⁃2016 放射性皮肤疾病诊断标准》[6]对放射性皮炎治疗效果进行评估,分为治愈(皮损部无渗液,疼痛感消失,创面全部被痂皮覆盖且面积变小)、有效(皮损部压之有少量渗液,疼痛感减轻,创面基本被痂皮覆盖)和无效(皮损部渗液增多,疼痛、痒等不适感无好转)。总有效率=(治愈例数+有效例数)/总例数×100%。
1.5 统计学分析
数据处理采用SPSS 20.0 软件。计量资料以均数±标准差(±s)表示,2 组间比较采用t检验,同组多次测量数据比较采用F检验;计数资料以例数和百分率表示,2 组间比较采用χ2检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 2 组疗效比较
观察组放射性皮炎治疗总有效率比对照组更高(P<0.05);观察组治愈时间比对照组更短(P<0.05)。见表1。
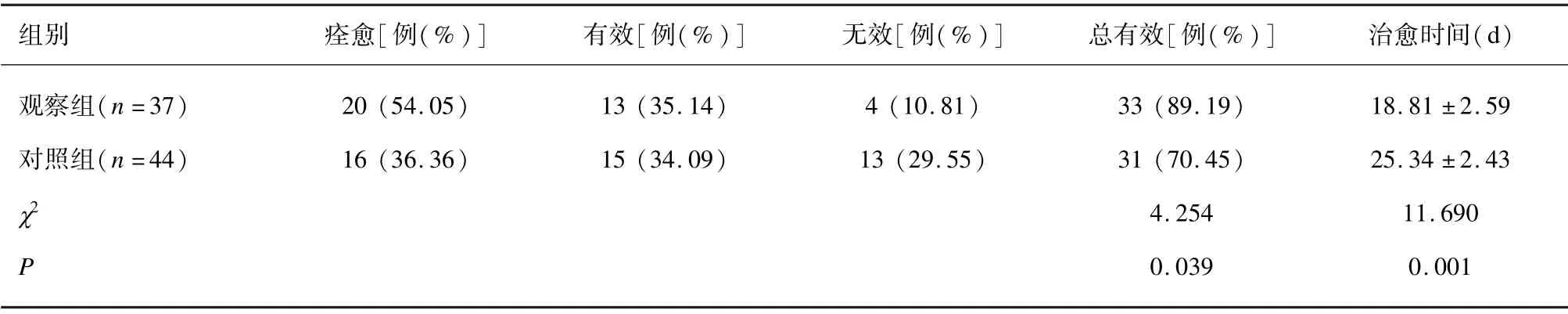
表1 2 组治疗效果比较
2.2 2 组VAS 评分比较
治疗前,2 组的VAS 评分差异无统计学意义(P>0.05);治疗后,2 组VAS 评分均低于同组治疗前(P>0.05),且随时间延长而逐渐减少(P<0.05),观察组治疗后3 d 和治疗后7 d 的VAS 评分均低于对照组(P<0.05)。见表2。
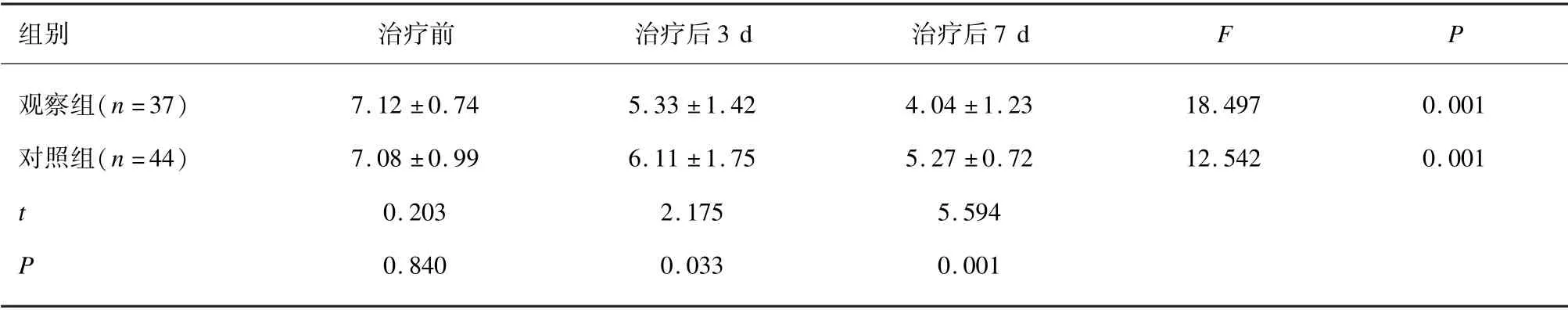
表2 2 组VAS 评分比较(分, x —±s)
2.3 2 组炎性因子及EGF 水平比较
治疗前,2 组IL⁃6、 TNF⁃α 及EGF 水平差异均无统计学意义(P>0.05);治疗后,2 组IL⁃6 和TNF⁃α水平均明显低于同组治疗前(P>0.05),EGF 水平均高于同组治疗前(P>0.05),且观察组IL⁃6 和TNF⁃α水平比对照组更低,EGF 水平比对照组更高(P<0.05)。见表3。
表3 2 组炎性因子及EGF 水平比较(±s)
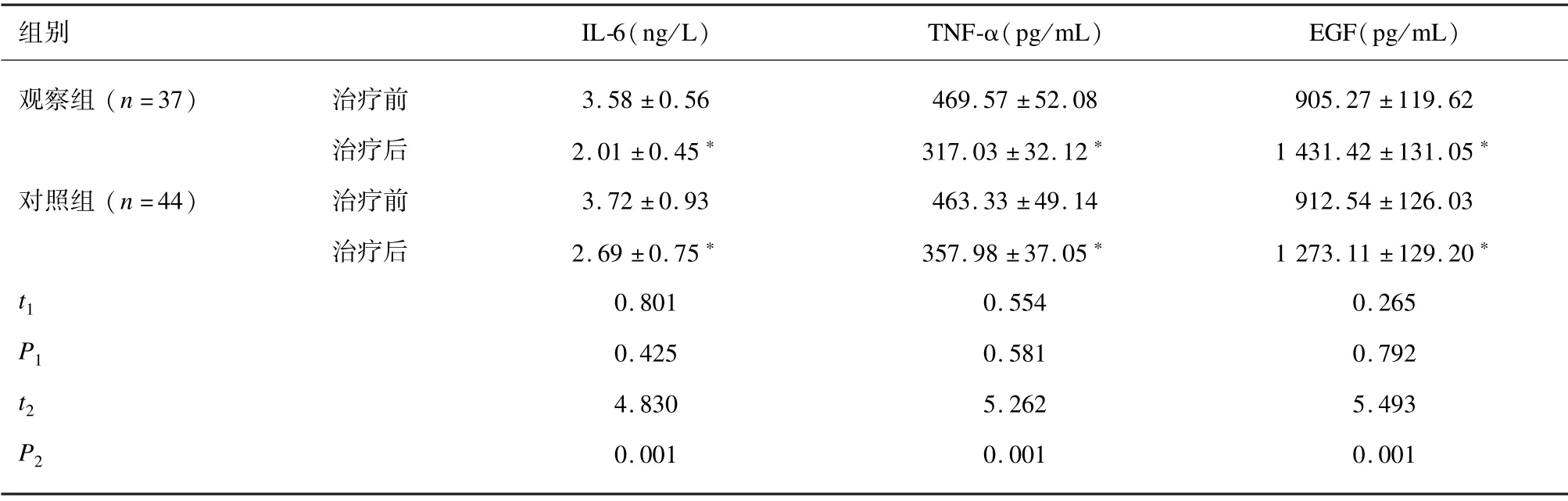
表3 2 组炎性因子及EGF 水平比较(±s)
注: t1 和P1 为2 组治疗前指标比较统计值; t2 和P2 为2 组治疗后指标比较统计值;与同组治疗前比较,∗P <0.05。
组别 IL⁃6(ng/L)TNF⁃α(pg/mL)EGF(pg/mL)观察组(n =37)治疗前 3.58 ±0.56 469.57 ±52.08 905.27 ±119.62治疗后 2.01 ±0.45∗ 317.03 ±32.12∗ 1 431.42 ±131.05∗对照组(n =44)治疗前 3.72 ±0.93 463.33 ±49.14 912.54 ±126.03治疗后 2.69 ±0.75∗ 357.98 ±37.05∗ 1 273.11 ±129.20∗t1 0.801 0.554 0.265 P1 0.425 0.581 0.792 t2 4.830 5.262 5.493 P2 0.001 0.001 0.001
2.4 2 组RISRAS 评分和KPS 评分比较
治疗前,2 组RISRAS 评分和KPS 评分差异均无统计学意义(P>0.05);治疗后,2 组RISRAS 评分和KPS 评分均低于同组治疗前(P>0.05),且观察组治疗后RISRAS 评分比对照组更低,KPS 评分比对照组更高(P<0.05)。见表4。
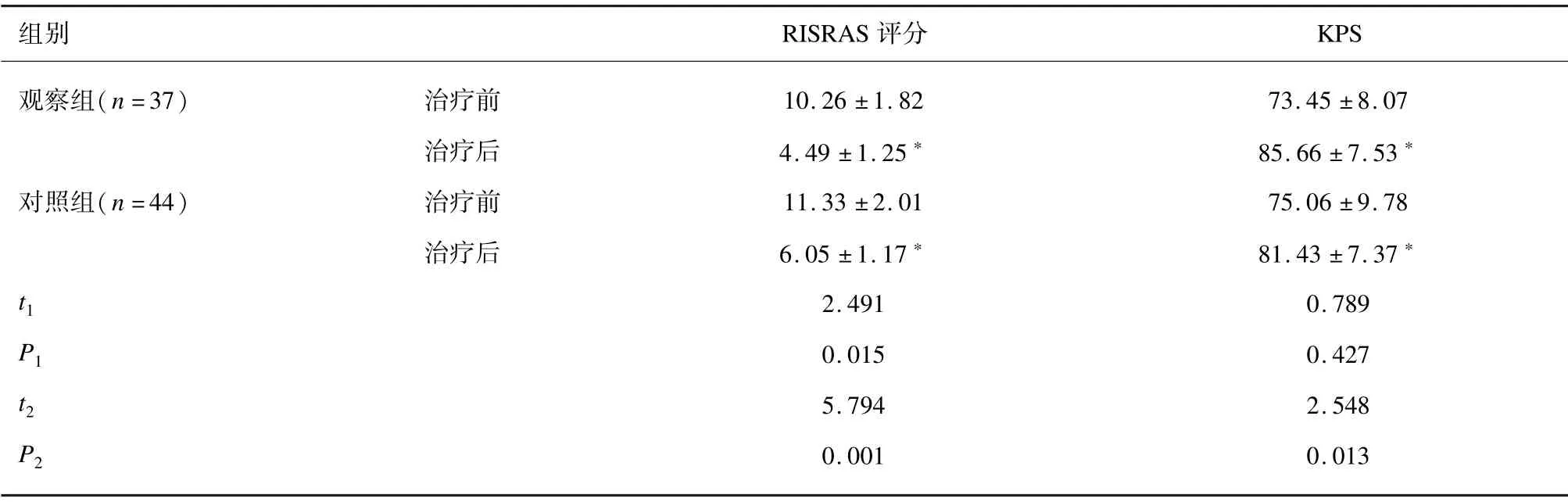
表4 2 组RISRAS 评分和KPS 评分比较(分)
3 讨论
有研究[7]报道,乳腺癌在女性恶性肿瘤中发病率占第一位,具有发病率高、极具侵袭性、一般进程相对缓慢等特点。放疗是通过利用高能射线照射肿瘤使肿瘤细胞死亡而达到局部治疗效果,大多数乳腺癌患者在放疗期间会出现局部发红、发肿、红斑等放疗的早期皮肤反应,随着放疗的不断进行,放疗区域可能出现水肿、脱皮、溃烂等放射性皮炎症状。严重的放射性皮炎很可能导致化疗剂量减少或放疗中断,进而影响患者预后,同时它也会导致生活质量下降、额外的镇痛及预防感染治疗增加患者的经济负担等问题。Boismal 等[8]研究指出,年龄增加是伤口愈合受损的主要风险因素,且老年人口愈合受损风险超过任何其他年龄组,探索适用于老年乳腺癌患者放射性平皮炎伤口愈合应用的科学高效的治疗方法仍然是一个巨大的挑战。
伤口愈合是一个动态而复杂的过程,涉及炎症、组织再生和组织重塑等生化和生理过程。有研究发现,从创伤早期开始应用bFGF 可能通过有丝分裂原活化蛋白激酶/细胞外信号调节激酶(MEK/ERK)和磷酸肌醇3 激酶/蛋白激酶B (PI3K/Akt)信号通路介导成纤维细胞更好增殖并促进DNA 合成,并指出bFGF 可以改善细胞迁移、增殖、分化和血管生成[9]。在临床应用中,bFGF 被广泛接受并用于加速伤口愈合,但生物活性消失速度较快,存在稳定性较差这一缺点。康复新液是1 种纯中药制剂,具有活血养滋生肌的功效,在我国被广泛应用于治疗胃溃疡和结肠,且治疗效果显著,目前已逐渐推广应用于溃疡、烧伤、瘘管等治疗[10]。有研究曾将康复新液外用于口腔黏膜,发现康复新液可促进牙龈表皮细胞Ⅰ型等弹性胶原合成增加,生成新的肉芽组织,使牙龈炎症的局部细胞增殖[11];也有研究将康复新液以超声波熏蒸浴治疗用于痔疮术后,发现康复新液超声波熏蒸浴治疗组伤口愈合及住院所需时间均低于常规护理组(未使用康复新液)[12]。有关药理学研究发现,康复新液中富集的多元醇成分和上皮生长因子能够促进皮损部位的细胞生长,同时增强抗炎和抗感染作用,促进坏死组织的剥离[13]。
基于既往研究结论,此研究将康复新液用于老年乳腺癌放射性皮炎的康复治疗,发现观察组治疗有效率比对照组更高,提示在康复新液对bFGF 治疗放射性皮炎具有增效作用。另,研究结果显示治疗后观察组VAS 评分比对照组更低,提示bFGF 基础上加用康复新液能明显缓解老年乳腺癌患者放射性皮炎损伤引起的疼痛感,这与康复新液有效改善局部血液循环、促进水肿消肿的药理学效果密切相关[14]。有研究表明,康复新液可通过抑制放射损伤引起的钙依赖性钾通道开放来减轻患者化疗后的疼痛和不适[15]。炎症因子可通过刺激皮肤组织蛋白酶的合成和分泌,导致胶原蛋白含量降低,细胞增殖减弱,延缓创面愈合。对比2 组的血检指标,发现治疗后观察组的IL⁃6、TNF⁃α 检测值和EGF 灰度值比对照组更低,说明bFGF联合康复新液有助于降低老年乳腺癌患者放射性皮炎的炎症程度。Wei 等[16]研究指出,康复新液能在一定程度上提高机体免疫功能,并能增加血清中溶菌酶活性、加快坏死细胞组织清除,发挥抗炎效果。此次研究还发现观察组治疗后RISRAS 评分比对照组低,且KPS 评分比对照组更高,说明bFGF 联合康复新液能提高老年乳腺癌化疗患者的皮肤状况及健康状况,有助于患者接受彻底治疗,考虑可能与康复新液增强伤口部位细胞外基质的合成和分泌,改善中性粒细胞肌肉肌动蛋白功能从而促进辐射引起的创面愈合有关[17]。
综上所述,应用bFGF 联合康复新液治疗老年乳腺癌放射性皮炎,不仅能缓解皮损引起的疼痛感,还能降低炎症反应,促进创面愈合,进一步为老年乳腺癌患者顺利完成放疗提供保障。但本研究尚存在观察时间短、未使用盲法进行随机对照试验等不足,有待在今后研究中进一步完善研究方法,得出更严谨的结论。
——皮炎

