miR⁃500a表达在三阴性乳腺癌中的临床意义及对肿瘤进展的影响
黄海华,何琛波,孙毅
郴州市第一人民医院影像医学中心,湖南郴州 423000
乳腺癌是女性最常见的癌症,严重威胁着女性的身心健康[1]。虽然随着诊断技术和治疗方式的改进,乳腺癌的死亡率一直在下降,但全世界的乳腺癌发病率仍在上升,乳腺癌仍然是女性癌症死亡的主要原因[2]。预计到2040年,全球范围内老年女性乳腺癌患者(65 岁以上)人数将翻两番[3]。鉴于老年人体内衰老标志物和激素水平与年轻人不同,基于常规测量的生物标志物和治疗计划可能不再适用于老年女性[4]。在乳腺癌的分类中,三阴性乳腺癌(triple negative breast cancer,TNBC)是最具侵略性的一种,三阴性乳腺癌是指雌激素受体、孕酮受体和人表皮生长因子受体2 表达阴性的乳腺癌,由于与其他乳腺癌亚型患者相比,对三阴性乳腺癌患者进行内分泌或HER2 靶向治疗效果收效甚微,并且化疗的效果更差。TNBC 具有较高的癌症特异性死亡率,在我国也不例外[5⁃6]。因此对于三阴性乳腺癌的治疗面临着严峻的考验[7⁃9]。TNBC 多发于年轻女性,因此研究也较多。有关老年人TNBC 的研究发现60 岁以上的患者会出现与乳腺癌相关的基因变异[10]。因此,开发适用于所有年龄段TNBC患者开的预后标志物和治疗靶点是很有必要的。
MicroRNA 是1 类长度为18 ~25 个核苷酸的非编码内源性RNA。microRNA 可通过靶向mRNA,抑制后者翻译或降解,从而发挥重要的调控作用[11⁃12]。已有研究[13⁃16]证明,miRNA 在不同类型的肿瘤组织中表达异常。miRNAs 有望成为临床诊断和治疗肿瘤疾病的1 种新的肿瘤标志物。MiR⁃500a 在结直肠癌中发挥促癌作用[17],且可预测肝细胞癌患者的不良预后[18]。此外,在Fadi Abdel⁃Sater 的研究中,利用Taq⁃man 低密度阵列(TLDA)筛选TNBC 与正常乳腺组织中20 个差异表达的miRNA,其中miR⁃500a 表达差异较显著[20]。但是miR⁃500a 在TNBC 中的预后价值和生物学功能。
在本研究中,分析了miR⁃500a 在TNBC 临床组织样本和细胞样本中的表达状态。并进一步分析miR⁃500a 对TNBC 的总体生存预后的意义。通过细胞功能实验,分析了miR⁃500a 在TNBC 中的生物功能。以期为TNBC 的预后分层和治疗提供新的参考依据和靶点。
1 材料与方法
1.1 组织样本收集
收集2012年8月—2015年8月在郴州市第一人民医院确诊并实施手术的113 例TNBC 患者的肿瘤组织及相应的癌旁正常组织。所有TNBC 患者均按照世界卫生组织的标准[21]进行诊断。术后组织标本立即置于液氮中,保存备用。所有患者术前均未接受药物、放疗和化疗等治疗手段。5年的随访资料通过医院病历和电话访谈进行收集并记录。患者的临床病理信息见表1。
1.2 细胞培养
TNBC 细胞系MDA⁃MB⁃231、 HCC1937、 SUM149⁃PT、 HCC1187 和正常乳腺上皮细胞系MCF⁃10A 均购自中国科学院细胞库(中国,上海)。所有细胞系在37 ℃、5%CO2饱和湿度下,含10%胎牛血清的RPIM 1640培养基中培养(Invitrogen,Carlsbad,CA,美国)。
1.3 细胞转染
细胞转染miR⁃500a 模拟物、 miR⁃500a 抑制物和阴性对照按照Lipofectamine 2000 说明书(Thermo Fisher Scientific,Waltham,MA,美国)转染TNBC 细胞(以未转染的细胞作为空白对照组)。
1.4 总RNA 提取和实时荧光定量PCR
使 用 TRIzol 试 剂(Thermo Fisher Scientific,Waltham,MA,美国)提取TNBC 组织或细胞的总RNA,并使用NanoDrop 1000 (Thermo Fisher Scientific)验证其质量和数量。用TaqManmiRNA 逆转录试剂盒(Thermo Fisher Scientific)合成cDNA。在ABI 7500 PCR 系统上使用TaqManmiRNAPCR 定量试剂盒(Ther⁃mo Fisher Scientific)进行PCR 扩增和定量分析。2-ΔΔCt法计算miR⁃500a 的表达量。实验至少重复3 次。
1.5 细胞增殖实验
转染后细胞培养1 ~3 d,进行细胞增殖试验。CCK⁃8 法检测转染后的TNBC 细胞的增殖活性。10 μL CKK⁃8 溶液(Dojindo,Kumamoto,日本)添加到每个孔中,然后37 ℃培养2 h,450 nm 波长下检测细胞吸光度。
1.6 细胞迁移及侵袭试验
Transwell 法[22]用来检测细胞的侵袭和迁移能力。对于细胞侵袭能力的检测,Matrigel (BD Biosciences,San Jose,CA,美国)被预涂到transwell 的上室中。细胞密度为5×104个/孔,将含无血清培养基的细胞悬液100 μL 置于上室,并在下室中加入含10%胎牛血清的培养液500 μL (Thermo Fisher Scientific,Waltham,美国)。培养24 h 后,下室固定30 min,0.1%结晶紫染色20 min,每孔随机选取5 个视野进行计数统计。迁移试验与侵袭试验不同的是,Ttranswell 迁移室不需要预涂Matrigel 基质凝胶,其余步骤相同。
1.7 统计学分析
采用SPSS 20.0 和GraphPad 5.0 对数据进行统计学分析。实验结果以均数±标准差(±s)表示,组间差异采用单因素t检验或单因素方差分析。采用Kap⁃lan⁃Meier 法和Cox 回归分析预后意义。P<0.05 为差异有统计学意义。
2 结果
2.1 TNBC 组织和细胞中miR⁃500a 表达水平
通过qRT⁃PCR 检测miR⁃500a 的表达水平。如图1A 所示,miR⁃500a 在TNBC 组织中的表达水平明显高于癌旁组织(P<0.001)。同时,miR⁃500a 在4 种TNBC 细胞系(MDA⁃MB⁃231、 HCC1937、 SUM149PT、HCC1187)中的表达也显著高于正常乳腺细胞系(MCF⁃10A,P<0.001),见图1B。
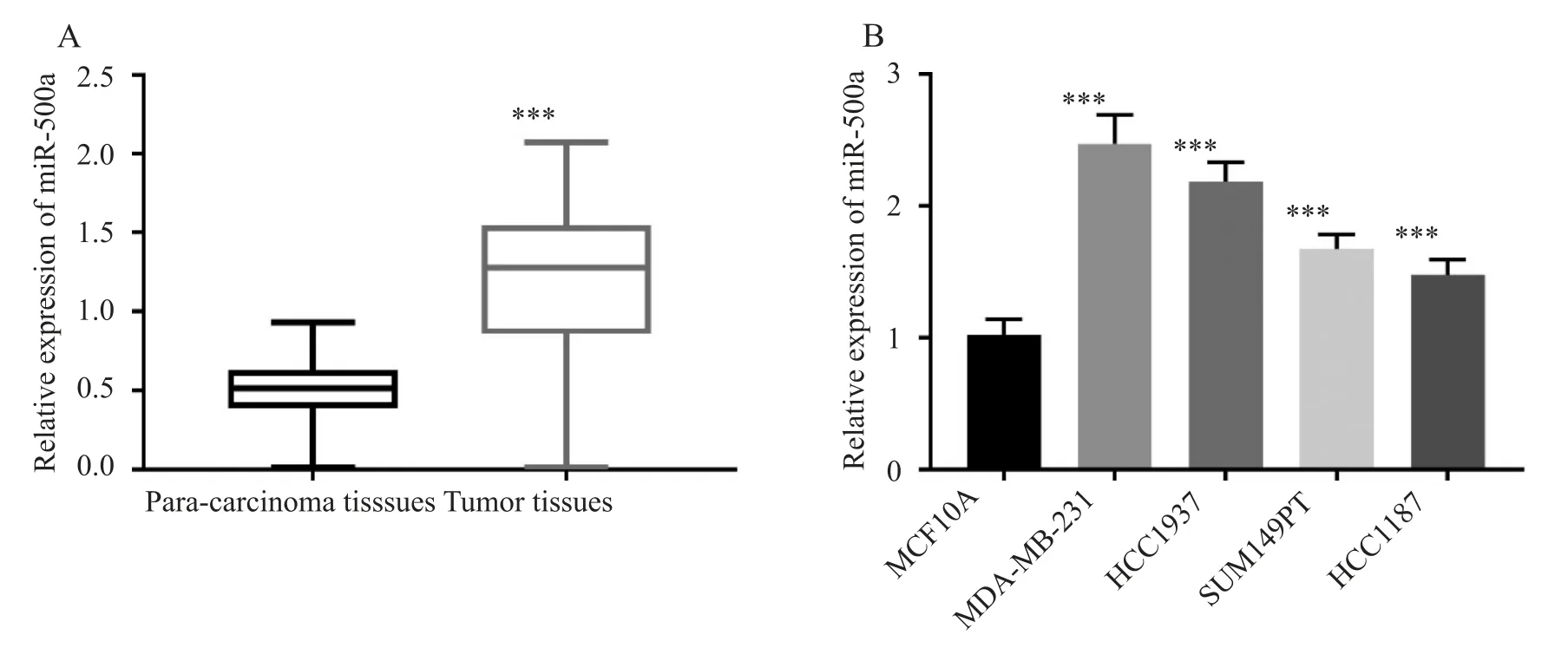
图1 miR⁃500a 在TNBC 组织和细胞系中过表达
2.2 TNBC 患者中miR⁃500a 表达水平与临床病理特征的关系
为了评估TNBC 患者中miR⁃500a 表达水平与临床病理特征之间的关系。将113 例TNBC 患者根据miR⁃500a 相对表达量的平均值(1.21)分组:高表达组(相对表达量大于1.21,n=60)和低表达组(相对表达量小于1.21,n=53)。miR⁃500a 在TNBC 组织中的表达与TNM 分期(P=0.032)和淋巴结转移(P=0.037)相关,而miR⁃500a 的表达与TNBC 患者的年龄、肿瘤大小和分化程度差异无统计学意义(P>0.05)。见表1。
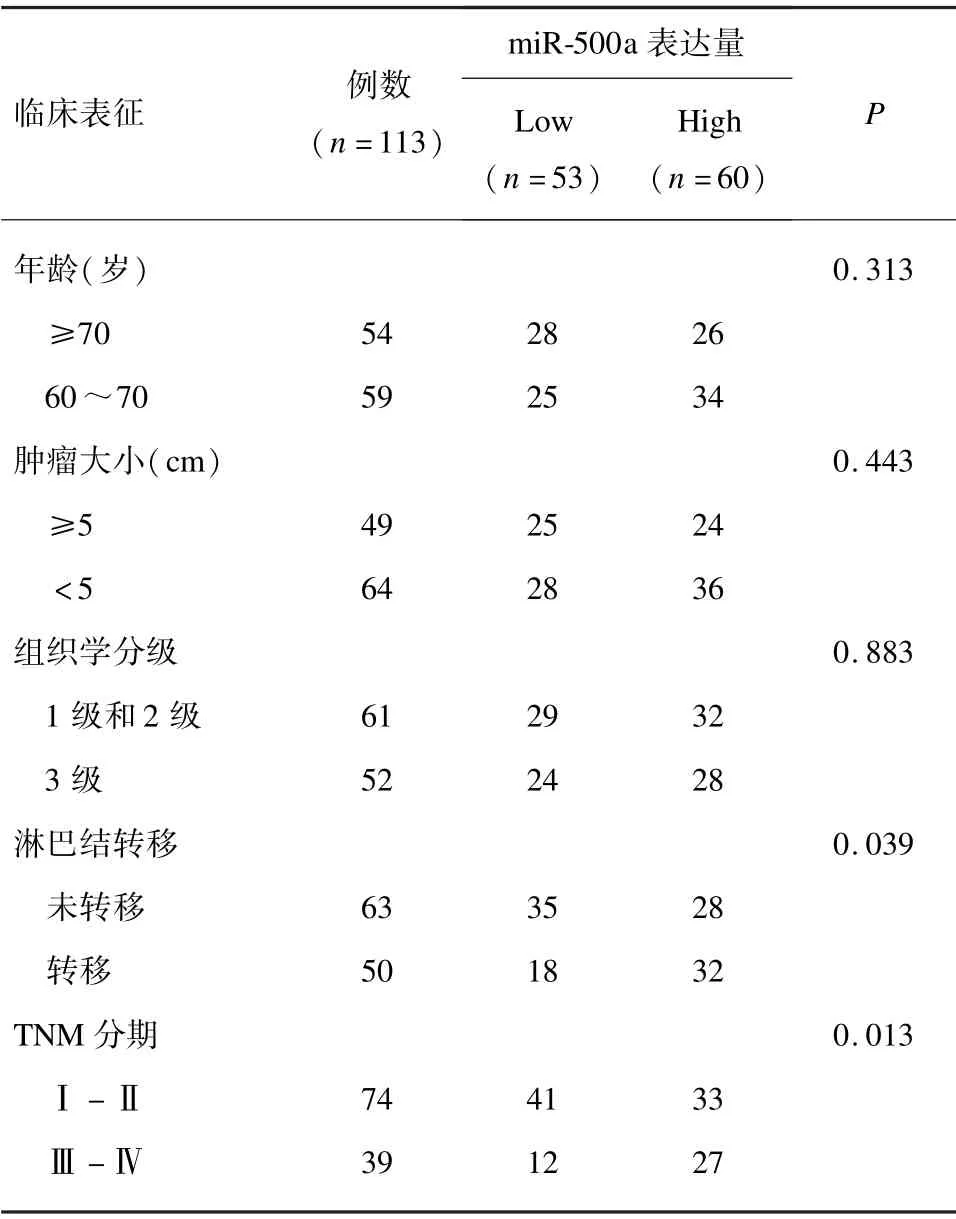
表1 miR⁃500a 表达水平与TNBC 患者临床病理参数的关系
2.3 miR⁃500a 的上调与TNBC 患者的不良预后相关
进一步评估了miR⁃500a 表达是否与TNBC 患者的预后相关。通过Kaplan⁃Meier 和log⁃rank test 分析方法,发现高表达组患者的总生存率明显低于低表达组(P=0.037),见图2。此外,多变量Cox 回归分析显示miR⁃500a(HR =3.700,P=0.026)、 TNM 分期(HR =3.196,P=0.035)和淋巴结转移(HR =2.633,P=0.035)是影响TNBC 患者总生存期的独立预后因素。见表2。
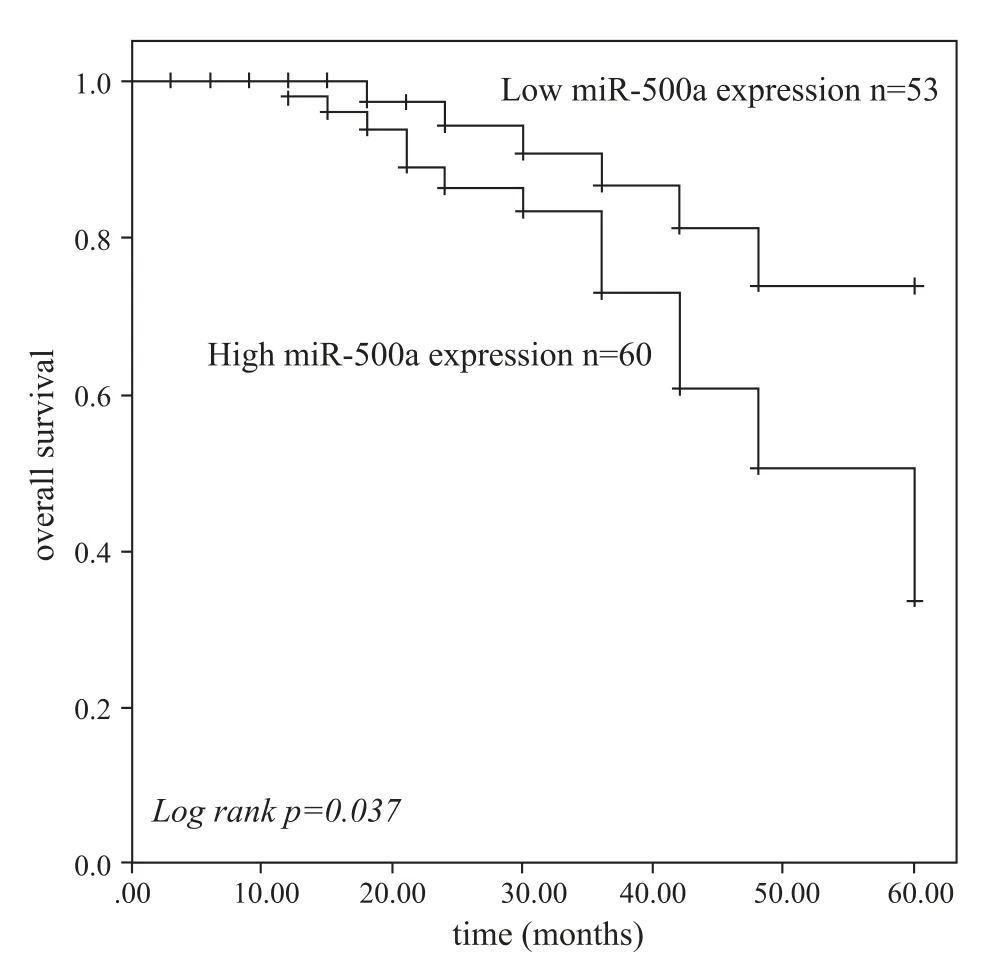
图2 TNBC 患者生存时间的Kaplan⁃Meier 曲线
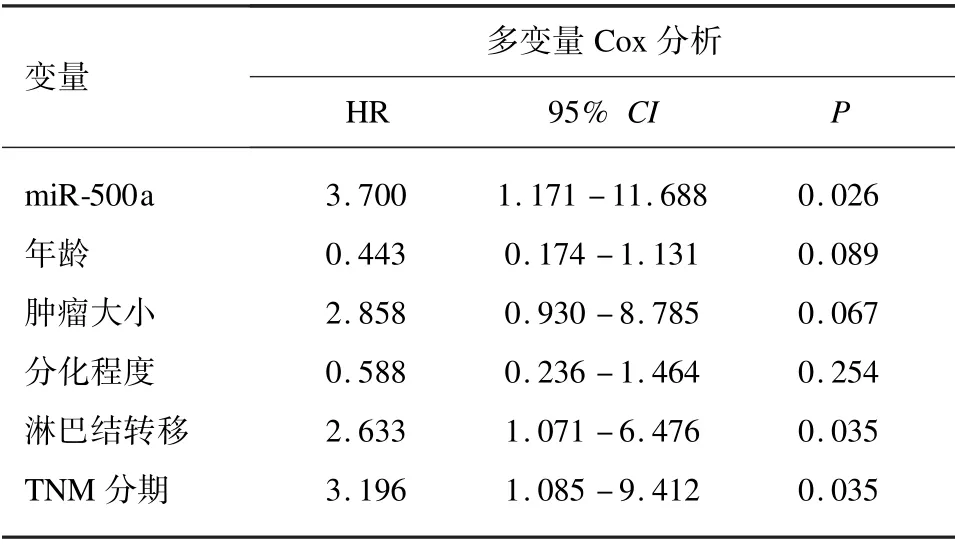
表2 总生存期独立危险因素的多因素Cox 回归分析
2.4 miR⁃500a 上调促进TNBC 细胞增殖、迁移和侵袭
利用qRT⁃PCR 分析检测miR⁃500a 在TNBC 细胞系中发挥的生物学作用。miR⁃500a 模拟物、 miR⁃500a抑制剂和阴性对照分别转染MDA⁃MB⁃231 和HCC1937细胞。如图3A 所示,与对照组相比,miR⁃500a 模拟物转染的TNBC 细胞中miR⁃500a 表达水平显著高于阴性对照,而miR⁃500a 抑制物转染的TNBC 细胞中miR⁃500a 表达水平显著低于阴性对照(P<0.001)。CCK⁃8 检测显示,与对照组相比,miR⁃500a 模拟物转染后促进细胞增殖,而miR⁃500a 抑制物转染后抑制细胞增殖(P<0.05),见图3B。
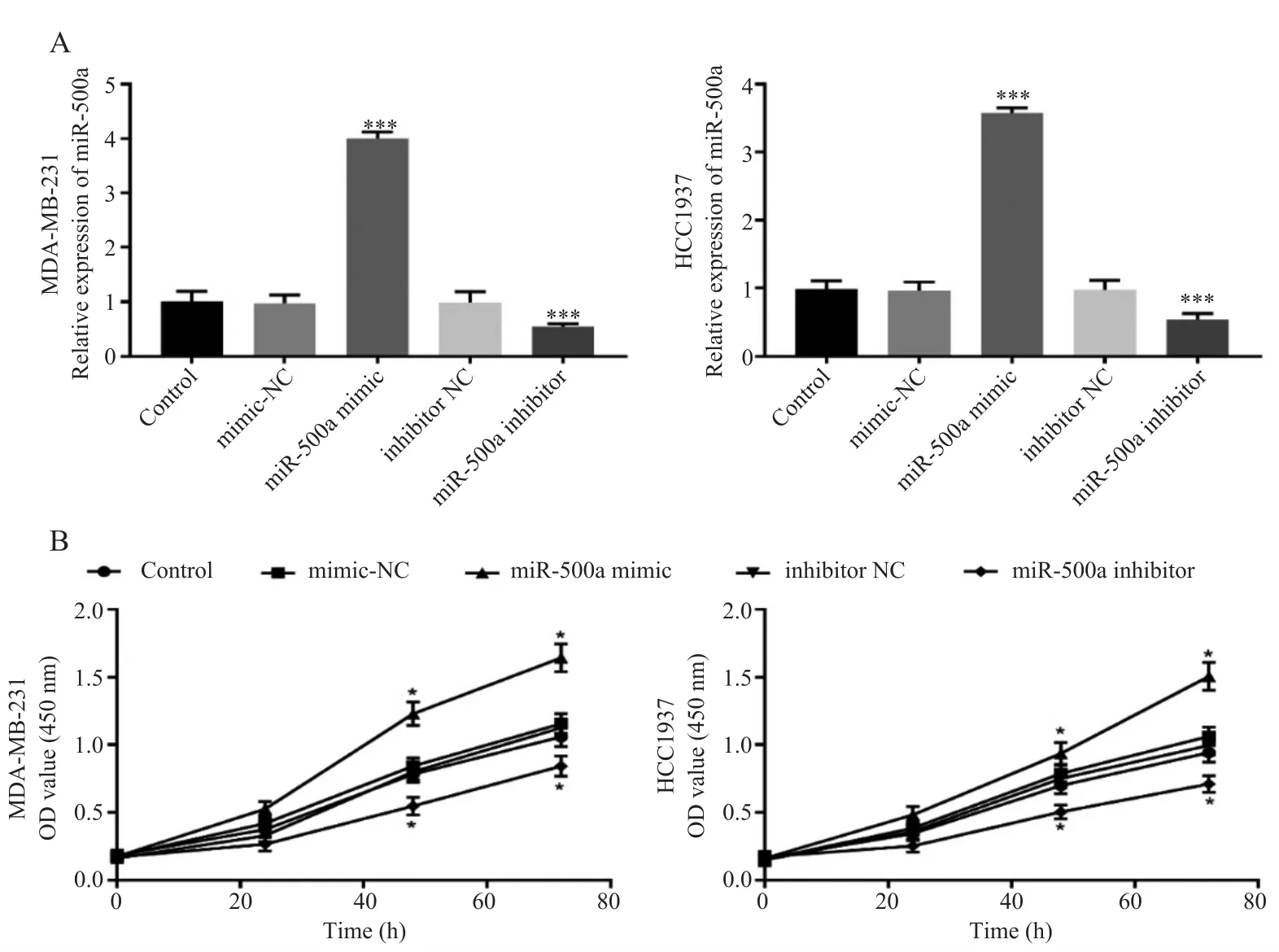
图3 miR⁃500a 表达水平对MDA⁃MB⁃231 和HCC1937 细胞系增殖的影响
采用Transwell 侵袭和迁移试验检测MDA⁃MB⁃231 和HCC1937 细胞的迁移和侵袭能力。结果表明,miR⁃500a 上调促进TNBC 细胞的侵袭和迁移能力,miR⁃500a 下调则有相反的作用(P<0.01)。见图4。
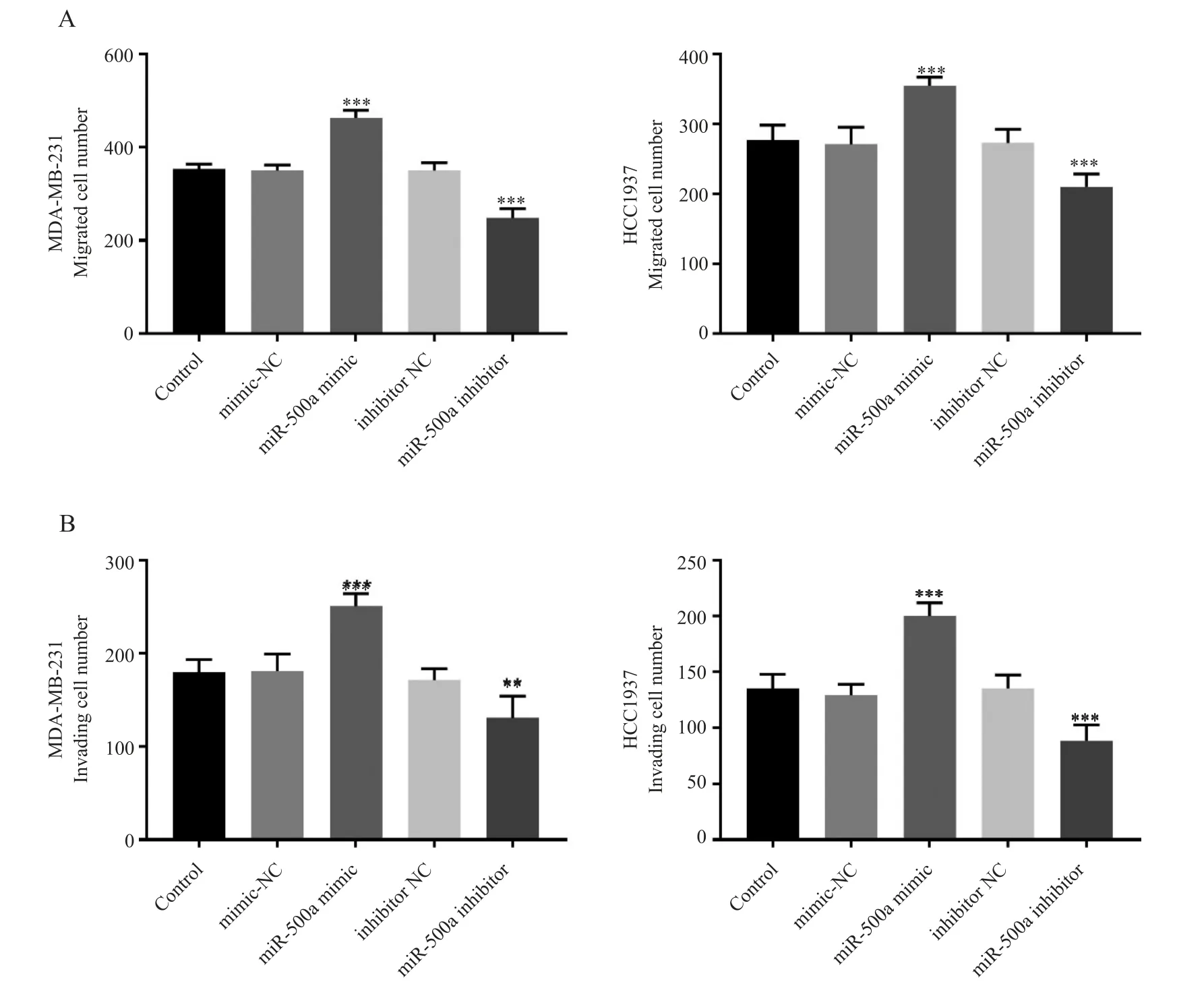
图4 miR⁃500a 对MDA⁃MB⁃231 和HCC1937 细胞迁移和侵袭能力的影响
3 讨论
TNBC 是乳腺癌的1 种亚型,具有特殊的生物学行为和临床病理特点,其预后较其他类型乳腺癌差[23]。TNBC 临床表现为侵袭性强,远处转移风险高。目前对TNBC 的治疗尚无明确的指南,治疗一般按常规标准治疗,但疗效不尽人意[24]。miRNAs 是许多领域研究的焦点,研究表明miRNAs 至少调控人类30%的编码基因[25]。这些miRNAs 广泛参与人类生理和病理活动的各个方面,包括细胞增殖、凋亡、分化、代谢、发育、造血、器官生成、病毒防御以及肿瘤的发生和发展。在与肿瘤的关系研究中,miRNA 表达的突变、缺失和变化被证明在人类肿瘤中发挥着与原癌基因或肿瘤抑制基因相似的作用[26]。
在本文中,首先研究了miR⁃500a 在TNBC 组织和细胞中的表达,结果表明,miR⁃500a 在TNBC 组织和细胞中具有异常高表达。miR⁃500a 的异常高表达不仅仅在TNBC 中存在,在很多其他癌症中,也有相似的表现,例如在肝细胞癌中,Jiang 等[27]同样利用qRT⁃PCR 证明了miR⁃500a 在肝细胞组织中具有过表达,同时揭示了miR⁃500a⁃3p 通过STAT3 途径促进肿瘤干细胞干性维持的新机制。在恶性胶质母细胞瘤中,miR⁃500a⁃5p 在肿瘤组织和细胞系中过表达,过表达的miR⁃500a⁃5p 促进胶质母细胞瘤细胞在体外的增殖、迁移和侵袭,证明了miR⁃500a⁃5p 可以作为胶质母细胞瘤患者诊断和预后的新型生物标志物[28]。TNM分期和淋巴结转移对恶性肿瘤的治疗和预后有着重要意义,因此评估了TNBC 患者的miR⁃500a 表达水平与临床病理特征的关系,发现miR⁃500a 在TNBC 组织中的表达与TNM 分期和淋巴结转移相关,这2 个因素同时也是影响TNBC 患者总生存期的独立预后因素。类似地,miR⁃155 在TNBC 组织中的相对表达量明显高于非肿瘤组织,而且这种异常表达与肿瘤分化程度和淋巴结转移有关,提示其具有预后价值[29]。低表达的miR⁃18a 则与TNBC 肿瘤大小和临床淋巴结状态相关,可用于不良预后的预测[30]。该研究探索了miR⁃500a 在TNBC 患者中的预后价值。研究结果证实,miR⁃500a 在可预测TNBC 的不良预后,有助于实现患者预后分层,为临床个体化治疗提供基础。
Guo 等[19]除了研究miR⁃500a 在肝癌中的异常高表达及其不良预后,还对miR⁃500a 在肝癌中的生物学作用和机制做了进一步的研究,发现miR⁃500a的上调促进了肝癌细胞系的迁移和侵袭。本研究也对miR⁃500a 在TNBC 中的生物学功能进行了相关的研究发现过表达的miR⁃500a 会促进TNBC 细胞的增殖、侵袭和迁移能力,这与上述结果一致。在结直肠癌中,miR⁃500a 也有相同的表现,低表达的miR⁃500a 抑制细胞生长和迁移,而过度表达miR⁃500a 则促进细胞生长和迁移;另外,miR⁃500a 被证明可能靶向磷酸酶和张力蛋白同源基因的3'⁃非翻译区。miR⁃500a 可能在大肠癌中起致癌作用[17]。本研究发现,在TNBC 中也发挥致癌基因的作用。因此,推测miR⁃500a 可能是作为TNBC 的致癌因子,参与了TNBC 的发生和发展。这提示miR⁃500a具有作为TNBC 治疗靶点的潜力。在本研究中,存在一些不足之处,例如样本量小,未能进行miR⁃500a在TNBC 中的靶基因试验等。在今后的工作中将扩大其样本量,并对miR⁃500a 在TNBC 中的发挥的机制进行更深入的研究。
总之,本研究表明miR⁃500a 在TNBC 组织和细胞系的表达明显高于正常组织和细胞系,且过表达的miR⁃500a 与TNBC 预后差、生存时间短有关。此外,高表达水平的miR⁃500a 促进TNBC 的细胞增殖、迁移和侵袭能力。这些结果表明miR⁃500a 可能作为一种预后分子标志物,旨在为TNBC 提供新的治疗策略。

