Thaulin-1多肽对耐药金黄色葡萄球菌的抗耐药性实验
赵恩亮
上世纪20 年代末,国外英国细菌学家、生物化学家、微生物学家亚历山大·弗莱明发现了青霉素[1],作为一种极具灭菌作用的抗生素药物[2],为人类的传染病控制开启了新的篇章[3]。近年来,抗生素的广泛应用为患者带来了诸多临床获益,但随着抗生素滥用引发的耐药情况也逐渐成为医学领域重点关注问题[4-6]。现阶段临床认为抗生素耐药性是影响医院感染以及重症患者感染死亡的主要影响因素[7-9],而耐万古霉素、耐甲氧西林的金黄色葡萄球菌为临床常见抗性菌株[10-11]。抗菌肽主要为生物天然防御系统中的重要组成部分,主要存在于动植物及微生物组织中[12-13],当前所发现抗菌肽种类已超过3 000 种,研究人员对抗菌肽结构分类的重视程度逐年升高[14-15]。研究观察了人工合成Thaulin-1 多肽对临床耐药金黄色葡萄球菌的抗耐药性,根据研究结果明确Thaulin-1 肽对多种临床常见菌的杀菌、抑菌作用,促进Thaulin-1 肽类物质作为新型抗生素基质的研究,为抗菌多肽药物的研发奠定基础。
1 材料与方法
1.1 采用多肽固相合成法合成Thaulin-1
(1)Rink amide MBHA 树脂的处理:使用天平准确称取250 mg 的Rink amide MBHA 树脂,用5 mL 的经脱水处理的二氯甲烷(dichloromethane,DCM)过夜浸泡,浸泡时间要超过12 h;
(2)Rink amide MBHA 树脂上Fmoc 保护基脱除:将过夜浸泡处理的Rink amide MBHA 树脂加入到多肽合成管中,采用真空减压抽滤系统彻底除去二氯甲烷(DCM)。加入10 mL 含有20%哌啶的二甲基甲酰胺(dimethyl formamide,DMF)剪切溶液,在恒温摇床以50 转/min 速度震荡20 min,采用真空减压抽滤系统除去合成管中的二甲基甲酰胺(DMF)剪切液。依次用二氯甲烷(DCM),异丙醇和二甲基甲酰胺(DMF)洗3 次。氨基酸保护基(Fmoc 保护基)脱除效率和多肽产率的密切相关,因此脱保护过程一定要重复进行。后面的连接过程中Fmoe 保护基脱除过程皆按照该步进行。
(3)活化氨基酸羧基及连接反应:使用天平准确称取0.8 mmol Fmoc-AA-OH,分别加入0.45 mmol HBTU,0.45 mmol HOBT 和220ulDIEA 后,在恒温摇床以50 转/min 速度震荡20 min 活化。将活化后的Fmoc-AA-OH 加入到合成管后,加入少量的DMF,再滴入几滴DCM,使树脂悬浮,在恒温摇床以50 转/min 速度震荡反应,(具体反应时间视氨基酸进行调整)
(4)茚三酮法检测:反应结束后,采用真空减压抽滤系统抽滤除去反应溶液,依次用二氯甲烷(DCM),异丙醇和二甲基甲酰胺(DMF)洗3 次。用不锈钢取样签蘸取少量的树脂加入到1.5 mL EP 管中,加入50 uL检测溶液A、B、C 混匀后,水浴加热5 min 后观察检测结果。若树脂为透亮黄色,则表明连接反应(3)反应完全,若树脂为蓝紫色,则表明反应不彻底,需要重复进行连接反应(3)。
溶液A:0.5 g 水合茚三酮溶于10 mL 乙醇中配制。
溶液B:8 g 熔融苯酚溶解在2 mL 乙醇中。
溶液C:9.8 mL 吡啶与0.2 mL KCN 溶液混匀。
(5)肽链上的Fmoc 保护基的脱除,具体操作同步骤2。
(6)重复3~5 步骤的反应,连接下一个氨基酸。
(7)Thaulin-1 肽N 端乙酰化:为提高多肽的稳定性,我们在合成的过程中,对Thaulin-1 肽进行N 端乙酰化处理。当Thaulin-1 肽序列连接完成之后,向合成管中加入10 mL 多肽剪切溶液,在恒温摇床以50 转/min 速度震荡20 min,真空减压抽滤系统除去合成管中的剪切溶液。依次用DCM.异丙醇和DMF 洗Rink amide MBHA 树脂3 次。加入4 mL DMF 后,再加入DCM 充分Rink amide MBHA 树脂。按0.2 mmol 树脂中加入500 uL乙酸酐,800 uL DIEA;在恒温摇床以50 转/min 速度震荡20 min,用DCM 冲洗3 次,用茚三酮方法检测乙酰化反应是否完全;检测反应完全后,依次用DCM(5 mL)、DMF(5 mL)、DCM(5 mL)、MeOH(5 mL)、DCM(5 mL)冲洗Rink amide MBHA 树脂3 次。采用氮气吹干方式,彻底除去树脂中的有机溶剂。
(8)Rink amide MBHA 树脂上Thaulin-1肽侧链保护基及多肽链的剪切:向氮气彻底吹干的Rink amide MBHA树脂中分别加入10 mL TFA/TIS/水(90%/5%/5%),在恒温摇床以50 转/min 速度震荡3 h。用G5 砂芯漏斗过滤剪切混合液到无水乙醚中沉淀多肽,通过真空冷冻干燥,得到Thaulin-1 肽粗品。利用制备型高效液相色谱反相柱技术进行分离纯化。利用WIDEPORE XB-C18 柱(4.6 mm×150 mm;3.6 µm particle size),应用AB 线性梯度(0.1% 乙腈/min),流速为1 mL/min,溶液A 是蒸馏水(0.1%三氟乙酸),溶液B 是色谱乙腈(0.1%三氟乙酸)。对制备得到的Thaulin-1 肽纯品进行质谱鉴定。
1.2 采用圆二色谱技术测定Thaulin-1 肽的二级结构
Thaulin-1 肽分子在不同介质中的结构将用圆二色谱来测定。50 mol/L 的磷酸缓冲液同时包含100 mol/L氯化钾(KP buffer:50 mol/L 磷酸二氢钾-磷酸氢二钾,100 mol/L 氯化钾,pH 7.4)的溶液将用来代表温和生理条件下的水介质。疏水介质用在50 mol/L 的磷酸缓冲液同时包含100 mol/L 氯化钾(pH 7.4)的溶液中加入三氟乙醇(TFE)(KP buffer:KCl=1:1)来代表。多肽分子的平均残基摩尔椭圆率用[θ]=θ/10lcMn 公式来计算,利用其在222 nm 的平均残基摩尔椭圆率来获得多肽的相对螺旋度。
1.3 采用微量肉汤稀释法测定Thaulin-1 肽抗菌活性
微量肉汤稀释法是测定抗菌肽的最低抑菌浓度MIC最常用的方法,相比纸片法和牛津杯法而言,微量肉汤稀释法操作简单,结果重现性高。从-80℃冰箱中取出冻存的细菌标准菌株和耐药菌株,涂布LB 固体培养基平板,37℃倒置培养24 h。挑取细菌单克隆菌落用MH 培养基180 转/min 培养,待细菌OD600 nm 达到0.4 以上后,用培养基稀释细菌的终浓度为5×105 CFU/mL。按90 µL/孔加入到96 孔板内,将抗菌肽梯度稀释(2 000µg/mL,1 800 µg/mL,1 600 µg/mL,1 400 µg/mL,1 200 µg/mL,1 000 µg/mL,800 µg/mL,600 µg/mL,400 µg/mL,200 µg/mL,100 µg/mL,50 µg/mL)后,按10 µL/孔加入,37℃培养24 h,测定OD590 nm,计算MIC。MIC 定义为杀死全部耐药细菌和标准株细菌的最低多肽浓度。
1.4 采用Thaulin-1 肽对人脐静脉内皮细胞作用测定细胞毒性
将冻存于液氮中的人脐静脉内皮细胞HUV-EC 取出,用37℃温水迅速化开后,无菌条件下(超净工作台紫外灯照射30 min 以上)接种到含20%血清(杭州四季青生物科技有限公司生产低内毒素、无支原体血清)的DMEM 高糖培养基中进行培养。用倒置显微镜观察,待细胞贴壁并正常分裂生长后,改用含10%血清进行培养。取指数生长期的HUV-EC 细胞用血球计数板计数,按0.5×105/L 细胞/孔接种到Corning 96 孔细胞培养板中,3 孔一组;培养24 h 后,待镜下观察细胞铺满80%以上后,加入Thaulin-1 肽(浓度同MIC 测定)作用24 h;吸取多肽药物,每孔再加入20 µL MTT(5 mg/mL)孵育4 h;轻轻吸出MTT 溶液,加入150 µL 二甲基亚砜来溶解活细胞产生的颗粒;用ELISA Reader 于550 nm 处测定各孔光密度;Thaulin-1 肽对人脐静脉内皮细胞HUV-EC 的毒性用抑制50%细胞存活率的多肽浓度(IC50)来衡量。未加入多肽溶液的孔作为阴性对照。
2 结果
2.1 多肽固相合成法合成Thaulin-1
Fmoc 固相合成是合成多肽的最高效方法之一。Thaulin-1 肽具有26 个氨基酸,按照其序列从C 端到N端合成(NGNLLGGLLRPVLGVVKGLTGGLGKK),记录每个氨基酸的连接时间。起始的7 个氨基酸合成,每步连接反应需要2 h 左右。中间部分的氨基酸连接,由于自聚集效应的存在,因此时间延长到8~12 h 左右,见表1。后续随着氨基酸链的延伸,反应时间有所减短,这与以往的合成时间类似。对合成完毕的Thaulin-1 肽,从树脂上切除下来并冻干后,使用HPLC 制备并通过质谱鉴定,见图1。Thaulin-1 肽理论分子量为2 572.11,质谱鉴定结果为2 571.40,表明序列合成无误,见表2。

图1 Thaulin-1 肽质谱鉴定结果
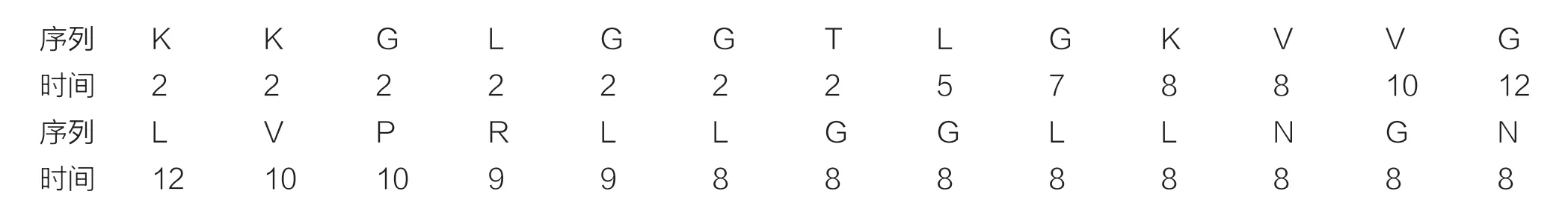
表1 Thaulin-1 肽Fmoc 固相合成中氨基酸反应时间(h)

表2 Thaulin-1 肽合成粗品的液相分析结果
2.2 Thaulin-1 肽对耐药菌的抗菌活性
人工合成Thaulin-1 肽对大肠杆菌和金黄色葡萄球菌进行初步活性测试,Thaulin-1 肽对两株菌株均表现出活性,Thaulin-1 肽具有正净电荷,根据实验结果分析,Thaulin-1 肽具有较高的抗菌活性,见表3。合成纯化和定量的Thaulin-1 肽和Gly-Thaulin-1 肽显示出相同的最小抑制浓度(MIC)与最小杀菌浓度(MBC)值,证明其作用机理主要是杀菌剂,不涉及明显的抑制阶段。通过MIC 和MBC 测定表现,Thaulin-1 肽及其类似物Gly-Thaulin-1 肽的活性没有差异,体现N-末端甘氨酸的存在不影响蛋白质的表达,不会改变Thaulin-1 肽的抗菌性能,见表4。

表3 Thaulin-1 肽对耐药菌的抗菌活性

表4 Thaulin-1 与Gly-Thaulin-1 的抑菌活性测定(μg/mL)
2.3 Thaulin-1 肽对耐药菌株细胞毒性作用
Thaulin-1 肽对人细胞的毒性很小,检测结果表现Thaulin-1 和Gly-thaulin-1 对革兰氏阴性菌细胞有选择性作用,但对人类细胞存在一定保护作用。
3 讨论
金黄色葡萄球菌主要为葡萄球菌属,隶属于革兰氏阳性菌,是临床中比较常见的致病菌。近年来,国内外临床广泛使用抗生素药物,致使耐药性金黄色葡萄球菌问题越来约为严重,而耐药性金黄色葡萄球菌感染也逐渐成为临床所面临的严重问题,部分患者呈现多重耐药表现,对临床医疗形成较大困难。抗菌肽主要为生物天然防御系统中的重要组成部分,主要存在于动植物及微生物组织中,当前所发现抗菌肽种类已超过3 000 种,研究人员对抗菌肽结构分类的重视程度逐年升高。在本次研究中主要分析了人工合成Thaulin-1 多肽对临床耐药金黄色葡萄球菌的抗耐药性,通过获得结果评价Thaulin-1 肽对多种临床常见菌的杀菌、抑菌作用,进而为抗菌多肽药物的研发提出可靠建议。
Thaulin-1 肽具有抗质控菌株金黄色葡萄球菌标准株ATCC 29213 和大肠埃希菌标准株ATCC 25922 活性,但Thaulin-1 肽抗临床耐药菌株活性和作用机制尚未见诸报道。本文以Fmoc 固相合成Thaulin-1 肽和临床检验工作分离得到的耐药菌株为对象,探索Thaulin-1 对耐药菌的抗菌活性和作用机制进行研究。
本项试验结果体现,Thaulin-1 肽具有26 个氨基酸,按照其序列从C 端到N 端合成(NGNLLGGLLRPV LGVVKGLTGGLGKK),记录每个氨基酸的连接时间。起始的7 个氨基酸合成,每步连接反应需要2 h 左右。中间部分的氨基酸连接,由于自聚集效应的存在,因此时间延长到8~12 h 左右。后续随着氨基酸链的延伸,反应时间有所减短,这与以往的合成时间类似。对合成完毕的Thaulin-1 肽,从树脂上切除下来并冻干后,使用HPLC 制备并通过质谱鉴定。Thaulin-1 肽理论分子量为2 572.11,质谱鉴定结果为2 571.40,表明序列合成无误。人工合成Thaulin-1 肽对大肠杆菌和金黄色葡萄球菌进行初步活性测试,Thaulin-1 肽对两株菌株均表现出活性,Thaulin-1 肽具有正净电荷,根据实验结果分析,Thaulin-1 肽具有较高的抗菌活性。合成纯化和定量的Thaulin-1 肽和Gly-Thaulin-1 肽显示出相同的最小抑制浓度(MIC)与最小杀菌浓度(MBC)值,证明其作用机理主要是杀菌剂,不涉及明显的抑制阶段。通过MIC 和MBC 测定表现,Thaulin-1 肽及其类似物Gly-Thaulin-1 肽的活性没有差异,体现N-末端甘氨酸的存在不影响蛋白质的表达,不会改变Thaulin-1 肽的抗菌性能。此外,Thaulin-1 肽对人细胞的毒性很小,检测结果表现Thaulin-1 和Gly-thaulin-1 对革兰氏阴性菌细胞有选择性作用,但对人类细胞存在一定保护作用。

