转铁蛋白受体对铁过载所致大鼠心肌细胞铁死亡的作用及其机制
杨岚婷,徐涛,2,杨福情,肖丹丹,宋林,王建勋*
1青岛大学基础医学院,山东青岛 266000;2青岛农业大学中心实验室,山东青岛 266109
铁是多细胞生物和几乎所有微生物的必需微量元素,也是人类饮食中主要的微量营养素之一[1]。铁缺乏会对冠状动脉疾病、心力衰竭和肺动脉高压患者产生不利影响[2]。近年来相关研究显示,除铁缺失导致的机体紊乱外,铁过载也会给机体造成严重伤害,表现为活性氧的产生增加,进而导致细胞功能障碍或死亡、组织和器官损伤[3-4]。铁蛋白和转铁蛋白能够降低细胞内铁水平,位于细胞膜上的转铁蛋白受体(transferrin receptor,TFRC)可与携带游离铁的转铁蛋白结合,将细胞外铁转运到细胞内,提高细胞内铁水平,对维持细胞铁稳态具有重要作用[5]。2012年哥伦比亚大学Dixon等[6]报告,铁死亡是一种依赖于铁离子的程序性死亡机制,细胞中脂质过氧化产物的大量累积是铁死亡的明显特征之一。已有研究报道铁死亡是治疗心肌病的一个重要靶标,在心脏缺血再灌注损伤中伴随着大量脂质过氧化物的产生[7-10]。但铁过载是否通过铁死亡参与心脏疾病发生发展的研究较少。基于铁稳态和铁死亡与心脏疾病的密切联系,TFRC作为调节铁代谢的重要分子是否通过铁死亡参与心脏疾病值得进一步探讨。本研究观察了铁过载对小鼠心脏功能以及H9C2大鼠心肌细胞铁死亡的影响,以探讨TFRC在心肌细胞铁死亡中的作用机制。
1 材料与方法
1.1 细胞和试剂 H9C2大鼠心肌细胞,通过传代扩增获得;高糖DMEM培养基购于大连美仑公司;胎牛血清(FBS)购于广州赛国生物科技有限公司;0.25%胰酶消化液购于武汉赛维尔生物科技有限公司;青霉素-链霉素、SDS-PAGE凝胶试剂盒购于苏州新赛美生物科技有限公司;超敏ECL发光液、反转录试剂盒(HiScript Ⅲ RT SuperMix for qPCR)、染料法定量PCR检测试剂盒(SYBR qPCR Master Mix)购于南京诺唯赞生物科技股份有限公司;BODIPY®581/591 C11染料、柠檬酸铁铵(AIC)和铁死亡诱导剂爱拉斯汀(Erastin)购于美国Sigma公司;PBS缓冲液、碘化丙啶(propidium iodide,PI)染料、丙二醛(MDA)含量检测试剂盒、5×蛋白上样缓冲液、RIPA组织/细胞裂解液购于北京索莱宝科技有限公司;铁死亡抑制剂Ferrostatin-1(Fer-1)购于美国Selleck公司;TFRC兔单克隆抗体和谷胱甘肽过氧化酶4(GPX4)兔单克隆抗体购于英国 Abcam 公司;β-actin兔单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG(H+L)二抗购于武汉 ABclonal 公司;TFRC的小干扰RNA(small interfering RNA,siRNA)寡核苷酸购于上海吉玛公司; jetPRIME® 转染试剂购于法国Polyplus 公司。
1.2 实验动物及分组 C57BL/6J雄性小鼠14只,8周龄,体重18~22 g,购于济南朋悦实验动物繁育有限公司[实验动物生产许可证号:SCXK(鲁)2019-0003],采用标签法随机抽样分为高铁饮食组和正常饮食组,每组7只。高铁饮食组小鼠连续喂食高铁饲料(2.41 g元素铁/kg)8周;正常饮食组小鼠连续喂食常规饲料(36.54 mg 元素铁/kg)8周。小鼠16周龄时行动物超声检查,并取其心脏组织进行相关分析。所有动物实验均经青岛大学医学部动物福利伦理委员会(20210510C571420210710011)和使用委员会审批通过。
1.3 小鼠心脏组织MDA含量检测 使用MDA含量检测试剂盒(索莱宝,BC0025)检测小鼠心脏组织MDA含量,按说明书方法进行操作,采用酶标仪测定各样本在450 nm、532 nm和600 nm波长的吸光度。
1.4 Masson染色检测心肌组织纤维化情况 石蜡切片烘干后脱蜡至水,按照Masson染色试剂盒说明书进行操作,中性树胶封片。在奥林巴斯IX73型研究级倒置显微镜下观察心肌组织纤维化情况并拍照。用Image J软件进行图像分析,计算胶原沉积面积。
1.5 细胞培养 用含有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的高糖DMEM培养H9C2大鼠心肌细胞。H9C2细胞始终生长在5% CO2、37 ℃的培养箱中;分别用50、100、200、300、500 μmol/L AIC,10 μmol/L Fer-1或5 μmol/L Erastin,在指定时间处理细胞24 h。
1.6 RNA干扰敲低TFRCTFRC的特异性siRNA寡核苷酸序列为 5'-CCUAAAUCUUCUCGCUUAUTT-3';阴性对照为 5'-UUCUCCGAACGUGUCACGUTT-3'。通过Nucleotide BLAST与GenBank中的所有其他序列进行比较,确定该siRNA寡核苷酸序列的特异性。使用 jetPRIME® 转染试剂,根据制造商说明书进行siRNA转染,以敲低TFRC的表达。实验中使用六孔板培养细胞,将200 μl jetPRIME® 缓冲液、1524 ng siRNA或阴性对照RNA、4 μl jetPRIME® 转染试剂混匀后,室温静置10 min加入孔板中。
1.7 细胞死亡率检测 将H9C2细胞接种到6孔板中,用AIC、Fer-1或Erastin处理24 h后,将6孔板从培养箱中取出,去掉培养基,PBS洗涤3遍后加入500 μl胰酶,消化1 min后将细胞转移到1.5 ml EP管中并吹打至单个细胞。4 ℃、1000 r/min离心5 min,弃上清,加入1 ml PI(1.5 μmol/L)工作液重悬后置于4 ℃摇床孵育20 min。4 ℃、1000 r/min离心5 min,弃上清,用1 ml PBS 洗涤。4 ℃、1000 r/min离心5 min,弃上清,用1 ml PBS 重悬,过滤后用流式细胞仪检测。
1.8 细胞脂质过氧化物检测 将H9C2细胞接种到6孔板中,用AIC或Erastin处理24 h后,将6孔板从培养箱中取出;加亲脂荧光染料C11(2 μmol/L)放置于37 ℃培养箱避光染色30 min。将染色后的培养基收集到15 ml离心管中,PBS洗涤3遍后加入500 μl胰酶,消化1 min后将细胞转移到相应的15 ml离心管中。1000 r/min离心5 min,弃上清,用1 ml PBS洗涤细胞。1000 r/min离心5 min,弃上清,加1 ml PBS重悬细胞,过滤后用流式细胞仪检测,观察脂质过氧化物相对含量。
1.9 Western blotting检测相关蛋白表达 将H9C2细胞接种到6孔板中,按实验分组进行加药处理或转染,在指定时间将6孔板从培养箱中取出置于冰上。用PBS洗涤3遍后每孔加入100 μl含有PMSF的裂解液。用细胞刮将细胞刮取至1.5 ml EP管中,冰上裂解20 min。4 ℃、12 000 r/min离心15 min,吸取75 μl上清于新的EP管中,每管加25 μl 4×蛋白上样缓冲液,金属浴98 ℃加热10 min。蛋白样品用12.5%的SDS-PAGE凝胶进行电泳分离,然后转移到0.45 μm的硝酸纤维膜上,5%脱脂牛奶封闭1 h;兔单克隆抗体TFRC 一抗(1:1000稀释)、兔单克隆抗体GPX4 一抗(1:1000稀释)、兔单克隆抗体β-actin(1:10 000稀释)4 ℃孵育过夜;HRP标记的山羊抗兔IgG(H+L) 二抗(1:5000稀释)室温孵育1 h,使用超敏ECL发光液显影。实验重复3次。
1.10 qRT-PCR检测TFRCmRNA表达水平 采用Trizol法提取细胞总RNA,根据反转录试剂盒说明书将1 μg RNA反转录为cDNA。使用SYBR Green Master Mix试剂盒和CFX96 qRT-PCR仪进行检测,总反应体系为20 μl [SYBR 10 μl、Primer1(10 μmol/L)0.4 μl、Primer2(10 μmol/L) 0.4 μl、Template cDNA 1 μl、ddH2O 8.2 μl]。反应条件:95 ℃、30 s,95 ℃、10 s,60 ℃、30 s,40个循环;95 ℃、15 s,60 ℃、60 s,95 ℃、15 s。设置3个复孔,实验重复3次。采用2-ΔΔCt法计算目的基因的相对表达量,以GAPDH为内参照。相应引物序列见表1。
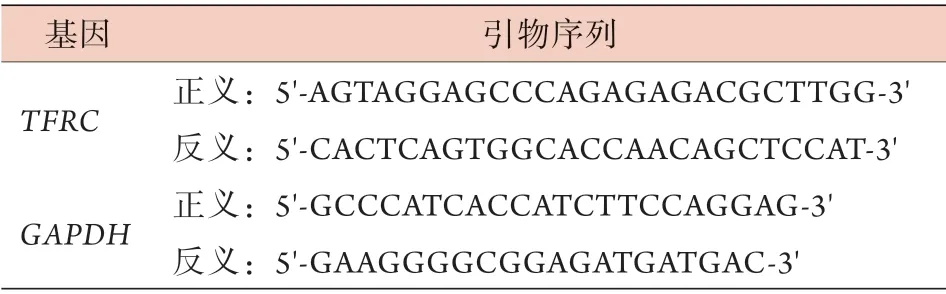
表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.11 统计学处理 采用GraphPad Prism 8.3.0软件进行统计分析。计量资料以±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 高铁饮食对小鼠心脏组织的影响 超声心动检查结果显示,与正常饮食组比较,高铁饮食组小鼠心室间隔厚度(IVSd)和左心室后壁厚度(LVPWd)明显增大[(0.96±0.12) mmvs. (0.73±0.09) mm,(1.18±0.28) mmvs. (0.84±0.07) mm,P<0.05],左室射血分数[EF(%)]和左心室缩短分数[FS(%)]差异无统计学意义(67.59%±13.13%vs.74.96%±7.63%,35.39%±9.18%vs.38.28%±8.56%,P>0.05)。与正常饮食组比较,高铁饮食组小鼠心脏组织MDA相对含量和心肌胶原沉积相对面积均明显增加(2.08±0.80vs.1.00±0.50,4.04±0.60vs.1.00±0.21,P<0.05,图1)。
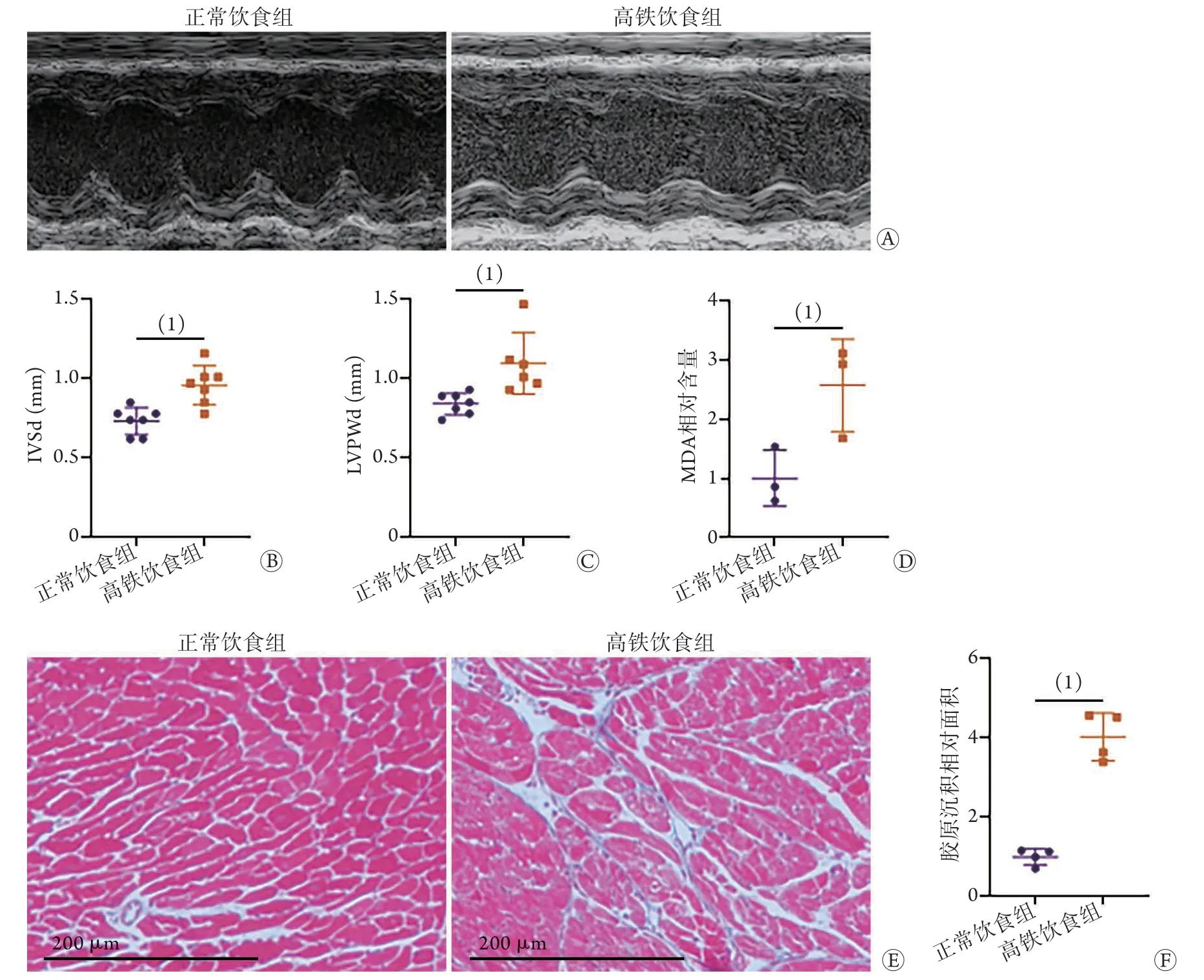
图1 高铁饮食诱导小鼠心肌组织的变化(n=4)Fig.1 Changes of myocardial tissue of mice induced by high-iron diet (n=4)
2.2 高铁环境对大鼠心肌细胞死亡率和脂质过氧化物水平的影响 H9C2大鼠心肌细胞给予不同浓度(50、100、200、300、500 μmol/L)AIC处理2 4 h 后,随着A I C 浓度增加,细胞死亡率(0.37%±0.06%,8.3%±0.17%,11.23%±0.21%,21.87%±1.43%,30.3%±0.98%)逐渐增高,差异有统计学意义(P<0.05);其中AIC浓度为500 μmol/L时细胞死亡率明显高于其他浓度(P<0.05,图2A)。分别用PI染色和C11染色检测对照组、500 μmol/L AIC组及AIC+Fer-1组(500 μmol/L AIC+10 μmol/L Fer-1)的细胞死亡率(图2B)和脂质过氧化物含量(图2C、D),结果显示,AIC组细胞死亡率和脂质过氧化物相对含量均高于对照组(33.73%±1.20%vs.2.30%±1.73%,5.36±0.06vs.1.00±0.19,P<0.05);AIC+Fer-1组的细胞死亡率和脂质过氧化物相对含量均低于AIC组(19.63%±0.81%vs.33.73%±1.20%,2.03±0.12vs.5.36±0.06,P<0.05)。
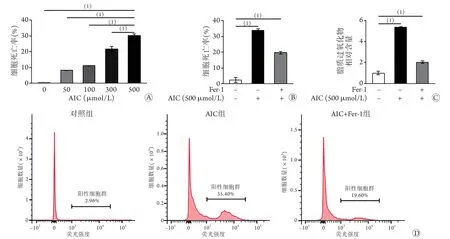
图2 AIC与Fer-1处理后H9c2大鼠心肌细胞死亡率和脂质过氧化物含量变化(n=3)Fig. 2 Death rate and lipid peroxide content of H9c2 rat's cardiomyocytes treated with AIC and Fer-1 (n=3)
2.3 高铁环境下大鼠心肌细胞TFRC表达变化Western blotting检测结果显示,与处理前比较,H9C2大鼠心肌细胞采用500 μmol/L AIC处理24 h后,TFRCmRNA相对表达水平升高(2.78±0.45vs.1.00±0.13,P<0.05),TFRC蛋白相对表达水平也升高(3.08±0.03vs.1.00±0.03,P<0.05,图3A、B),而GPX4相对表达水平无明显变化(1.07±0.06vs.1.00±0.01,P>0.05,图3C)。
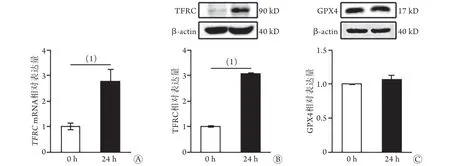
图3 AIC处理后H9C2大鼠心肌细胞TFRC表达水平的变化Fig.3 Changes on expression levels of TFRC in H9C2 rat's cardiomyocytes treated with AIC
2.4 敲低TFRC对AIC处理的大鼠心肌细胞死亡率及脂质过氧化物含量的影响 H9C2大鼠心肌细胞转染TFRC的siRNA(TFRC-si)后,Western blotting检测结果显示,TFRC mRNA相对表达量明显下降(0.54±0.01vs.0.97±0.01,P<0.05,图4A);PI染色和C11染色结果显示,转染TFRC-si后,经AIC处理的H9C2大鼠心肌细胞死亡率和脂质过氧化物相对含量均明显下降(14.13%±0.06%vs.26.2%±0.51%,3.35±1.07vs.5.28±0.65,P<0.05,图4B、C)。
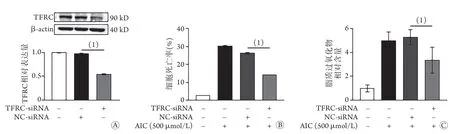
图4 敲低TFRC后AIC处理的H9C2大鼠心肌细胞死亡率和脂质过氧化物含量变化Fig.4 Lower death rate and lipid peroxide content of H9C2 rat's cardiomyocytes treated with AIC after TFRC knocked down
2.5 敲低TFRC对Erastin处理的大鼠心肌细胞GPX4表达和细胞死亡率的影响 Western blotting检测结果显示, Erastin处理24 h后,H9C2大鼠心肌细胞GPX4相对表达水平明显降低(0.45±0.00vs.1.00±0.01,P<0.05),TFRC相对表达水平明显升高(1.22±0.07vs.1.00±0.08,P<0.05,图5A);转染TFRC的si-RNA敲低TFRC后,PI染色结果显示,Erastin处理的H9C2细胞死亡率明显降低(17.47%±0.47%vs.31.80%±1.22%,P<0.05,图5B)。
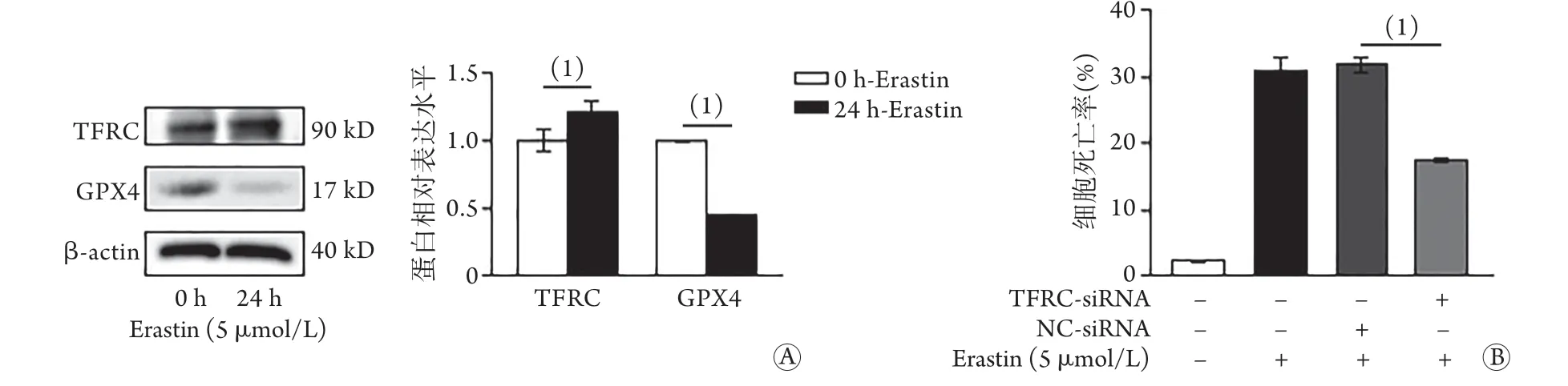
图5 敲低TFRC对Erastin处理的H9C2大鼠心肌细胞TFRC和GPX4蛋白表达及细胞死亡率的影响Fig.5 Influence on the cell mortality and the expressions of TFRC and GPX4 proteins of H9C2 rat's cardiomyocytes treated with Erastin after TFRC knocked down
3 讨 论
细胞死亡是一个基本的生理过程。正常的细胞死亡有利于生物体的增殖、分化、发育和代谢;而非正常细胞死亡可诱发多种疾病发生,如神经细胞、骨骼肌细胞、心肌细胞等处于终末期分化的细胞大量死亡,可造成神经障碍、肌肉萎缩或心力衰竭等多种疾病的发生[11]。因此,对细胞死亡的精准调控可能对部分疾病的治疗十分关键。目前已报告细胞凋亡、坏死、自噬、焦亡等多种细胞死亡方式[12-13],而铁死亡作为细胞死亡的方式之一,被越来越多的学者关注;对铁死亡的深入研究可能为疾病治疗提供更多有效靶点。由于血红蛋白具有运输和储存氧气的作用,铁稳态对维持生命体正常的生物功能十分重要,对于维持心血管健康尤为重要[6]。铁过载时,细胞内增加的亚铁离子与过氧化氢发生芬顿反应,催化羟基自由基(OH.)生成,导致细胞膜脂质过氧化,进而发生细胞死亡,这种细胞死亡方式被称为铁死亡。铁死亡虽然也是一种程序性细胞死亡方式,但其在形态学和生物化学上与凋亡和坏死截然不同。铁死亡依赖于铁和活性氧(ROS),脂质过氧化物的积累为其主要特征。
心脏是人类和脊椎动物循环系统驱动力的来源[14]。心力衰竭的发病率和病死率均较高,是造成人类死亡的重要原因之一。处于终末分化的心肌细胞损失是致死性心力衰竭发展过程中的一个关键病理因素,但心肌细胞死亡的具体机制尚不完全清楚。铁死亡最早报告于癌细胞,有多项研究报道了铁死亡与癌症的关系。近年一些研究显示,心肌损伤过程中存在铁过载现象[15-17]。本研究结果显示,连续8周的高铁饮食可引起小鼠心脏IVSd和LVPWd明显增加,但EF和FS与正常饮食组差异不明显且在正常范围,提示尚未出现明显的心功能障碍。之前有研究报告IVSd、LVPWd增加是慢性心脏缺血的表现,是肥厚型心肌病的前兆[10]。据此,我们推测,长期高铁饮食对心脏存在较大危害,可能加重心肌梗死、缺血再灌注损伤等引起的心脏疾病。本研究结果还显示,连续8周的高铁饮食导致小鼠心脏组织MDA含量和胶原沉积面积增加,提示高铁饮食可能促进小鼠心肌细胞损伤和纤维化的发展。据此推测,小鼠心肌细胞损伤可能与高铁饮食引起的铁死亡有关,但尚需进一步验证。
由于心脏的高能量需求,铁过载对心脏功能有较为不利的影响,可加剧心力衰竭。心力衰竭是血色病和β-地中海贫血较为常见的死亡原因,其特征是原发性或输血引起的铁超负荷[18-20]。2014年,一项纳入131 553名参与者和2459例冠心病患者的荟萃分析显示:与摄入量较低的参与者相比,血红素铁摄入量较高的参与者患冠心病的风险增加了31%[21]。2019年,浙江大学王福俤教授团队报告铁死亡是对抗心肌病的有效靶点;阿霉素(DOX)处理小鼠后,上调的血红素加氧酶1将血红素降解为大量非血红素铁,进而诱发急性心肌病,而高铁饮食可加重DOX诱发的心肌损伤;此外,还报告缺血再灌注手术组小鼠心脏非血红素铁和铁蛋白mRNA表达水平明显升高[15]。因此,从铁过载引起的铁死亡入手,寻找治疗心脏疾病的新靶标可能会成为未来心脏疾病机制研究的焦点。铁稳态对于哺乳动物细胞的正常运作至关重要。TFRC作为铁离子进入细胞的“看门人”,在心肌细胞铁代谢调控中发挥核心作用,但具体调控机制尚待进一步研究。本研究结果显示,通过靶向TFRC能够减少铁过载引起的大鼠心肌细胞死亡,该结果可能为心脏疾病的治疗提供新的思路。
抑制半胱氨酸摄取或促进脂质修复酶GPX4的失活可诱导铁死亡的发生。一项定量蛋白质组学分析显示,心肌梗死期间GPX4下调可导致心肌细胞铁死亡;RNA测序和qRT-PCR分析显示GPX4下调发生在转录水平,并可促进脂质过氧化物的积累,导致H9C2心肌细胞铁死亡[22]。在流行病学研究中,人类GPX4基因变异与肥胖和心血管疾病有关。代谢相关研究发现,GPX4在脂质过氧化物导致肥胖发生的心脏代谢紊乱中发挥关键作用[23-24]。一项关于诱导型GPX4敲除小鼠和肝脏缺血再灌注的研究显示,Fer-1可减轻GPX4敲除小鼠中铁死亡的发生,同时可减轻缺血再灌注引起的肝损伤[25]。王福俤教授团队报告,Fer-1和铁螯合剂能够减轻缺血再灌注损伤引起的小鼠心肌肥大和心肌梗死,提示铁死亡可作为对抗心肌病的靶标[15]。研究发现,镰刀型贫血症小鼠模型中血红素诱导的血红素加氧酶1可通过铁死亡驱动心肌病,而抑制铁死亡能够减轻镰刀型贫血相关的心肌病[26]。本研究显示,大鼠心肌细胞在高铁环境诱导下TFRC表达增加,但GPX4的表达变化不明显,提示TFRC介导的铁过载诱导的心肌细胞铁死亡中可能没有GPX4的参与。我们推测,高铁诱导的铁死亡主要通过增强脂质过氧化而发生,而GPX4介导的活性氧清除对其影响不显著。本研究中使用Erastin处理心肌细胞后,GPX4表达下调,与其他相关研究一致[27-28];TFRC表达上调,提示TFRC可能在铁死亡发生的多个通路中发挥作用。上述结果提示,不同诱导条件或不同病理因素作用下,铁死亡发生的调控机制有所不同,具体机制尚待进一步深入研究。
综上所述,铁死亡是一种普遍且动态的细胞死亡形式,参与多种疾病的发生发展,铁死亡抑制剂有望对细胞提供实质性的保护。本研究初步观察了铁过载对正常小鼠心脏结构和功能的影响,但尚缺乏铁过载对小鼠心肌损伤影响的深入探讨;本研究也为靶向TFRC调控大鼠心肌细胞死亡提供了证据,为未来探索心脏疾病治疗的新策略,如通过调节铁代谢来缓解心力衰竭等提供了思路。

