载阿替普酶磁性明胶纳米粒的构建及其溶栓作用研究
张文丽,郭大静,王俊锐,钟毅欣,冉海涛,张瑜*
1重庆医科大学附属第二医院放射科,重庆 400010;2超声分子影像重庆市重点实验室,重庆 400010
血栓形成是各类血栓性疾病如急性肺动脉栓塞、急性心肌梗死和深静脉血栓形成等的主要发病机制。当前临床治疗血栓性疾病的首选方式是静脉注射纤溶药物,利用药物激活纤溶酶活性,分解由致密纤维蛋白网状结构与血小板交织而成的血栓,最终促进血凝块溶解,恢复血管通畅[1-2]。但是溶栓药物的广泛应用并未显著改变血栓性疾病的高致残率和高致死率[3]。为了解决临床血栓性疾病治疗的不足,我们引入纳米药物递送系统,试图利用其靶向输送的特点,实现纤溶药物的精准输送;其次,磁性纳米可以在近红外光(near infrared,NIR)介导下通过朗道阻尼效应将光能快速转化为热能,为血栓性疾病提供新的治疗策略[4-5],加之磁性纳米粒在分子影像学领域中具有良好的发展前景,为血栓性疾病有限治疗窗口的诊疗一体化带来了更多可能[6]。基于以上理论,本研究以明胶(gelatin,Gel)为纳米载体,包裹溶栓药物阿替普酶(alteplase,rt-PA)以及具备光声(PA)和磁共振(MR)成像能力的磁性四氧化三铁(Fe3O4)颗粒,靶向连接血栓纤维蛋白的五肽——半胱氨酸-精氨酸-谷氨酸-赖氨酸-丙氨酸(Cys-Arg-Glu-Lys-Ala,CREKA),构建靶向诊疗一体化双模态显像纳米粒CREKA-Fe-rt-PA-Gel,并探究其体外双模态显像潜能与光热增效溶栓效果及其体内靶向血栓的能力。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 rt-PA(德国勃林格殷格翰公司);Fe3O4(西安瑞禧生物科技有限公司);CREKA多肽、异硫氰酸荧光素(FITC)-CREKA多肽、FITC-纤维蛋白原、人凝血酶(江苏强耀生物科技有限公司);A型Gel、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)(美国 Sigma-Aldrich 公司);丙酮、戊二醛(重庆川东化工有限公司);细胞膜红色荧光探针DiIC18(3)(DiI,博士德生物技术有限公司)。
1.1.2 仪器 声震仪(美国 Sonics & Materials 公司);Malvern Zetasizer Nano ZS90光粒径测量仪;BD FACS Vantage SE流式细胞仪;Lecia TSCCP2激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM);ELX800 酶标仪(美国 Bio-Rad公司);Shmadzu LC-2-1A HT 高效液相色谱仪(日本岛津公司);FC-80-2W-MM 808 nm激光器(中国Mid-River公司);Fotric 220 近红外热成像仪(中国Fotric公司);Vevo LAZR 光声成像系统(加拿大 Visual Sonics 公司);3.0 T 磁共振成像(MRI)扫描仪(德国SIEMENS公司)。
1.2 细胞 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),由重庆医科大学超声影像研究所提供。
1.3 实验动物 8~10周龄雌性SD大鼠30只,体重170~200 g;6~8周龄雌性昆明小鼠20只,体重18~20 g。均由重庆医科大学动物中心[实验动物生产许可证号:SCXK(渝)2018-0003]提供。本研究经重庆医科大学附属第二医院伦理委员会批准(批准文号:2020年科伦审第44号),实验过程符合国家和单位有关实验动物管理及使用的规定。
1.4 纳米粒制备 采用二次去溶剂法制备Gel纳米粒[7],将制备好的Gel纳米粒稀释至50 ml。制备CREKA-Fe-rt-PA-Gel纳米粒:取 2.5 ml Gel纳米粒溶液,将200 μl Fe3O4(10 mg/ml)溶于1.3 ml PBS后加入Gel纳米粒溶液中连续声震 20 min,然后将1 mg rt-PA 溶于1 ml PBS 溶液,加入上述溶液后继续声震5 min。离心洗涤去除未反应的Fe3O4及rt-PA,将上述纳米粒(10 mg/ml)加入 PBS 溶液(pH=6),以2:1的比例加入EDC、NHS,常温下孵育2 h活化纳米粒表面的羧基端,离心洗涤去除未反应的 EDC、NHS,加入PBS(pH=8)及CREKA多肽继续搅拌,待12 h后离心洗涤,制得CREKA-Fe-rt-PA-Gel纳米粒。
1.5 纳米粒相关表征测定 以透射电镜观察CREKA-Fe-rt-PA-Gel纳米粒的形态,以粒径仪检测其粒径、分布及表面电位。在Gel纳米粒制备过程中,将DiI加入丙酮中标记Gel,在CREKA-Fe-rt-PAGel纳米粒制备过程中使用FITC标记CREKA,通过激光共聚焦显微镜观察制备后纳米粒的荧光颜色以验证CREKA多肽连接是否成功。将未标记的Fert-PA-Gel作为对照组,DiI标记的CREKA-Fe-rt-PAGel作为实验组,采用流式细胞仪分析荧光标记以验证CREKA多肽的携带率。配制不同浓度 (31.25、62.50、125.00、250.00、500.00、1000.00 μg/ml)rt-PA,采用高效液相色谱仪(色谱柱Welch-C18)绘制rt-PA标准曲线,以有机溶剂二甲基亚砜破坏纳米粒后再次检测并分析rt-PA含量。rt-PA包封率=rt-PA实际含量/rt-PA投入量×100%。加入不同含量(0.50、0.75、1.00、1.25、1.50 mg)Fe3O4制备CREKA-Fe-rt-PA-Gel纳米溶液,离心取上清,采用有机溶剂二甲亚砜破坏上清液成分后以电感耦合等离子质谱检测上清液Fe3O4含量。Fe3O4包封率(%)=(Fe3O4投入量-上清液Fe3O4含量)/Fe3O4投入量×100%。将CREKA-Fe-rt-PA-Gel纳米粒冻干,采用振动样品磁强计分析其磁学性能。
1.6 体外光热效应测定 将CREKA-Fe-rt-PA-Gel按不同浓度(1.0、2.0、4.0、8.0 mg/ml)分为4组,并设置0.9%氯化钠注射液作为空白对照组;每组取200 μl分别置于96孔板中,采用808 nm激光(2.0 W/cm2)辐照20 min。相同浓度 CREKA-Fe-rt-PAGel(4 mg/ml)分别经808 nm激光(1.0、1.5、2.0 W/cm)辐照20 min。以热成像仪检测各组温度变化。为探究该纳米粒的稳定性,以固定浓度(4.0 mg/ml)CREKA-Fe-rt-PA-Gel为研究对象,经808 nm激光(2.0 W/cm2)辐照5 min,停止激光辐照,温度降至室温后继续前面的辐照流程并循环5个周期。各组纳米粒辐照过程均采用成像仪监控记录温度变化情况。
1.7 体外双模态显像
1.7.1 体外PA显像 制备琼脂糖凝胶模型,将不同浓度(0.125、0.250、0.500、0.750、1.000、1.250、1.500 mg/ml)CREKA-Fe-rt-PA-Gel溶液各200 μl 加入凝胶模型中,使用光声成像仪以一定波长(680~970 nm)辐照各组纳米粒溶液,采集相应的光声图像,并利用仪器自带后处理软件测量最强信号处的波长。
1.7.2 体外MR显像 将不同浓度(0.25、0.50、1.00、2.00、4.00 mg/ml)CREKA-Fe-rt-PA-Gel溶液各1.5 ml加入微型离心管中,使用3.0 T MRI采集T2加权像(T2WI),利用后处理软件测得图像的R2(1/T2)值。同时采集伪彩图,并获取相应的信号强度。
1.8 体外安全性试验
1.8.1 细胞毒性试验 以含1%双抗、10%胎牛血清的RPMI 1640培养基于37 ℃、5% CO2培养箱中孵育HUVEC细胞。将HUVEC细胞置于96孔板中,待细胞贴壁且生长融合面积达到50%左右时,弃去旧培养基,分别加入不同浓度(0.5、1.0、2.0、4.0、6.0 mg/ml)CREKA-Fe-rt-PA-Gel孵育24 h,弃去旧培养基,用PBS清洗3次,每孔加入100 μl含10%CCK-8的新鲜培养基孵育1 h,使用酶标仪检测吸光度A450,每组测量5次。
1.8.2 溶血试验 在轻度麻醉下从昆明小鼠眼眶收集血液样本。通过离心(3000 r/min,15 min,4 ℃)获得红细胞,并用PBS(pH=7.4)清洗3次,直到上清液变成无色;将获得的红细胞沉淀稀释10倍;分别将0.5 ml rt-PA、Gel-rt-PA、Gel-rt-PA-Fe、CREKA-Fert-PA-Gel 与0.5 ml红细胞混合作为实验组,0.5 ml去离子水与0.5 ml红细胞混合作为阳性对照组,0.5 ml PBS与0.5 ml红细胞混合作为阴性对照组。所有样品在37 ℃孵育4 h,3000 r/min离心15 min获取上清液。使用酶标仪在540 nm处测定上清液的吸光度。溶血率(%)=(A实验组-A阴性对照组)/(A阳性对照组-A阴性对照组)×100%。
1.9 体外溶栓效果评估
1.9.1 体外溶栓试验 在轻度麻醉下用1.5 ml微型离心管从昆明小鼠眼眶收集多个0.5 ml血液样本,4 ℃放置24 h形成凝块,PBS清洗3次,分别设置NIR组、rt-PA(0.04 mg/ml)组、Gel-rt-PA+NIR组、Gelrt-PA-Fe+NIR组、CREKA-Fe-rt-PA-Gel+NIR组,将血凝块与上述各组溶液(4 mg/ml)孵育3 h,激光辐照(2 W/cm2,20 min)处理后取溶液3000 r/min离心15 min,使用酶标仪分别在540 nm及450 nm处测定上清液吸光度,作为血红蛋白和纤维蛋白的含量指标来评估溶栓效果。
1.9.2 FITC标记的纤维蛋白凝块试验 将25 U/ml凝血酶和2.5 mmol氯化钙加入含有5 mg/ml FITC标记的纤维蛋白原(200 μl)溶液中,37 ℃孵育1 h,诱导FITC标记的纤维蛋白凝块;将纤维蛋白凝块与CREKA-Fe-rt-PA-Gel孵育1 h,并进一步用808 nm激光(2 W/cm2,5 min)照射,设置对照组、CREKAFe-rt-PA-Gel组、NIR组、CREKA-Fe-rt-PA-Gel+NIR组,采用CLSM评估各组纤维蛋白网状结构的损伤程度。
1.10 体内靶向性能观察 分离SD大鼠左侧颈总动脉,以宽度为0.5 cm的滤纸蘸取10% FeCl3分别包裹左侧颈总动脉15 min及10 min,构建完全栓塞和部分栓塞的血栓模型,使用0.9%氯化钠注射液冲洗残余FeCl3。为观察纳米粒在体内血栓上的分布,建立血栓模型1 h后,分别将1 ml浓度为 5 mg/ml DiI标记的纳米粒(CREKA-Fe-rt-PA-Gel、Fe-rt-PA-Gel)经尾静脉注入大鼠体内,1 h后在深度麻醉下处死,取颈动脉,制备厚度为 10 μm的切片并进行HE染色。在光学显微镜及荧光显微镜下观察两组(Fe-rt-PAGel组和CREKA-Fe-rt-PA-Gel组)纳米粒在血栓中的分布情况。
1.11 统计学处理 采用 GraphPad 8.0.2软件进行统计分析。计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CREKA-Fe-rt-PA-Gel的基本特征 构建的CREKA-Fe-rt-PA-Gel纳米粒(图1A)在透射电镜下呈大小均一的圆形(图1B),粒径(254.79±6.83) nm,电位(5.48±4.60) mV(图1C),多分散系数(0.09±0.05)。激光共聚焦观察显示FITC标记的CREKA多肽成功连接在DiI标记的Fe-rt-PA-Gel上(图1D),流式分析显示连靶率为98.66%(图1E)。高效液相色谱法计算的药物标准曲线为y=37887x+327636,对应标准曲线计算得到rt-PA的包封率为23.03%±0.05%(图1F);电感耦合等离子质谱检测显示,随着投入Fe3O4含量的增加,纳米粒中Fe3O4实际含量也随之增加,计算得出Fe3O4包封率为92.78%±0.57%(图1G);磁滞回线显示CREKA-Fe-rt-PA-Gel没有明显的剩余磁化强度,为顺磁性(图1H)。
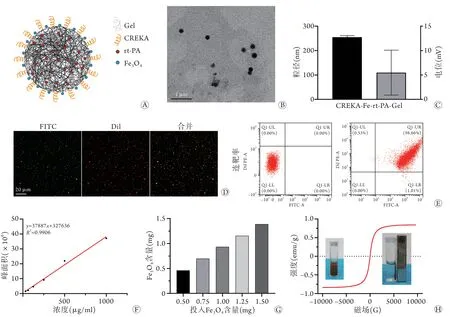
图1 CREKA-Fe-rt-PA-Gel纳米粒的基本特征Fig.1 Basic characterization of the nanoparticles (CREKA-Fe-rt-PA-Gel)
2.2 体外光热效应 激光辐照不同浓度CREKA-Fert-PA-Gel,10 min时温度上升趋于平稳,随着纳米粒溶液浓度升高和辐照时间延长,温度上升更加明显,光热效能表现出显著的浓度依赖性和时间依赖性,而对照组温度未见明显上升(图2A)。不同强度的激光辐照CREKA-Fe-rt-PA-Gel,激光强度越高,辐照时间越长,温度上升越明显(图2B)。在5个循环光热辐照下,CREKA-Fe-rt-PA-Gel表现出较好的光热稳定性(图2C)。为了避免温度过高对组织的损伤,选择CREKA-Fe-rt-PA-Gel浓度4 mg/ml、激光强度2 W/cm2、辐照时间20 min进行后续实验。
2.3 体外双模态显像 PA显像显示CREKA-Fe-rt-PA-Gel在690 nm处的PA信号最强,与Fe3O4的PA吸收峰一致;在此波长下PA信号随浓度增加逐渐增强,呈线性改变(图2D)。MR显像显示CREKA-Fert-PA-Gel具有T2加权成像能力,且随着CREKA-Fert-PA-Gel浓度增加T2信号逐渐减弱,呈线性相关(图2E)。MR伪彩图显示其信号强度均匀(图2F)。
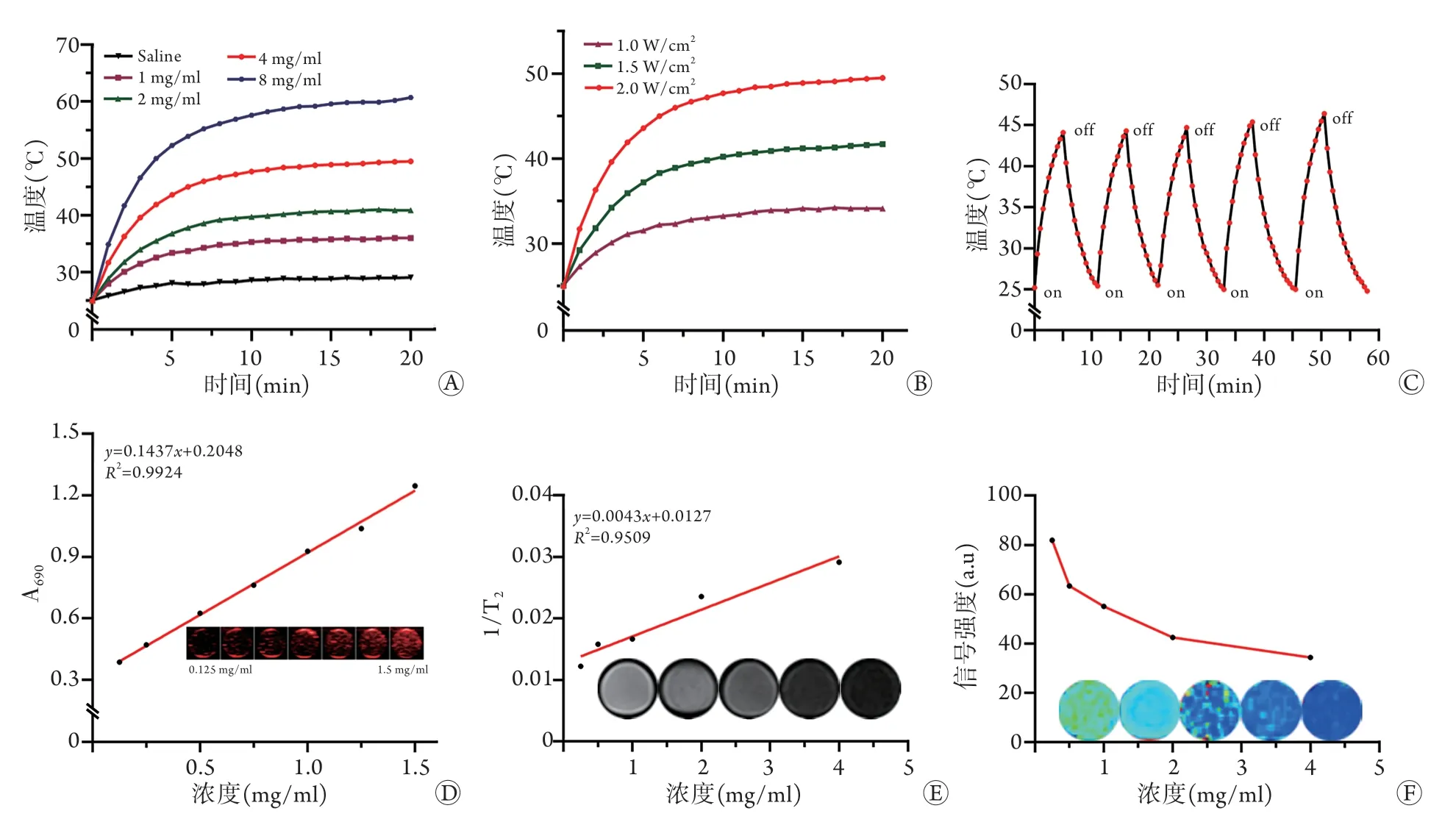
图2 CREKA-Fe-rt-PA-Gel纳米粒的体外光热效应及双模态成像Fig.2 Photothermal effect and dual-mode imaging of the nanoparticles (CREKA-Fe-rt-PA-Gel) in vitro
2.4 细胞毒性及溶血反应 CCK-8法检测显示,HUVEC与不同浓度(0.5、1.0、2.0、4.0、6.0 mg/ml)CREKA-Fe-rt-PA-Gel孵育24 h后,细胞的存活率均>90% (图3A),各组之间差异无统计学意义(F=2.748,P>0.05)。溶血反应结果显示,与阴性对照组比较,各实验组溶血率均远低于上限(5%);同时,阳性对照组出现明显的溶血现象(图3B)。
2.5 体外溶栓试验 将血凝块分别与Gel-Fe、Gel-rt-PA-Fe、CREKA-Fe-rt-PA-Gel共培养并用NIR激光辐照。与NIR组相比,r t-PA组溶液中的纤维蛋白和血红蛋白含量差异无统计学意义(P>0.05);与NIR组(0.084±0.005)及rt-PA组(0.112±0.005)相比,Gel-rt-PA组(1.176±0.062)、Gel-rt-PA-Fe组(1.510±0.046)、CREKA-Fe-rt-PA-Gel组(2.226±0.047)纤维蛋白含量明显增加,差异均有统计学意义(P<0.01)。此外,与NIR组(0.075±0.005)及rt-PA组(0.100±0.009)相比,Gel-rt-PA组(0.702±0.123)、Gel-rt-PAFe组(0.949±0.027)、CREKA-Fe-rt-PA-Gel组(1.459±0.021)血红蛋白含量明显增加,差异均有统计学意义(P<0.01)。CREKA-Fe-rt-PA-Gel组纤维蛋白和血红蛋白含量均为最高(图3C)。
2.6 FITC标记的纤维蛋白凝块试验 将纤维蛋白与CREKA-Fe-rt-PA-Gel共培养并用NIR激光辐照5 min后,与未经任何处理的绿色荧光(FITC)标记的纤维蛋白相比,CREKA-Fe-rt-PA-Gel组及NIR组纤维蛋白结构未见明显改变,而CREKA-Fe-rt-PAGel+NIR组纤维蛋白结构出现大量塌陷的骨架和小片(图3D)。
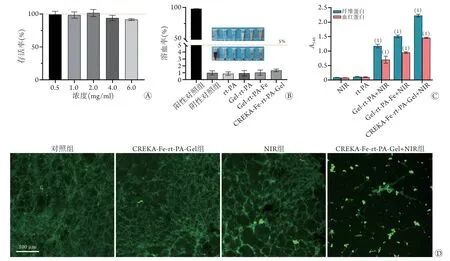
图3 CREKA-Fe-rt-PA-Gel纳米粒的体外生物安全性及溶栓试验结果(n=3)Fig.3 Biosafety and thrombolysis test of the nanoparticles (CREKA-Fe-rt-PA-Gel) in vitro (n=3)
2.7 体内靶向性能 成功构建大鼠左侧颈总动脉血栓模型(图4A)。在光学显微镜下可见正常血管管腔无填充,其血管壁可见深染的细胞核;完全栓塞血管管腔可见均匀一致的颜色,其血管壁可见深染的细胞核(图4B)。为了避免血管壁中细胞核HE染色对实验的干扰,选择部分栓塞的血管进行靶向性研究,在光学显微镜下,Fe-rt-PA-Gel组血栓中仅可以见部分纳米粒,而CREKA-Fe-rt-PA-Gel组血栓中可见更多的纳米粒分布(图4B)。
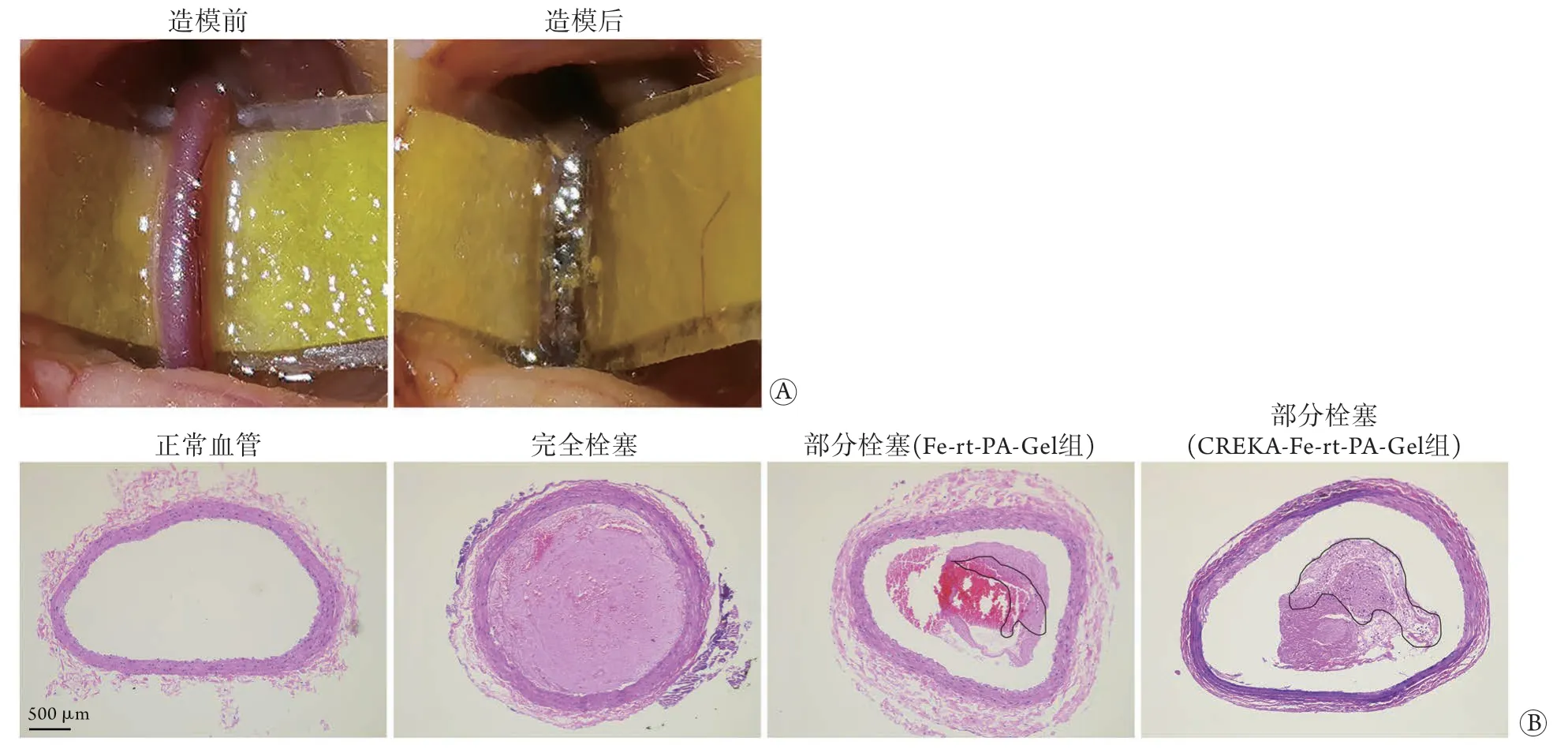
图4 大鼠颈总动脉血栓模型及CREKA-Fe-rt-PA-Gel纳米粒的体内靶向性试验 (n=3)Fig.4 Thrombus model in common carotid artery of rats and test of targeting ability of the nanoparticles (CREKA-Fe-rt-PA-Gel)in vivo (n=3)
3 讨 论
为了解决临床血栓性疾病治疗的不足,本研究引入了纳米药物递送系统,旨在利用其靶向运输的特点实现纤溶药物的精准输送,并联合光热疗法(PTT),以增强药物溶栓的效果。当前临床常规药物溶栓治疗存在以下不足:(1)纤溶药物的作用缺乏纤维蛋白特异性,在溶解病理性血栓纤维蛋白的同时也会溶解生理性纤维蛋白,甚至导致高出血风险(例如,链激酶SK在活动性出血3个月内禁用);(2)药物循环寿命较短[例如,组织型纤溶酶原激活物(t-PA)的半衰期仅为2~6 min],在血液循环中的快速清除和酶降解高度限制了治疗窗口[8-10];(3)单一的药物溶栓联合外科辅助治疗造成了高成本、高风险,需要复杂的临床风险监控。
PTT由于其对肿瘤组织的热消融作用已经成功地用于部分肿瘤的治疗,作为肿瘤替代疗法具有较好的临床应用前景[11-12]。基于目前临床血栓性疾病治疗的局限性,有研究者提出了光热溶栓的辅助治疗方法[13]。利用光吸收剂在NIR辐射下使局部温度升高,从而破坏血凝块的纤维蛋白网络,达到溶栓效果[14]。借助纳米药物递送系统的精确性和可忽略的侵入性,本研究构想的光热增效溶栓策略有望进一步改善临床血栓性疾病的治疗效果。
由于Fe3O4在NIR区具有较强的吸收峰,不仅可以利用分子影像学的优势作为磁性造影剂进行PA[15],而且可以利用朗道阻尼效应将光能快速转化为热能进行PTT治疗。同时,Fe3O4固有的顺磁性不仅能实现MR显像,还有望被外置磁体吸附而进一步用于磁导航溶栓治疗。本研究利用Fe3O4的这些性能构建的磁性CREKA-Fe-rt-PA-Gel纳米粒,其粒径为(254.79±6.83) nm,多分散系数为(0.09±0.05),大小均一、分散性良好,此外,其连靶率及Fe3O4包封率高,光热效能表现出明显的辐照强度依赖性和时间依赖性,在5个循环光热辐照下具有明显的光热稳定性,激光强度越高,辐照时间越长,温度上升越明显。良好的光热能力为其用于血栓治疗奠定了基础。PA显像显示,CREKAFe-rt-PA-Gel在690 nm处的PA信号最强,与Fe3O4的PA吸收峰一致,提示CREKA-Fe-rt-PA-Gel没有改变Fe3O4本身的性质;MR显像显示其具有T2加权成像能力,MR伪彩图显示其信号强度均匀。体外成像试验显示,CREKA-Fe-rt-PA-Gel具有良好的PA/MR双模态成像潜能,有望作为分子影像的造影剂。
本研究细胞毒性试验中,HUVEC细胞与不同浓度的CREKA-Fe-rt-PA-Gel孵育24 h后,细胞存活率均>90%,提示CREKA-Fe-rt-PA-Gel对细胞无明显毒性。溶血反应结果显示,与PBS组(阴性组)比较,各组纳米粒的溶血率均远低于上限(5%),而阳性对照组出现明显的溶血现象,提示CREKA-Fe-rt-PAGel具有良好的生物安全性和血液相容性,可用于体内研究。
本研究体外溶栓试验中,血凝块与Gel-rt-PA、Gel-rt-PA-Fe、CREKA-Fe-rt-PA-Gel共培养并用NIR激光辐照后,Gel-rt-PA、Gel-rt-PA-Fe、CREKA-Fert-PA-Gel组纤维蛋白和血红蛋白含量明显高于NIR组及rt-PA组,且CREKA-Fe-rt-PA-Gel组含量最高,提示该磁性载药纳米递送系统联合光热增效具有较强的溶栓能力。更为重要的是,将纤维蛋白与CREKA-Fe-rt-PA-Gel共培养并用NIR激光辐照5 min后,与未经任何处理的绿色荧光(FITC)标记的纤维蛋白相比,单纯CREKA-Fe-rt-PA-Gel组和NIR组纤维蛋白结构未见明显改变,而CREKA-Fe-rt-PAGel+NIR组纤维蛋白出现大量塌陷的骨架和小片,直观地显示了光热增效溶栓的机制为破坏血栓中致密的纤维蛋白网状结构,提示CREKA-Fe-rt-PA-Gel联合光热作用能够破坏纤维蛋白骨架。相比传统的单纯药物溶栓,纳米粒联合PTT实现了更强的溶栓效果,这为临床血栓性疾病的治疗提供了新的选择。光热增效溶栓的机制在于单纯的CREKA-Fe-rt-PA-Gel纳米粒或NIR并不能损伤血栓纤维蛋白,但纳米粒联合NIR产生光热效应时却能毁损血栓中致密的纤维蛋白网状结构。究其原因,可能是光热使纤维蛋白发生热损伤而使其网状结构破坏。另外,纳米粒在修饰了CREKA多肽后,可增强其体内应用的靶向性,有助于增强后续体内治疗的效果,而且有可能减轻药物溶栓造成出血并发症的弊端。但本研究未对血栓体内多模态成像与体内溶栓治疗效能进行深入探讨;Fe3O4作为光吸收剂具有较好的应用前景,但在光热治疗过程中,可能损伤相邻组织结构,其达到最大安全治疗效果的临界温度尚待进一步探究,这也是今后的研究方向。
总之,本研究构建了靶向诊疗一体化的载rt-PA磁性明胶纳米粒——CREKA-Fe-rt-PA-Gel,其血液相容性较好,可用于PA/MR双模态显像,具有良好的光热性能;CREKA-Fe-rt-PA-Gel联合光热治疗具备较强的溶栓效果。目前关于光热溶栓的研究尚处于初级阶段,值得进一步深入探讨。

