基于生物信息学筛选通过调控脂肪细胞功能改善肥胖的中药单体
李畅,冷清阳,冷华卿,张宏利,李晓华*
1上海中医药大学第七人民医院内分泌科,上海 200137;2上海市黄浦区打浦桥街道社区卫生服务中心,上海 200032
肥胖是长期能量摄入与消耗不平衡引起的以体内脂质过度蓄积、体重指数超过一定范围为特征的慢性代谢性疾病,可增加罹患心血管疾病、2型糖尿病等的风险[1-4],严重影响生活质量。迄今为止,治疗肥胖主要是采用生活方式管理、药物降脂、减肥手术等策略,但尚不能满足临床需求。减重手术虽然可通过改善患者的脂肪组织功能、增加胰岛素敏感性、降低炎症水平而改善代谢[5],但存在术后并发症等问题。本研究基于基因表达综合数据库(gene expression omnibus,GEO),运用生物信息学手段分析差异表达基因(differentially expressed genes,DEGs)和核心(hub)基因,并通过药物基因组数据库(connectivity map,cMAP)预测及鉴定可调节脂肪细胞功能的中药单体,旨在为肥胖治疗提供新的思路和方向。
1 材料与方法
1.1 生物信息学分析
1.1.1 GEO芯片数据下载及处理 通过在GEO数据库中分别检索“BMI AND subcutaneous adipose tissue”和“bariatric surgery AND subcutaneous adipose tissue”,可得到GSE70353[6]和GSE72158[7]两个数据集的探针矩阵。数据集GSE70353含770名不同BMI的男性(45~73岁)皮下白色脂肪组织(subcutaneous adipose tissue,SAT)的基因表达,筛选出其中110名肥胖者[体重指数(BMI)>30 kg/m2]及259名非肥胖者(BMI<25 kg/m2)的数据;数据集GSE72158含42例女性减肥术前及术后1年SAT的基因表达。这两个数据集的详细信息见表1。利用perl脚本将探针转换为基因名,将矩阵数据分组合并。
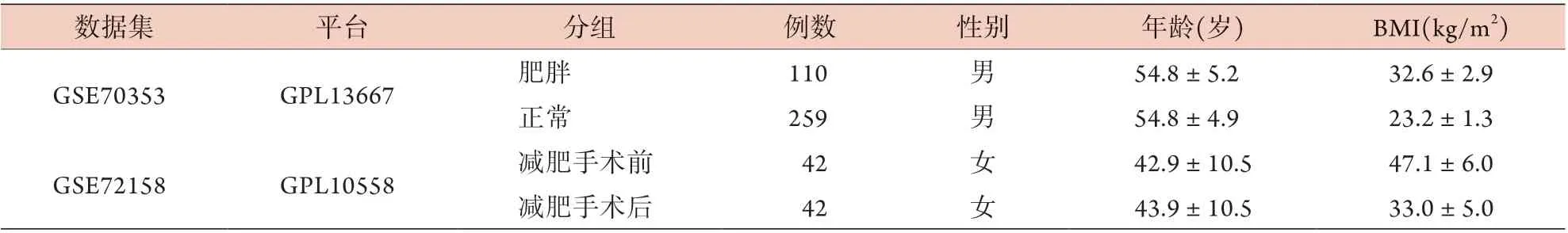
表1 数据集基础指标信息Tab.1 Detail for the GEO data sets
1.1.2 差异基因的筛选 通过R软件(4.11版)对探针矩阵进行标准化,运行limma包筛选出DEGs(|log2(fold change)|>0.5,Padjust<0.05),随后绘制DEGs火山图。整理数据,利用R软件读取两个数据集各自对应DEGs的基因名称,去掉基因首尾空格,基因取唯一,引用Venn包对交集基因进行绘图。
1.1.3 DEGs的GO功能富集和KEGG通路富集分析 通过R软件(4.11版)读取两个数据集中筛选出来的共同DEGs,通过安装或引用DOSE、clusterProfiler、org. Hs. eg. db、enrichplot对共同的DEGs进行功能注释Gene Ontology(GO)富集分析和Kyoto Encyclopedia of Genes and Genomes(KEGG)富集分析(Padjust<0.05),并筛选出前20个富集功能和通路。GO分析包括生物学过程(biological process,BP)、细胞定位(cellular component,CC)和分子功能(molecular function,MF)分析。
1.1.4 蛋白质互作网络(PPI)的构建和hub基因的筛选 将共同的DEGs导入STRING(Search Tool for the Retrieval of Interacting Genes),获得蛋白质PPI后,设置高度置信(high confidence)=0.7,隐藏无链接的单个节点。将PPI筛选出的基因导入Cytoscape(3.8.2版),利用CytoNCA包选取度中心性(degree)为中位值至最大值之间,筛选出hub基因。
1.1.5 小分子中药单体筛选 使用cMAP分别读取hub基因的上调组及下调组基因,并预测可靶向这些基因的小分子药物。
1.2 细胞实验
1.2.1 实验材料 小鼠3 T 3-L 1 细胞系购自ATCC细胞库。岩白菜素、银杏内酯A购自美国MedChemExpress公司;DMEM高糖培养基、胎牛血清、PBS购自美国Gibco公司;胰岛素购自美国Lilly公司;地塞米松、3-异丁基-1-甲基黄嘌呤(IBMX)、二甲基亚砜(DMSO)、Trizol试剂购自美国Invitrogen公司;PCR引物购自上海生物工程有限公司;反转录、qRT-PCR试剂盒购自南京诺唯赞公司;牛血清白蛋白购自新西兰Proliant生物公司。
1.2.2 3T3-L1白色脂肪细胞的培养和诱导分化将3T3-L1前脂肪细胞接种于24孔板,用含10%胎牛血清的DMEM高糖培养基培养于37 ℃、5%CO2培养箱中。细胞完全融合后采用含0.5 mmol/L IBMX、1 μmol/L地塞米松、10 μg/ml胰岛素的完全培养基诱导至细胞完全收缩,采用含10 μg/ml胰岛素的完全培养基培养48 h后换成不含胰岛素的完全培养基,每2 d更换一次培养基。诱导分化的第8天,3T3-L1诱导的成熟白色脂肪细胞(white adipocytes,WAT)即可用于后续实验。
1.2.3 细胞分组与处理 采用含2%牛血清白蛋白的DMEM高糖培养基饥饿6 h后,将细胞分别加入含终浓度为0、0.4、2和10 μmol/L岩白菜素的培养基和含终浓度为0、0.01、0.1和1 μmol/L银杏内酯A的培养基内处理24 h。独立细胞实验至少重复3次。
1.2.4 实时荧光定量PCR 使用Trizol试剂提取白色脂肪细胞总RNA,反转录合成cDNA,将cDNA稀释10倍后作为模板,采用qRT-PCR检测相关基因的mRNA表达情况。引物序列如下:肿瘤坏死因子α(TNF-α),上游5'-TGGGCCTCTCATGCACCACC-3',下游5'-GAGGCAACCTGACCACTCTCCCT-3';白细胞介素6(IL-6),上游5'-AGACAAAGCCAGAGTCCT TCAG-3',下游5'-GCCACTCCTTCTGTGACTCCAG-3';过氧化物酶体增殖物激活受体γ(PPARγ),上游5'-TCGCTGATGCACTGCCTATG-3',下游5'-GA GAGGTCCACAGAGCTGATT-3';核糖体蛋白基(36B4),上游5'-AAGCGCGTCCTGGCATTGTCT-3',下游5'-CCGCAGGGGCAGCAGTGGT-3'。以36B4作为内参基因,计算2-ΔΔCt值比较基因的相对表达量。
1.3 统计学处理 采用Graph Pad Prism 8.0进行统计分析。所有数据均以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法。P<0.05为差异有统计学意义。
2 结 果
2.1 两数据库中与改善肥胖相关的共表达DEGs的筛选 GSE70353数据集中含有770名不同BMI男性(45~73岁)SAT的基因表达数据,筛选出259名非肥胖者(BMI<25 kg/m2)与110名肥胖者(BMI>30 kg/m2)的132个DEGs用于后续研究,其中上调基因59个,下调基因73个(图1A);GSE72158数据集中含有42例减肥手术前及术后1年女性患者SAT的基因表达数据,筛选出291个DEGs用于后续研究,其中上调基因76个,下调基因215个(图1B)。这两个数据集有64个共同的DEGs,其中,减肥手术改善肥胖后SAT中有19个基因(与肥胖呈负相关)上调,45个基因(与肥胖呈正相关)下调(图1C、D,表2),这些基因将用于后续分析。
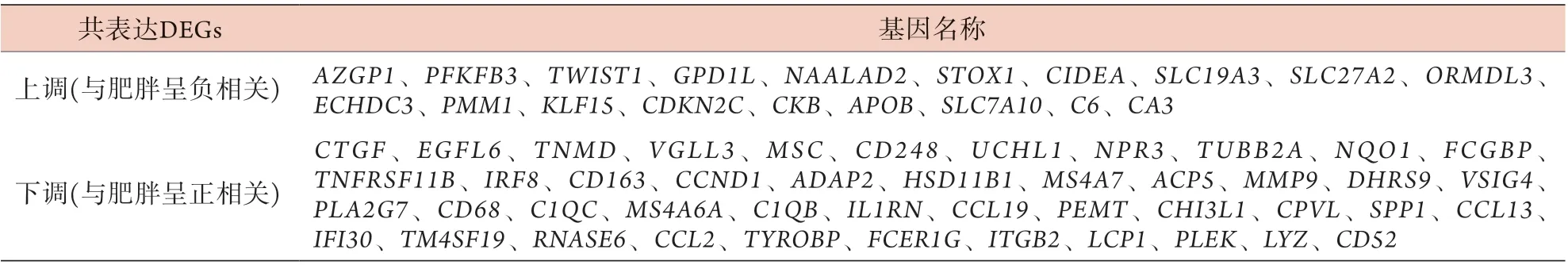
表2 两个数据集中的共表达差异基因(DEGs)Tab.2 Co-expressed DEGs in two data sets
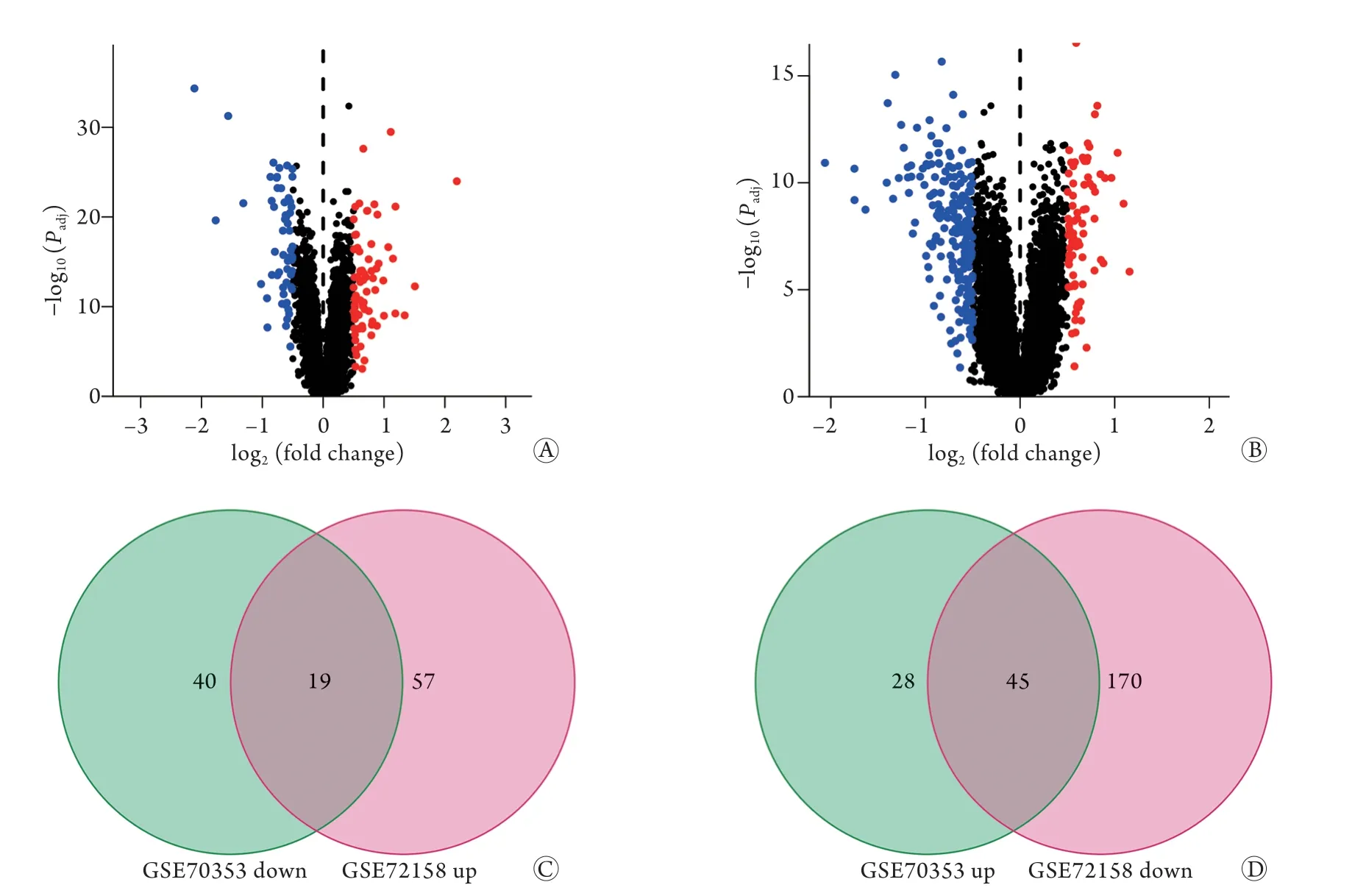
图1 两个数据集共表达的差异表达基因(DEGs)的筛选Fig.1 Identification of co-expressed DEGs from two data sets
2.2 共表达DEGs的GO富集分析 GO富集分析中的BP分析结果显示,共表达DEGs主要在中性粒细胞趋化性(neutrophil chemotaxis)、参与免疫反应的中性粒细胞活化(neutrophil activation involved in immune response)、中性粒细胞介导的免疫(neutrophil mediated immunity)、体液免疫反应(humoral immune response)等子集中富集;CC分析结果显示,共表达DEGs主要在特殊颗粒(specific granule)、分泌颗粒膜(secretory granule membrane)、低密度脂蛋白颗粒(low-density lipoprotein particle)等子集中富集;MF分析结果显示,共表达DEGs主要定位在细胞因子活性(cytokine activity)、趋化因子活性(chemokine activity)、CCR趋化因子受体结合(CCR chemokine receptor binding)、整理素结合(integrin binding)、趋化因子受体结合(chemokine receptor binding)等子集(图2)。
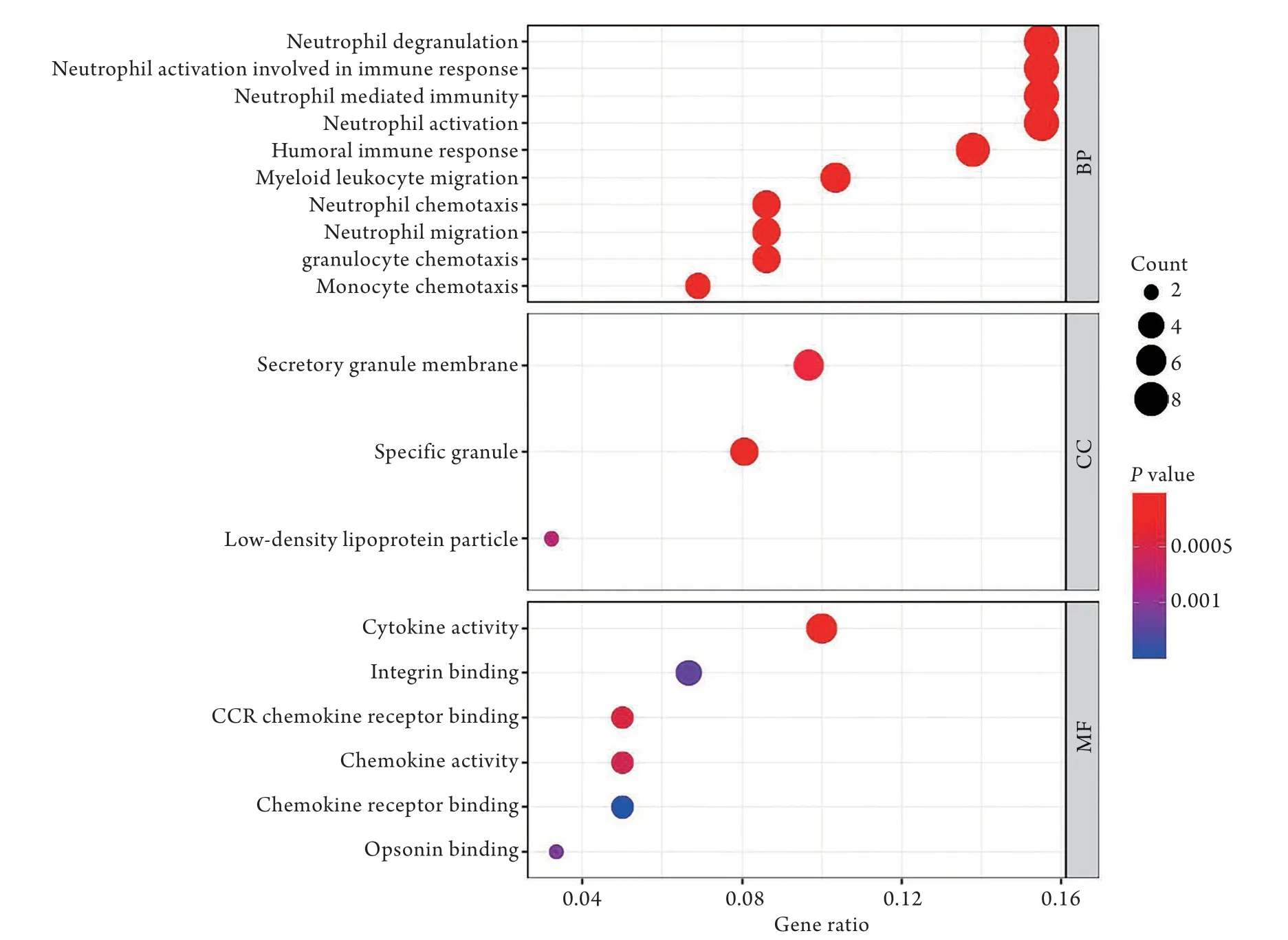
图2 共表达差异表达基因(DEGs)的GO富集分析Fig.2 GO enrichment results of co-expressed DEGs
2.3 共表达DEGs的KEGG富集分析 KEGG通路分析结果显示,共表达的DEGs主要与补体和凝血级联反应(complement and coagulation cascades)、百日咳(pertussis)、内分泌抵抗(endocrine resistance)等通路有关,此外还与金黄色葡萄球菌感染(Staphylococcus aureusinfection)、糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications)、酒精性肝病(alcoholic liver disease)等通路有关(图3)。
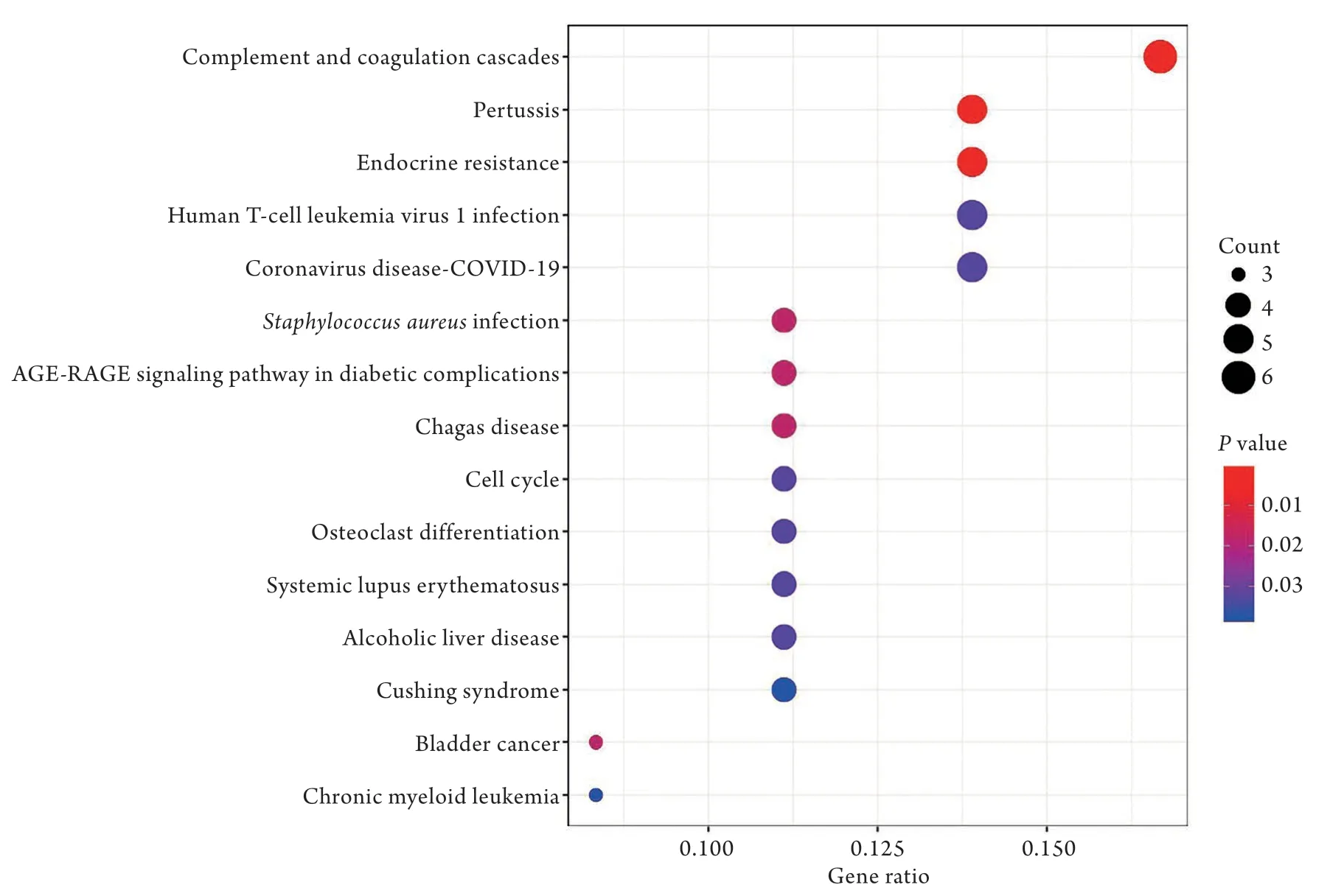
图3 共表达差异表达基因(DEGs)的KEGG通路分析Fig.3 KEGG pathway analysis of co-expressed DEGs
2.4 PPI的构建与hub基因的鉴定 通过STRING构建64个DEGs的PPI(图4A),筛选出高度置信(high confidence=0.7)且隐藏无节点的基因后,利用Cytoscape筛选Degree中位值(2)至最大值(12)之间的基因,共得到18个hub基因(图4B、表3),其中肥胖改善后下调的基因有17个(与肥胖呈正相关),仅APOB基因上调(与肥胖呈负相关)。

表3 共表达基因中的18个核心(hub)基因Tab.3 Eighteen hub genes from co-expressed DEGs
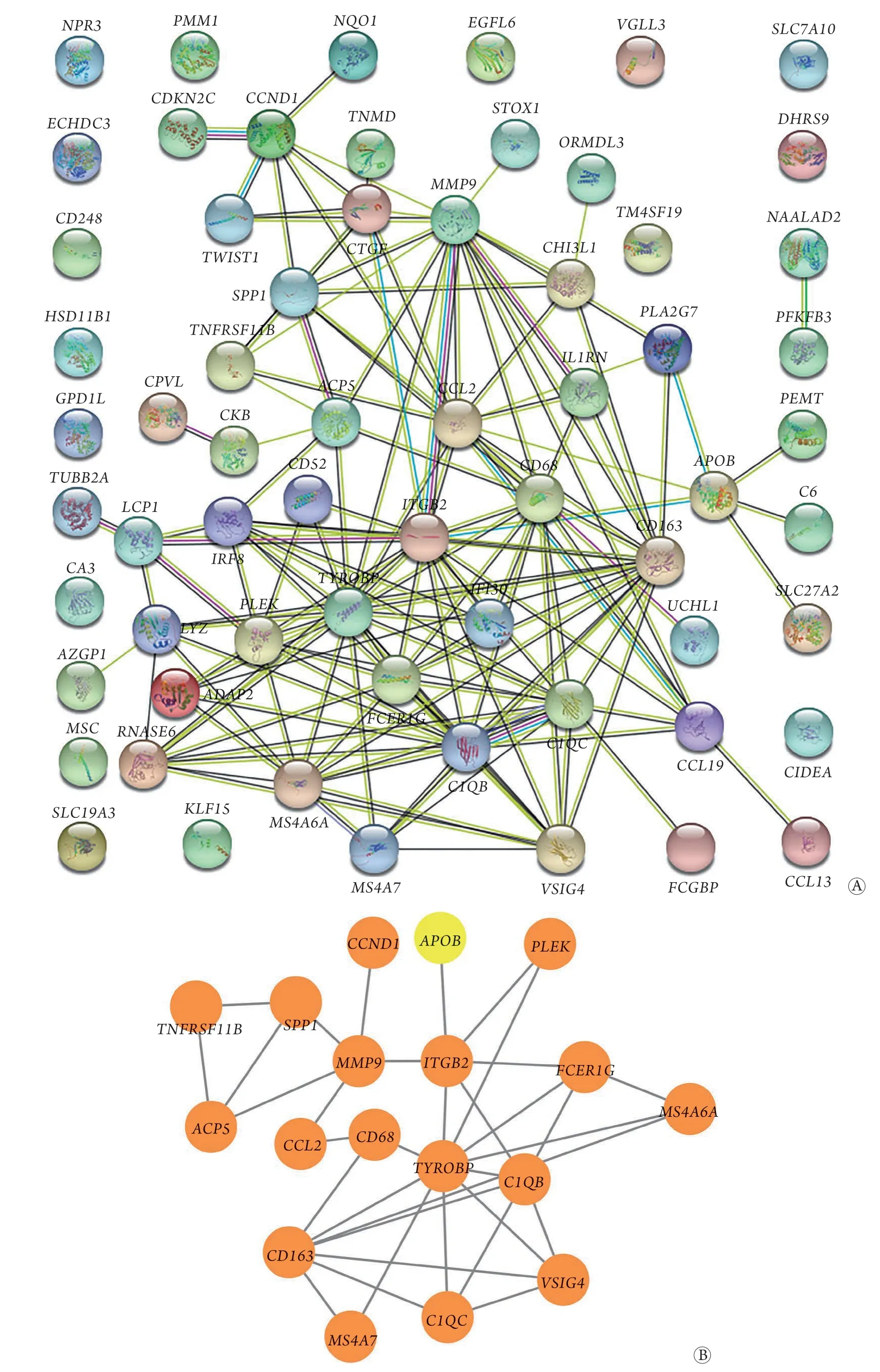
图4 两个数据集共表达差异表达基因(DEGs)的PPI图(A)及hub基因网络图(B,黄色为上调基因、橙色为下调基因)Fig.4 The PPI network (A) and hub genes (B, the yellow is up-regulated gene and the orange is down-regulated gene) of coexpressed DEGs in two data sets
2.5 中药单体的预测 通过cMAP分析上调及下调的hub基因,筛选出1309个小分子药物,选择显著富集(P<0.05)的药物,得到1264个小分子药物,其中中药提取物74个。去除有毒或不宜长期内服的药物后,最终获得28个中药单体。其中22个已被证实可明显降低高脂饮食诱导的肥胖小鼠的体重或通过其他机制改善肥胖;尚无研究表明其余6个中药单体(北美黄连碱、荷包牡丹碱、岩白菜素、表长春胺、银杏内酯A、长春胺)与肥胖有关(表4)。
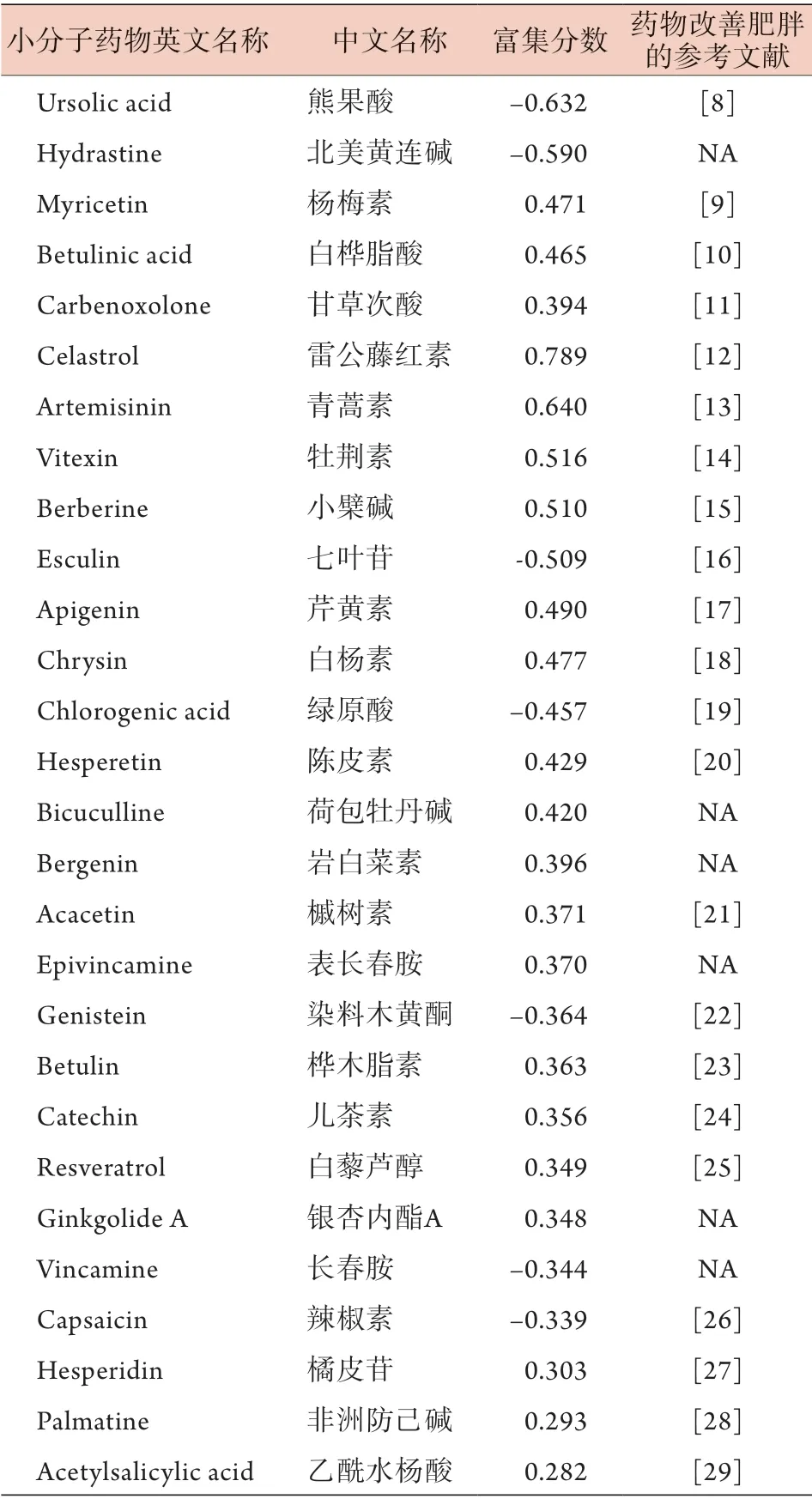
表4 cMAP数据库中筛选出的中药单体Tab.4 Traditional Chinese medicines (TCM) monomers screened from cMAP
2.6 初步验证筛选出的部分中药单体改善肥胖的作用 qPCR实验结果显示,与0 μmol/L组比较,0.4 μmol/L岩白菜素组PPARγmRNA表达水平明显下降(P<0.05),2 μmol/L和10 μmol/L岩白菜素组PPARγmRNA表达水平有下调的趋势,但差异无统计学意义(图5A);0.4 μmol/L和10 μmol/L岩白菜素组IL-6mRNA表达水平明显下降(P<0.05),2 μmol/L岩白菜素组IL-6mRNA表达水平有下调的趋势,但差异无统计学意义(图5A)。与0 μmol/L组比较,0.1 μmol/L银杏内酯A组PPARγmRNA表达水平明显下降(P<0.05),0.01 μmol/L和1 μmol/L银杏内酯A组PPARγmRNA表达水平有下调的趋势,但差异无统计学意义(图5B);0.1 μmol/L银杏内酯A组IL-6mRNA表达水平明显下降(P<0.05),0.01 μmol/L和1 μmol/L银杏内酯A组IL-6mRNA表达水平有下调的趋势,但差异无统计学意义(图5B)。
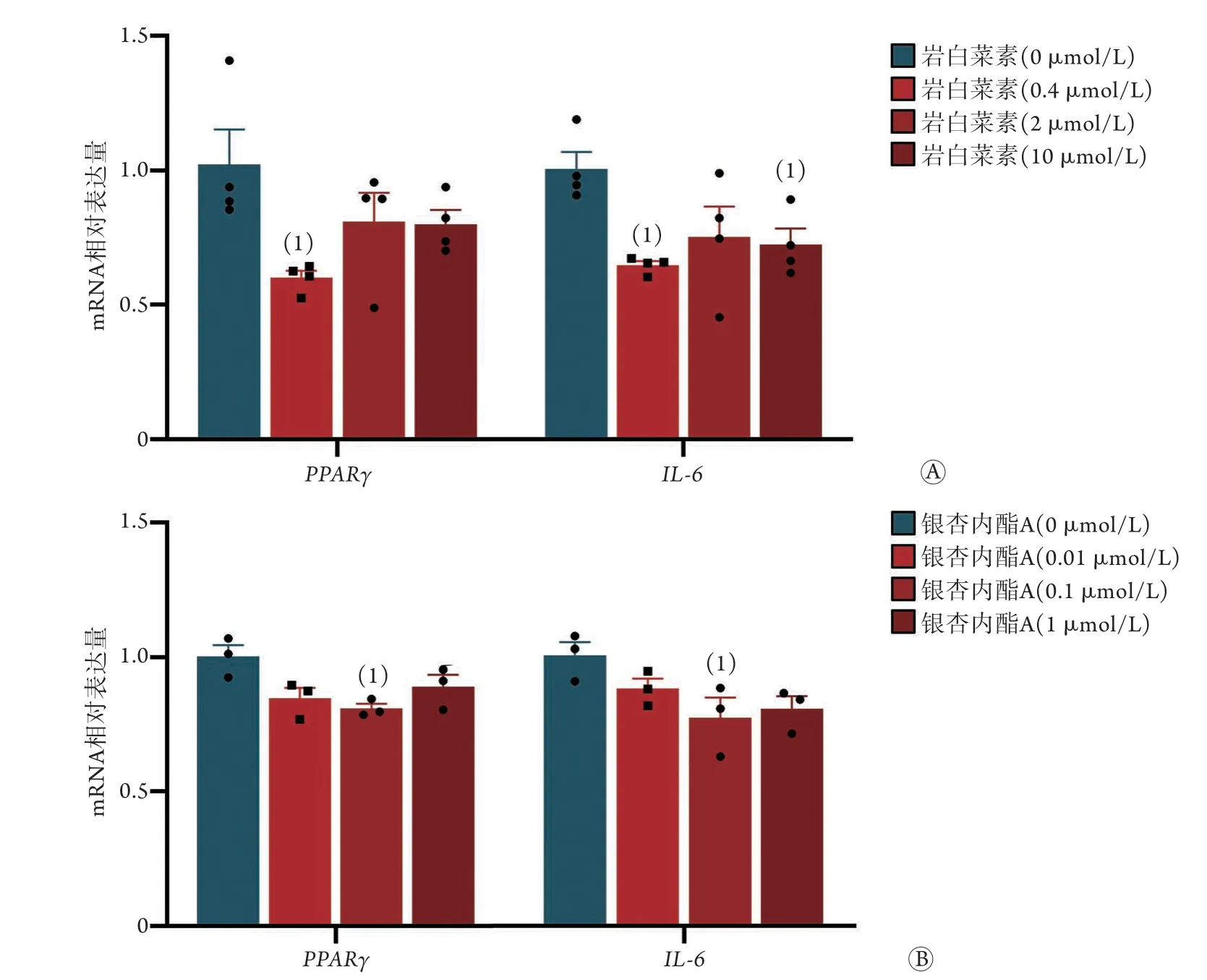
图5 中药单体对3T3-L1细胞诱导分化的WAT中PPARγ、IL-6 mRNA表达水平的影响Fig.5 Effects of TCM monomer on the expression of PPARγ and IL-6 mRNA in WAT induced by 3T3-L1 cells
3 讨 论
肥胖是多种疾病的危险因素,如未能及时控制,将严重影响患者的生活质量,且目前仍无令人满意的治疗措施。有研究发现,减重手术可改善患者的脂肪组织功能、增加胰岛素敏感性、缓解炎症等[5]。本研究的生物信息学分析也发现,减肥手术后,促进肥胖的促炎状态向抗炎状态转变,这或许是减肥手术后脂肪细胞功能改善的关键之处。但由于减肥手术标准严格[30]、并发症多,适用人群不够广泛,本研究试图找到其他可改善脂肪细胞功能的药物,如中药单体。
本研究通过GEO数据库中的两个数据集分别筛选出肥胖人群向非肥胖人群转化后的DEGs,以及经减肥手术治疗前后患者的DEGs,并确定了64个共同的DEGs,GO富集分析发现这64个DEGs主要与炎症相关,与之前的文献报道一致[31]。其中下调的45个基因主要与中性粒细胞介导的免疫反应和体液免疫等生物学过程有关,提示减肥手术缓解了肥胖引起的脂肪组织炎症。此外,这64个DEGs多位于分泌颗粒、特定的颗粒及低密度脂蛋白颗粒中,分子功能多与炎症趋化因子活动相关。KEGG通路分析结果显示,下调的DEGs多与补体和凝血级联反应及内分泌代谢等通路有关。
本研究进一步对64个DEGs构建PPI网络,筛选出18个hub基因。ACP5作为脂肪组织巨噬细胞的标志物,可编码酒石酸抗性酸磷酸酶,后者在小鼠中过表达后表现为增生性肥胖,并可促进前脂肪细胞进入细胞增殖周期[32]。MMP9作为巨噬细胞活化标志物,可通过参与脂肪组织的细胞外间质重构来应对脂肪组织的扩张[33],但目前尚不明确其是否对脂肪细胞本身的功能具有调节作用。脂肪组织中免疫球蛋白FCER1G,补体蛋白家族的C1QB、C1QC,补体受体VSIG4,趋化因子CCL2及配体蛋白TYROB均与免疫有关;SPP1是可上调ITF-γ和IL-12表达的细胞因子,与肥胖呈正相关[34],提示此类hub基因可能在调节脂肪组织炎症中发挥一定作用,但仍需进一步证实。本研究筛选出的hub基因并非常见的脂肪细胞炎症标志物,但可作为观察肥胖是否改善的伴随指标。
本研究在cMAP平台筛选出同样调控这18个hub基因的小分子药物,有1309个小分子药物作用后可观察到这些hub基因的相应变化,而最终筛选得到28个无明显不良反应且适合口服的中药单体,其中的22个中药单体已被证实能够减重或通过其他方式改善肥胖。这22个中药单体中,不乏熟知的抗肥胖药物(如小檗碱、雷公藤红素、儿茶素、辣椒素、熊果酸、青蒿素及其衍生物等)和近年才发现的抗肥胖药物(如杨梅素、白桦脂酸、白杨素、槭树素、橘皮苷等),提示本研究方法预测出的药物可靠性高。
另6个中药单体尚无报道提示其可改善肥胖。有研究发现,岩白菜素可下调间充质干细胞中的脂肪细胞特异性标志物PPARγ[2],银杏内酯A可抑制骨髓基质细胞的成脂分化[3],而肥胖的外在表现形式是白色脂肪组织过度积累。绝大多数脂肪细胞在分化状态与未分化的前体状态之间循环[1],故抑制脂肪细胞分化是改善肥胖的一种途径。因此,笔者猜测岩白菜素和银杏内酯A或许可通过抑制白色脂肪分化而改善肥胖,并利用3T3-L1细胞诱导分化的WAT模型进行验证;此外,hub基因主要与炎症相关,推测这两个中药单体可缓解炎症反应。因筛选出的hub基因在肥胖中的作用机制尚不明确,故本研究选择了与肥胖炎症相关的标志物IL-6进行验证。在细胞水平上,本研究初步证实岩白菜素和银杏内酯A可下调WAT中炎性因子IL-6、脂肪细胞分化标志物PPARγmRNA的表达,提示岩白菜素和银杏内酯A可能具有通过调控脂肪细胞而改善炎症,以及抑制脂肪细胞分化的作用,进一步证实了此筛选方法的可靠性。但岩白菜素和银杏内酯A是否还通过其他作用机制改善肥胖,仍有待进一步验证。尚无研究发现另外4个中药单体与肥胖相关,但是cMAP数据库提示其可靶向与炎症相关的hub基因,因此,笔者猜测这4个中药单体也可能通过改善炎症而发挥改善肥胖的作用,后续将进一步明确其是否可调节炎症水平,并对其改善肥胖的作用和机制进行深入探讨。
综上所述,本研究通过生物信息学分析预测可能调控脂肪细胞功能改善肥胖的中药单体,共筛选出28个中药单体,其中22个已被证实可改善肥胖,仍有6个中药单体未被证实具有改善肥胖的作用。本研究初步证实2个中药单体(岩白菜素和银杏内酯A)可能改善肥胖,表明此研究方法筛选的药物可靠,为后续寻找和开发治疗肥胖的药物提供了新思路,另外4个中药单体的作用则仍有待进一步研究证实。

