非重型肺源性急性呼吸窘迫综合征患者的预后影响因素分析
孙伟,王晶
首都医科大学附属北京朝阳医院京西院区呼吸与危重症医学科,北京 100043
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)本质上为炎症反应引起的肺损伤,主要表现为肺血管通透性增加、通气肺组织减少及肺实质重量增加[1-3]。尽管ARDS的病理生理机制及治疗研究取得了一些进展,如肺保护性通气策略、俯卧位通气等[4],但其病死率仍居高不下[5]。大型流行病学调查显示,轻、中、重型ARDS的病死率均较高,分别为34.9%、40.3%、46.1%[6]。因此,对影响ARDS患者预后的因素进行研究显的尤为重要,如何快速准确地利用临床上较为容易获取的数据评估预后成为新的研究方向。有研究发现,血清Clara细胞分泌蛋白16(Clara cells 16,CC16)和可溶性晚期糖基化终产物受体(soluble receptor for advanced glycation end products,sRAGE)对ARDS的诊断及预后评估具有一定价值[7],但其在临床上不易获得且检测价格昂贵。既往研究发现,影响ARDS病死率的因素包括氧合指数、有创机械通气时的平台压[8]、影像学改变[9]、高血糖[10]等。影响预后的因素不尽相同,也许与引起ARDS的潜在因素不同有关,有研究发现,肺源性与肺外源性ARDS的病理生理机制有明显区别,二者在体内炎症反应[11]、肺组织病理学及呼吸力学特点等方面都存在异质性[12]。此外,不同严重程度的ARDS患者对同一治疗手段的反应亦不同[13]。本研究分析非重型肺源性ARDS患者预后的影响因素,以期为临床医师提供一种准确、简单、易行的预后判断方法。
1 资料与方法
1.1 研究对象 本研究为回顾性研究。收集2017年1月-2021年6月北京朝阳医院京西院区收治的非重型肺源性ARDS患者123例,其中男82例,女41例;轻型ARDS 68例,中型ARDS 55例;ARDS的原因均为肺部感染。根据30 d生存情况分为死亡组(n=45)与存活组(n=78)。纳入标准:(1)年龄≥18岁;(2)出院诊断包括肺炎、Ⅰ型呼吸衰竭(氧合指数100~300 mmHg);(3)入院24 h内检查胸部CT;(4)符合ARDS诊断标准(发病时间≤1周;胸部影像学表现为双肺渗出影;肺渗出影不能用液体负荷过重或左心衰竭解释);(5)病历资料完整。排除标准:(1)ARDS并非由肺部原发病引起;(2)合并严重的间质性肺疾病、慢性阻塞性肺疾病、支气管扩张等基础肺疾病;(3)合并严重心脑血管疾病、肝肾疾病或器官衰竭、恶性肿瘤。本研究通过北京朝阳医院医学伦理学委员会批准(2021-科-460)。
1.2 治疗方法 患者入院后均接受胸部CT检查,根据病情给予抗感染、适当的氧疗措施(包括氧疗、高流量吸氧、无创呼吸机,根据患者情况选用)以及其他对症治疗(如复苏抗休克、纠正脏器功能不全、营养支持、维持内环境稳定等综合治疗)。入院24 h检测血常规、C反应蛋白(CRP)、降钙素原、纤维蛋白原、白蛋白、脑钠肽(brain natriuretic peptide,BNP)及动脉血气等,并计算外周血中性粒细胞/淋巴细胞比值(NLR)和氧合指数(PaO2/FiO2)。
1.3 临床观察指标 收集患者的基线资料(包括年龄、性别、入院时APACHE Ⅱ评分等),合并症(包括深静脉血栓、肾衰竭、休克、肝功能异常等),基础疾病(包括入院前是否使用糖皮质激素、高血压、2型糖尿病、呼吸系统疾病、心脏基础疾病、恶性肿瘤等),以及入院时生命体征(包括心率、血压、体温及脉搏等)。记录病程中是否出现深静脉血栓、肾功能不全及休克等情况。
1.4 观察时间 观察时间为30 d,主要终点事件为死亡。若患者在第30天时仍未出院,则在医院观察生存状态;若患者在第30天已经出院,则电话联系患者或家属确定其生存状态。
1.5 ARDS患者生存状态的影响因素分析 使用Kaplan-Meier法绘制生存曲线,采用log-rank检验评估生存曲线的差异。采用Cox比例风险回归模型分析影响患者生存状态的危险因素。将单因素分析中有统计学差异的指标及有临床意义的指标纳入多因素Cox生存分析。
1.6 影响因素对ARDS患者预后的预测效能分析 采用ROC曲线评估上述影响因素对ARDS患者预后的预测效能,计算ROC曲线下面积(area under the curve,AUC)及临界值,以AUC>0.5为具有诊断价值。
1.7 统计学处理 采用SPSS 21.0软件进行统计分析,GraphPad Prism 7软件绘图。符合正态分布的连续变量以±s表示,两组间比较采用t检验;不符合正态分布的连续变量以M(Q1,Q3)表示,两组间比较采用Mann-WhitneyU检验。分类变量以例(%)表示,两组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组基线资料及临床指标比较 观察30 d,死亡45例,存活78例,病死率为36.6%。两组性别、年龄,吸烟、入院前长期使用糖皮质激素比例,心率、平均血压、pH、HCO3-、PaO2/FiO2、白细胞计数、降钙素原、BNP水平比较,差异均无统计学意义(P>0.05)。在合并症方面,死亡组患者出现肾功能不全、深静脉血栓及休克的比例高于存活组(P<0.05)。与存活组比较,死亡组患者入院时体温较高(P=0.045)、呼吸频率较快(P=0.004)。在临床指标方面,死亡组患者APACHE Ⅱ评分、NLR及纤维蛋白原、CRP水平均高于存活组(P<0.05),动脉血二氧化碳分压(PaCO2)、血小板计数及白蛋白水平均低于存活组(P<0.05)(表1)。
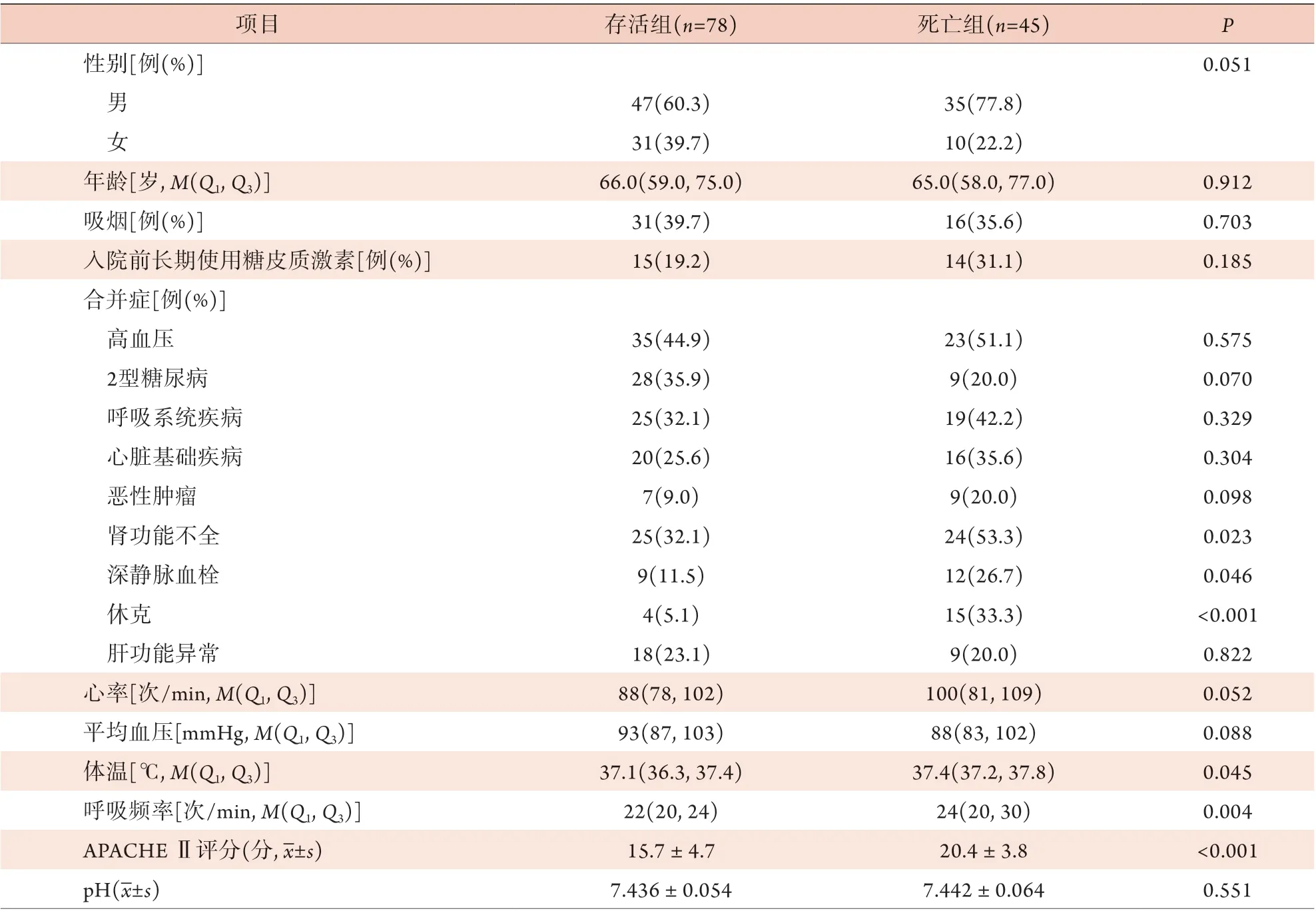
表1 非重型肺源性ARDS患者基线资料及临床指标比较Tab.1 Comparison of baseline characteristics and clinical indicators of patients with non-severe pulmonary ARDS
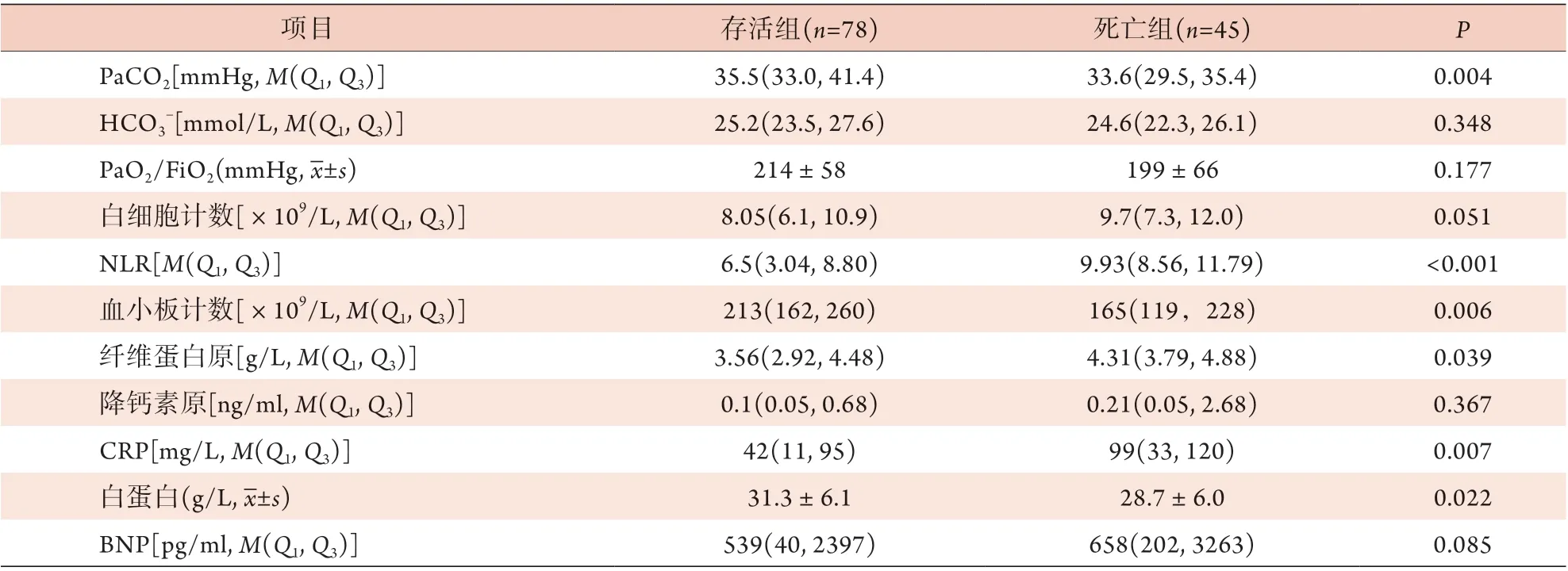
(续 表)
2.2 非重型肺源性ARDS患者生存状态的影响因素分析 Kaplan-Meier生存分析显示,肾功能不全、深静脉血栓及休克是非重型肺源性ARDS患者30 d死亡的危险因素(P<0.05,表2)。
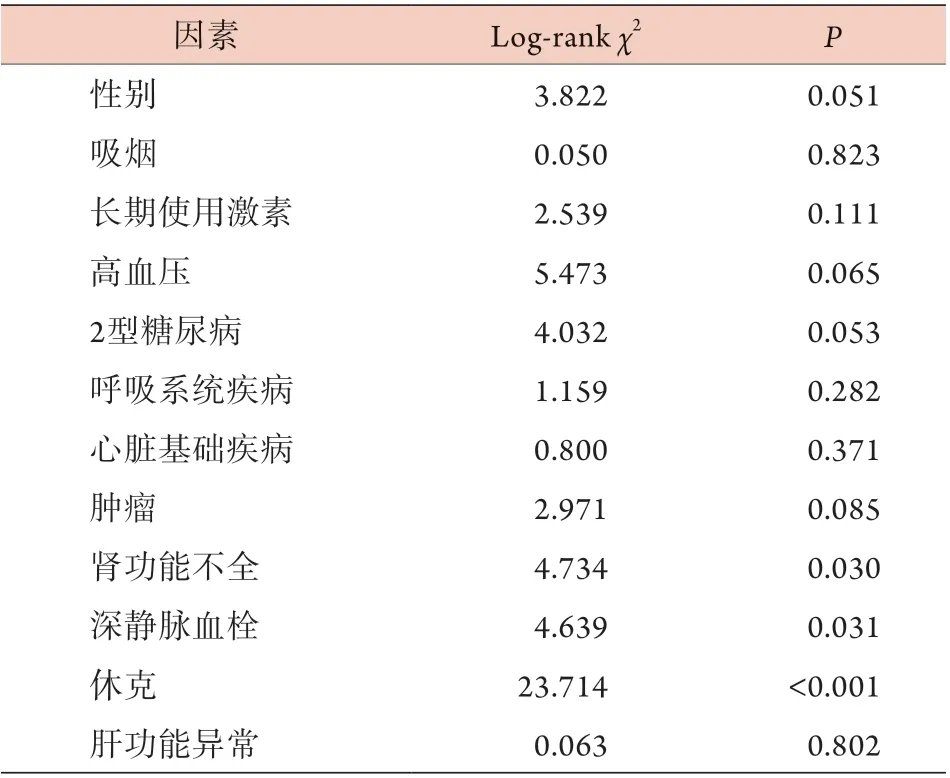
表2 非重型肺源性ARDS患者30 d死亡的Kaplan-Meier生存分析Tab.2 Kaplan-Meier survival analysis of 30-day mortality in patients with non-severe pulmonary ARDS
单因素Cox生存分析显示,心率、体温、呼吸频率、PaCO2、NLR、白细胞计数、血小板计数、纤维蛋白原、CRP、白蛋白及APACHE Ⅱ评分是非重型肺源性ARDS患者30 d死亡的危险因素(P<0.05,表3)。多因素Cox生存分析显示,高APACHE Ⅱ评分(HR=1.094,95%CI 1.009~1.120,P=0.031)、高NLR (HR=1.087,95%CI 1.012~1.167,P=0.021)及病程中出现休克(HR=3.135,95%CI 1.315~6.964,P=0.010)是非重型肺源性ARDS患者30 d死亡的独立危险因素(图1)。
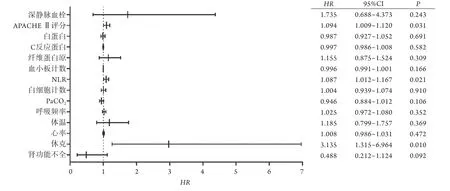
图1 非重型肺源性ARDS患者30 d死亡的多因素Cox生存分析Fig.1 Multivariate Cox survival analysis of 30-day mortality in patients with non-severe pulmonary ARDS
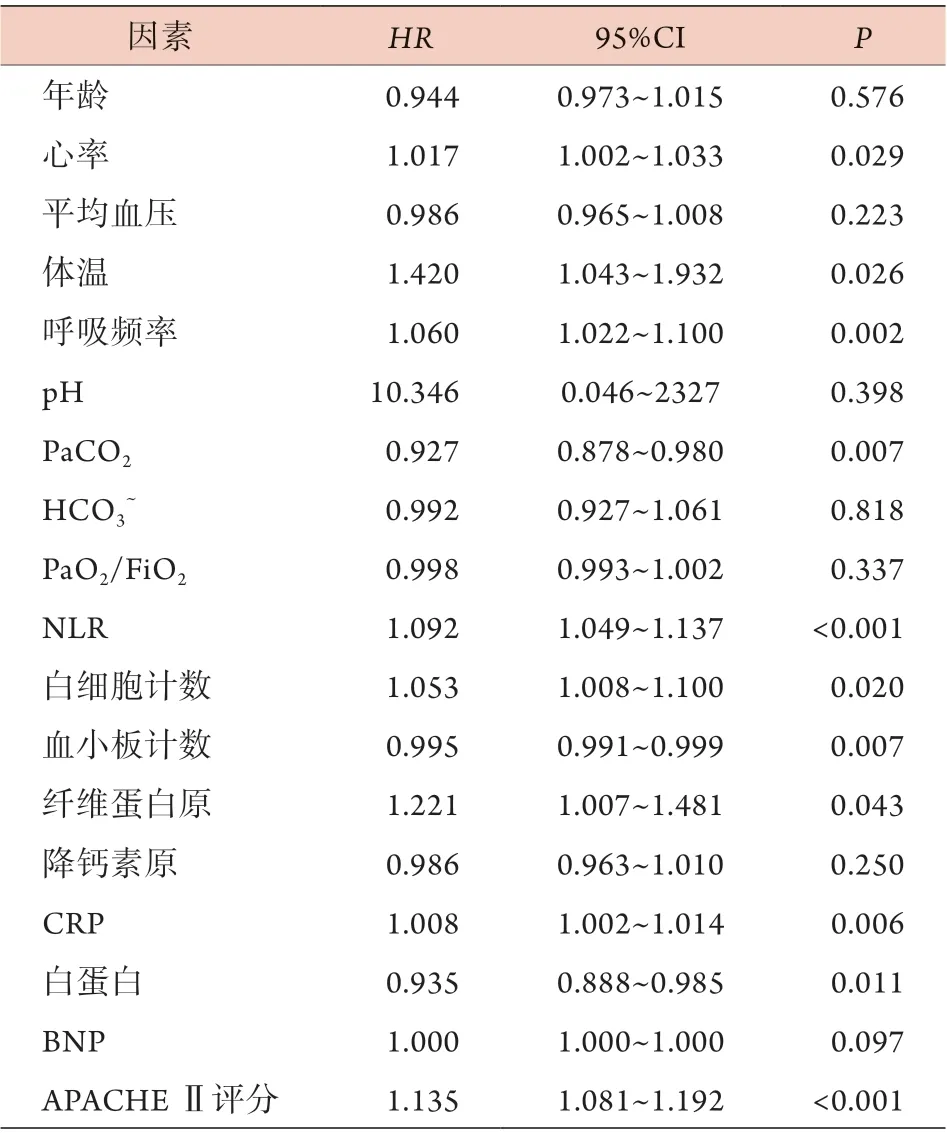
表3 非重型肺源性ARDS患者30 d死亡的单因素Cox生存分析Tab.3 Univariate Cox survival analysis of 30-day mortality in patients with non-severe pulmonary ARDS
2.3 A PACH E Ⅱ评分、NLR对非重型肺源性ARDS预后的预测效能 ROC曲线分析结果显示,APACHE Ⅱ评分、NLR预测非重型肺源性ARDS患者30 d死亡的截断值分别为16.5分、8.13,曲线下面积(AUC)分别为0.803(95%CI 0.727~0.879,P<0.001)和0.772(95%CI 0.688~0.856,P<0.001) (图2、表4)。

表4 APCHE Ⅱ评分、NLR对非重型肺源性ARDS患者预后的预测效能Tab.4 Predictive efficacy of APACHE Ⅱ score and NLR on non-severe pulmonary ARDS patients
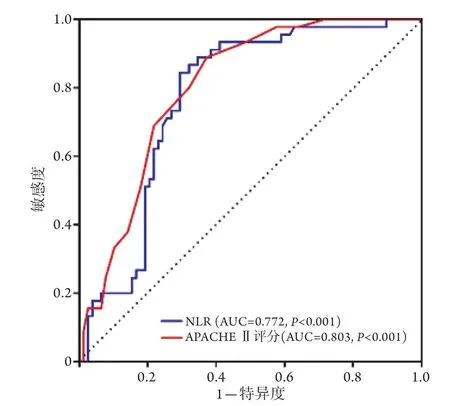
图2 APCHE Ⅱ评分、NLR预测非重型肺源性ARDS患者预后的ROC曲线分析Fig.2 ROC curve analysis of APACHE Ⅱ score and NLR in predicting prognosis of non-severe pulmonary ARDS patients
3 讨 论
ARDS病死率高、治疗手段有限,且轻、中型ARDS可进展为重型,致使病死率进一步增高。因此,准确简便地评估病情、找到与预后相关的因素,并给予相应的治疗措施是降低ARDS病死率、改善预后的关键。本研究以非重型肺源性ARDS患者为研究对象,发现休克、NLR>8.13、APACHE Ⅱ评分>16.5分是其30 d死亡的独立危险因素。因此,对于初始NLR高、APACHE Ⅱ评分高,且病程中出现休克的患者,应给予充分的重视及积极的救治以降低病死率。
作为一个炎症指标,NLR已被证实与多种疾病的预后相关[14-16]。Wang等[17]发现,NLR>14是ARDS患者死亡的独立影响因素,较本研究中NLR临界值高,分析原因可能是其研究纳入的ARDS患者不单是肺源性的,还包括肺外因素引起的ARDS。另外,该研究纳入患者的氧合指数为126 mmHg,明显低于本研究的数值(存活组氧合指数为214 mmHg、死亡组为199 mmHg),提示NLR越高,ARDS患者体内炎症反应越重,氧合指数可能越低。Li等[18]发现,高NLR是ARDS患者死亡的独立危险因素。中性粒细胞与感染密切相关,任何部位的感染都可诱发骨髓释放大量中性粒细胞[19],中性粒细胞计数越高提示感染程度越重、病死率可能越高。此外,中性粒细胞是ARDS病程中首先被募集到炎症部位的白细胞[20],被募集后通过释放氧自由基、多种蛋白酶及形成细胞外网的方式执行抗菌功能,但不可控的中性粒细胞过度活化会对局部组织造成严重损伤[21],如肺毛细血管的通透性增加等,从而加重缺氧。本研究死亡组缺氧程度较存活组严重[氧合指数(199±66) mmHgvs.(214±58) mmHg],虽然无统计学差异,但也提示死亡患者的组织损伤较存活者严重。
APACHE Ⅱ评分被广泛用于重症患者的评估。国内的ARDS相关研究发现,APACHE Ⅱ评分在存活组与死亡组ARDS患者间差异明显[22]。既往研究发现,腹腔手术后继发ARDS与未发生ARDS的患者APACHE Ⅱ评分差异明显,且是预测ARDS患者死亡的独立危险因素[23]。此外,一项纳入207例ARDS(包括肺源性和肺外源性ARDS)患者的研究发现,APACHE Ⅱ评分也是影响ARDS患者生存状态的独立危险因素[24]。本研究发现,APACHE Ⅱ评分是影响非重型肺源性ARDS患者生存状态的独立危险因素。肺源性和肺外源性ARDS均以肺上皮细胞及肺血管内皮细胞受损为主要特征,这些上皮细胞及内皮细胞受损可导致肺毛细血管通透性增加,使肺局部产生的炎性因子更多地进入到循环血中,从而引起全身不良反应[25],进而引起APACHE Ⅱ评分升高。
国外大型研究发现,ARDS可大致分为高炎症反应和低炎症反应,高炎症反应患者出现低血压或使用血管活性药物的比例较高,且病死率明显高于低炎症反应患者[26-27]。本研究结果显示,死亡组患者的NLR及CRP水平均高于存活组,提示死亡组患者体内炎症反应较存活组严重;死亡组患者出现休克的比例及病死率高于存活组,与国外大型研究结果[26]一致。另有研究发现,休克是高龄ARDS患者死亡的独立危险因素[28],该研究纳入患者的年龄为65岁以上,而本研究纳入的两组患者的中位年龄分别为66岁和65岁,与上述研究相仿。
除以上三个独立影响生存状态的因素外,还有一些指标值得注意。本研究结果显示,发生深静脉血栓是死亡的危险因素,且死亡组患者的血小板计数明显低于存活组,纤维蛋白原水平明显高于存活组,提示非重型ARDS患者体内的凝血功能被异常激活。既往有研究发现,ARDS患者外周血组织因子水平高于非ARDS患者,而组织因子是最强的外源性凝血激活因子[29]。本研究虽未测定组织因子水平,但死亡组发生深静脉血栓的比例较高且凝血系统异常激活,与既往研究结果[29]一致。另有研究发现,非肺源性ARDS患者的凝血功能紊乱较肺源性ARDS患者明显[30]。
综上所述,对于非重型肺源性ARDS患者,高APACHE Ⅱ评分(>16.5分)、高NLR(>8.13)以及病程中出现休克是其死亡的独立危险因素。由于缺乏特异的治疗手段,ARDS患者的病死率仍居高不下,准确快捷地识别死亡危险因素有助于改善ARDS的预后。因此,早期评估、密切观察病情变化有利于预后评估,而根据病情及时调整治疗方案可改善患者的临床结局。本研究的不足之处为单中心回顾性研究,样本量较小,未来仍需通过大样本、多中心前瞻性研究进一步探讨影响非重型肺源性ARDS患者生存状态的因素。

