维替泊芬在实验性哮喘气道重塑中的作用及其机制
刘敏,王艺颖,简鼎,李媛媛,张光莉,罗征秀
重庆医科大学附属儿童医院呼吸科/儿童发育疾病研究教育部重点实验室/国家儿童健康与疾病临床医学研究中心/儿童发育重大疾病国家国际科技合作基地/儿科学重庆市重点实验室,重庆 400014
哮喘是一种慢性气道炎症性疾病,其特征为可逆性气流受限及气道高反应性[1-2]。全球约有3.58亿哮喘患者[3],我国成年哮喘患者多达4570万[4],哮喘已成为全球性的重大公共卫生问题。气道重塑不同程度地参与了哮喘的疾病进程,是哮喘出现不可逆气流受限、激素敏感性降低、病情持续加重的关键因素,其病理特点为气道平滑肌细胞(airway smooth muscle cell,ASMC)增生肥厚,且增生程度越重病情越严重[5-7]。Hippo/Yes相关蛋白(Yes-associated protein,YAP)通路可通过磷酸化级联反应调控细胞的增殖和凋亡。研究证实,血管平滑肌细胞中Hippo/YAP通路的活性受到抑制可使下游分子YAP磷酸化水平降低,YAP转运进入细胞核,与TEA结构域转录因子(TEA domain transcription factor,TEAD)结合并激活下游靶基因,引发一系列心血管疾病[8-10]。维替泊芬(verteporfin,Vp)是治疗新生血管黄斑变性的药物,近年来发现其可通过改变YAP的空间构象而抑制YAP与TEAD的结合,进而抑制肿瘤细胞的过度增殖[11]。ASMC与血管平滑肌细胞具有高度同源性,而Vp在哮喘气道重塑中的作用尚不清楚。本研究通过动物实验与细胞实验探讨Vp在实验性哮喘气道重塑中的作用机制。
1 材料与方法
1.1 主要试剂及仪器 屋尘螨提取液(house dust mite,HDM)购自美国Geerlabs公司;Vp购自上海茁彩生物科技有限公司;总RNA提取试剂盒购自合肥博美生物科技有限公司;兔抗人YAP、骨桥蛋白(osteopontin,OPN)、平滑肌肌球蛋白重链(smooth muscle myosin heavy chain,SMMHC)多克隆抗体购自武汉Servicebio公司;生物素化山羊抗兔IgG(H+L)购自上海Abcam公司;CCK-8检测试剂盒购自中国Biosharp公司;Annexin V-APC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司。荧光定量PCR仪、酶标仪购自美国ThermoFisher公司。
1.2 动物实验 6~8周龄SPF级BALB/c雌性小鼠12只,体重18~22 g,购自成都达硕实验动物有限公司[实验动物生产许可证号:SYXK(川)2015-030;使用许可证号:SYXK(川)2014-189]。本研究经四川大学华西医院动物伦理委员会审批,实验过程符合国家和单位有关实验动物管理及使用的规定。
1.2.1 哮喘模型的建立及实验分组 采用随机数字表法将12只雌性BALB/c小鼠分为对照组、实验性哮喘组与Vp干预组,每组4只。
实验性哮喘组每周给予HDM液(0.67 g/L,30 μl)滴鼻致敏1次,持续3周,从第23天开始,间隔1 d给予同剂量HDM滴鼻激发,直至第33天,每次激发前30 min腹腔注射100 μl生理盐水[12-14]。Vp干预组建模方式同实验性哮喘组,每次激发前30 min腹腔注射Vp溶液100 μl(10 mg/ml)[15]。对照组给予等量生理盐水进行滴鼻致敏及腹腔注射干预。饲养过程中观察小鼠一般情况,如毛发、呼吸频率、活动情况等,最终采集小鼠肺组织及支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)进行后续研究。实验性哮喘小鼠模型建立方法如图1所示。
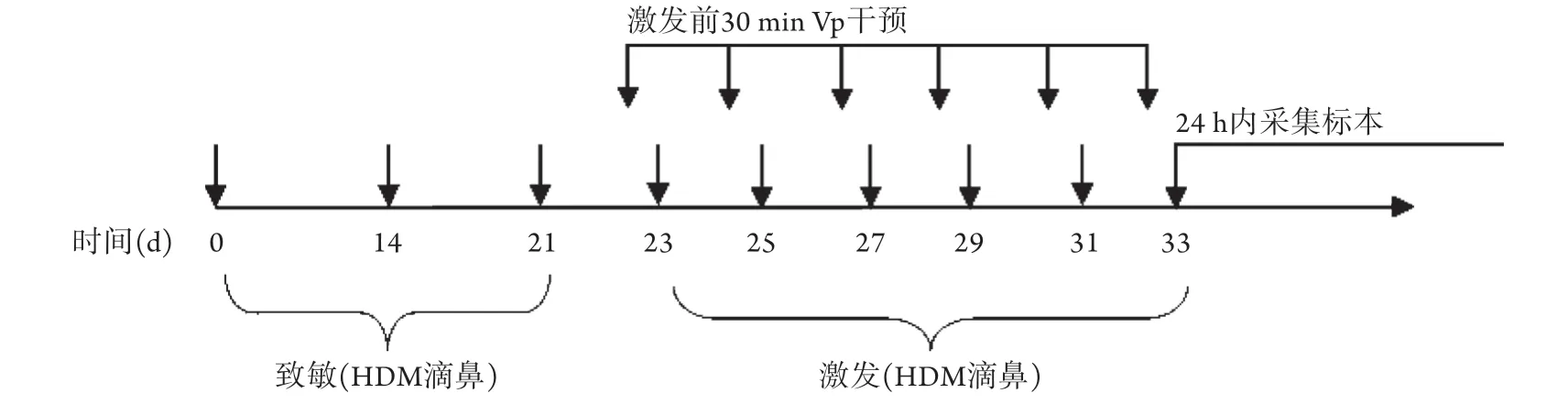
图1 实验性哮喘小鼠模型建立方法Fig.1 Establishment of experimental asthma mice model
1.2.2 HE染色观察肺组织病理变化 肺组织经10%中性甲醛溶液固定后,脱水、石蜡包埋、切片,苏木精染色20 min,水洗后伊红染色5 min,中性树胶封片,于显微镜下观察,并测量气道平滑肌厚度、支气管基底膜厚度及支气管管壁厚度。气道平滑肌厚度(μm)=支气管平滑肌面积(μm2)/管腔基底膜周长(μm);支气管管壁厚度(μm)=支气管管壁总面积(μm2)/管腔基底膜周长(μm)[16]。
1.2.3 瑞氏-吉姆萨染色计数BLAF中的炎性细胞取10 μl BALF计数细胞总数,剩余BALF以1000 r/min高速离心后涂片,自然干燥后用瑞氏-吉姆萨染液染色2 min,滴加等量磷酸盐缓冲液与瑞氏-吉姆萨染液混匀并染色3 min,流水冲洗后封片镜检。
1.2.4 Masson染色观察肺组织胶原纤维沉积情况肺组织切片脱蜡后使用Bouin液媒染,然后用天青石蓝和苏木精滴染3 min、丽春红品红滴染10 min、苯胺蓝滴染5 min,梯度乙醇脱水后二甲苯透明,最后封片镜检。
1.2.5 过碘酸希夫(Periodic Acid-Schiff,PAS)染色观察肺组织杯状细胞增生情况 肺组织切片经脱蜡、水洗后,使用高碘酸氧化液氧化10 min,蒸馏水洗后用Schiff液染色10 min,苏木精复染2 min,乙醇分化后经二甲苯透明,最后封片镜检。采用Image-Pro Plus 6.0图像软件测定PAS阳性染色面积(400倍视野)。
1.2.6 免疫组化检测肺组织中YAP、磷酸化YAP(p-YAP)的表达 肺组织切片经脱蜡后于柠檬酸盐缓冲液中进行加热,用磷酸盐缓冲液冲洗后放入3%H2O2中浸泡10 min,滴加山羊血清封闭液,分别加入一抗、二抗,DAB染液室温显色,阳性为棕黄色,蒸馏水冲洗终止显色,苏木精复染3 min,梯度乙醇脱水、二甲苯透明后封片镜检。
1.2.7 RT-PCR检测肺组织中YAP、OPN、SMMHCm R N A 的表达 将小鼠肺组织标本剪碎,每50~100 mg肺组织加入1 ml Trizol和0.2 ml氯仿,剧烈振荡后12 000 r/min离心15 min提取总RNA,反转录合成cDNA。引物序列如表1所示。反应体系:2×Real PCR EasyTMMix-SYBR 10 μl,上、下游引物各0.8 μl,模板DNA 2 μl,加入ddH2O至20 μl。反应参数:95 ℃预变性30 s;95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,循环45次。使用Thermo Scientific PikoReal软件进行分析,采用2-ΔΔCt法计算YAP、OPN、SMMHCmRNA的相对表达水平。

表1 RT-PCR引物序列Tab.1 Primer sequences of RT-PCR
1.2.8 Western blotting检测肺组织中YAP、p-YAP、OPN、SMMHC蛋白的表达 用RIPA液冰上裂解肺组织10 min,然后12 000 r/min离心10 min,取上清液,用BCA法测定蛋白浓度。经变性、电泳、转膜、封闭后,加入一抗(兔抗人YAP、p-YAP、OPN、SMMHC、β-actin抗体稀释倍数分别为1:1000、1:2000、1:1000、1:1000、1:100 000)孵育过夜;洗涤3次,加入二抗(1:5000)孵育3 h;洗涤3次,加入ECL发光液显色,曝光显影后,以β-actin为内参,采用图像分析软件分析YAP、p-YAP、OPN、SMMHC蛋白的相对表达量。
1.3 细胞实验 人气道平滑肌细胞(human airway smooth muscle cell,HASMC)购自湖南丰晖生物科技有限公司,37 ℃复苏后,于RPMI 1640培养基中在5% CO2、37 ℃培养箱中培养。
1.3.1 CCK-8法检测细胞增殖能力 取对数生长期细胞,用PBS洗涤、离心后,接种于96孔板中(100 μl/孔),于37 ℃、5% CO2条件下恒温培养。设置对照组、HDM组与不同浓度(0.025、0.05、0.08、0.10 mg/L)Vp+HDM组。不同浓度Vp+HDM组细胞用0.025、0.05、0.08、0.10 mg/L Vp刺激2 h后,再加入50 μg/ml HDM作用24 h;HDM组细胞以等量生理盐水代替Vp,采用与Vp+HDM组相同的培养方法;对照组细胞以等量生理盐水代替Vp和HDM。每孔加入10 μl CCK-8液继续培养2 h,采用多功能酶标仪测定450 nm波长处每孔的吸光度(OD)值。实验重复4次。选取Vp发挥有效抑制能力的最低浓度(0.05 mg/L)进行后续实验。
取对数生长期细胞,用0.05 mg/L Vp作用9 h、12 h、24 h后,采用多功能酶标仪测定450 nm波长处每孔的OD值,实验重复4次。选取0.05 mg/L Vp作用细胞24 h进行后续实验。
1.3.2 流式细胞术检测细胞凋亡率 取对数生长期细胞,设置对照组、HDM组与HDM+Vp组。HDM+Vp组细胞用0.05 mg/L Vp刺激2 h后,加入50 μg/ml HDM作用24 h;HDM组细胞以等量生理盐水代替Vp,采用与HDM+Vp组相同的培养方法;对照组细胞以等量生理盐水代替Vp和HDM。取上清液,PBS洗涤细胞并离心,弃上清,加入500 μl结合缓冲液重悬细胞,加入5 μl Annexin V-FITC及5 μl PI,上机检测细胞凋亡率。
1.3.3 Western blotting检测YAP、OPN、SMMHC蛋白的表达 取对数生长期细胞,设置对照组、HDM组与HDM+Vp组,各组处理方法同1.3.2。采用Western blotting检测各组细胞中YAP、OPN、SMMHC蛋白的相对表达水平,操作步骤同1.2.8。
1.4 统计学处理 使用SPSS 24.0软件进行统计分析。计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较若方差齐则采用LSD检验,方差不齐则采用Tamhane's T2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况及气道炎症比较 对照组小鼠毛发光亮,呼吸及活动良好,肺组织HE染色未见炎性细胞浸润;实验性哮喘组小鼠呼吸频率加快、毛发竖立、口唇发绀、四肢乏力、活动减少,肺组织HE染色显示支气管腔、肺间质有大量炎性细胞浸润;Vp干预组小鼠的症状介于上述两组之间,肺组织HE染色可见炎性细胞明显减少(图2)。
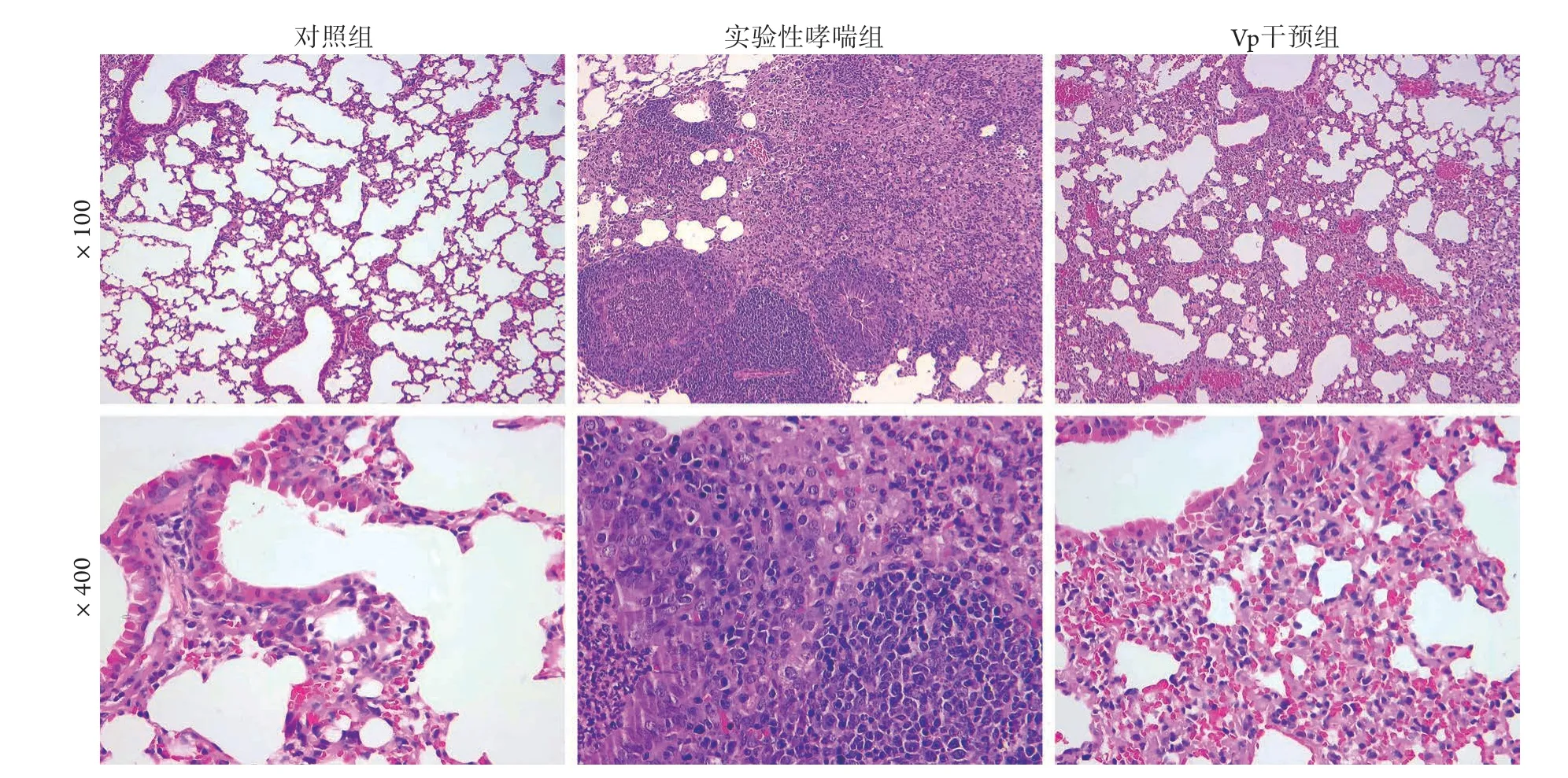
图2 各组小鼠肺组织病理变化(HE染色)Fig.2 Pathological changes of lung tissues of mice in each group (HE staining)
瑞氏-吉姆萨染色结果显示,实验性哮喘组小鼠BALF中细胞总数及嗜酸性粒细胞、中性粒细胞、淋巴细胞比例明显高于对照组,巨噬细胞比例明显低于对照组(P<0.05),与实验性哮喘组比较,Vp干预后小鼠BALF中细胞总数和嗜酸性粒细胞比例明显降低,中性粒细胞、巨噬细胞比例明显升高(P<0.05);与对照组比较,Vp干预后小鼠BALF中嗜酸性粒细胞及中性粒细胞比例明显升高(P<0.05)(表2)。
表2 各组小鼠BALF中炎性细胞计数比较(±s, n=4)Tab.2 Comparison of the number of inflammatory cells in BALF of mice in each group (±s, n=4)
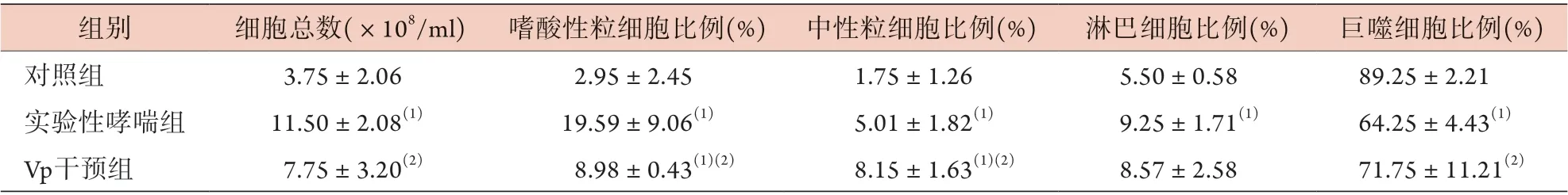
表2 各组小鼠BALF中炎性细胞计数比较(±s, n=4)Tab.2 Comparison of the number of inflammatory cells in BALF of mice in each group (±s, n=4)
BALF. 支气管肺泡灌洗液;Vp. 维替泊芬;与对照组比较,(1)P<0.05;与实验性哮喘组比较,(2)P<0.05
组别 细胞总数(×108/ml) 嗜酸性粒细胞比例(%) 中性粒细胞比例(%) 淋巴细胞比例(%) 巨噬细胞比例(%)对照组 3.75±2.06 2.95±2.45 1.75±1.26 5.50±0.58 89.25±2.21实验性哮喘组 11.50±2.08(1) 19.59±9.06(1) 5.01±1.82(1) 9.25±1.71(1) 64.25±4.43(1)Vp干预组 7.75±3.20(2) 8.98±0.43(1)(2) 8.15±1.63(1)(2) 8.57±2.58 71.75±11.21(2)
2.2 各组小鼠气道结构变化情况 HE、Masson和PAS染色结果显示,实验性哮喘组小鼠支气管基底膜厚度、气道平滑肌厚度、支气管管壁厚度及肺组织胶原纤维沉积面积、PAS染色阳性面积明显高于对照组[(1.13±0.38) μmvs. (0.79±0.36) μm,P<0.05;(6.49±2.36) μmvs. (4.56±1.52) μm,P<0.05;(33.85±5.95) μmvs. (22.08±3.30) μm,P<0.05;5.85%±2.35%vs. 0.36%±0.12%,P<0.01;28.81%±5.89%vs. 13.57%±2.08%,P<0.01];Vp干预后上述指标明显降低[分别为(0.93±0.27) μm、(4.9 9±1.7 5) μ m、(2 6.5 9±2.7 6) μ m、2.14%±0.89%、17.92%±1.89%],差异均有统计学意义(P<0.05);与对照组比较,Vp干预后小鼠支气管基底膜厚度、支气管管壁厚度明显增加(P<0.05),其余指标差异均无统计学意义(P>0.05)(图3-5)。

图5 各组小鼠肺组织PAS染色阳性面积比较(PAS染色,×400)Fig.5 Comparison of PAS staining positive areas in lung tissues of mice in each group (PAS staining ×400)
2.3 各组小鼠肺组织中YAP、p-YAP蛋白表达情况比较 免疫组化检测显示,对照组小鼠肺组织中YAP表达较低;实验性哮喘组细胞核呈深棕黄色,提示细胞核内YAP蛋白呈强阳性表达;而Vp干预后棕黄色染色较实验性哮喘组明显减少,与对照组相近,提示Vp干预后YAP蛋白呈弱阳性表达,且大部分位于细胞质,YAP蛋白核移位明显减少(图6)。对照组p-YAP表达较高;实验性哮喘组棕黄色染色减少,提示p-YAP蛋白表达降低;而Vp干预后棕黄色继续减少,提示p-YAP蛋白表达进一步降低(图6)。
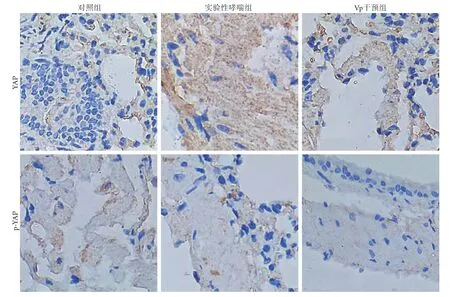
图6 各组小鼠肺组织中YAP、p-YAP蛋白表达情况比较(免疫组化染色,×400)Fig.6 Comparison of the expressions of YAP and p-YAP protein in lung tissue of mice in each group (Immunohistochemistry staining ×400)
2.4 各组小鼠肺组织中YAP、p-YAP、OPN、SMMHC表达情况比较 RT-PCR及Western blotting检测结果显示,与对照组比较,实验性哮喘组YAPmRNA(2.27±0.55vs. 1.01±0.09)和蛋白(2.37±0.06vs. 1.01±0.07)以及OPNmRNA(2.17±0.43vs.1.04±0.36)和蛋白(3.64±0.63vs. 1.73±0.76)表达水平明显增高(P<0.05或P<0.01),S M M HCmRNA(1.06±0.46vs. 2.86±0.68)和蛋白(0.92±0.15v s. 2.1 6±0.2 6)表达水平明显降低(P<0.0 5 或P<0.01);而Vp干预后YAPmRNA(1.15±0.34)和蛋白(1.14±0.08)以及OPNmRNA(1.28±0.34)和蛋白(2.16±0.78)表达水平明显降低(P<0.05或P<0.01),SMMHCmRNA(1.91±0.68)和蛋白(1.69±0.27)表达水平明显升高(P<0.05);而Vp干预组与对照组上述指标差异无统计学意义(P>0.05)(图7-8)。
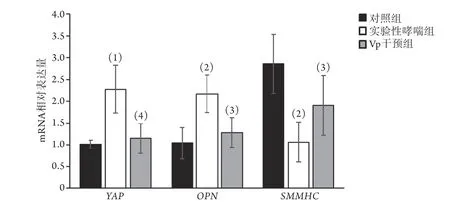
图7 各组小鼠肺组织中YAP、OPN、SMMHC mRNA表达水平比较Fig.7 Comparison of the mRNA expression levels of YAP, OPN and SMMHC in lung tissue of mice in each group
与对照组比较,实验性哮喘组p-YAP/YAP比值明显降低(0.60±0.10vs. 1.80±0.07,P<0.01),而Vp干预后p-YAP/YAP比值(1.21±0.07)明显升高(P<0.05);而Vp干预组与对照组p-YAP/YAP比值差异无统计学意义(P>0.05)(图8)。

图8 各组小鼠肺组织中YAP、p-YAP、OPN、SMMHC蛋白表达水平比较Fig.8 Comparison of the protein expression levels of YAP, p-YAP, OPN and SMMHC in lung tissue of mice in each group
2.5 Vp对HASMC细胞增殖能力的影响 CCK-8法检测结果显示,与对照组比较,HDM组细胞增殖能力明显增强(0.2874±0.0055vs. 0.2626±0.0051,P<0.01);与HDM组比较,0.05、0.08、0.10 mg/L Vp干预后细胞增殖能力减弱(0.2748±0.0043、0.2627±0.0037、0.2519±0.0048,P<0.05或P<0.0 1),且呈浓度依赖性;与对照组比较,0.025 mg/L Vp+HDM组、0.05 mg/L Vp+HDM组细胞增殖能力增强,0.10 mg/L Vp+HDM组细胞增殖能力减弱(P<0.05或P<0.01)(图9A)。据此选择Vp发挥有效抑制能力的最低浓度0.05 mg/L进行后续实验。
采用0.05 mg/L Vp作用12 h后细胞增殖能力明显减弱(0.2748±0.0043vs. 0.2874±0.0055,P<0.05),作用24 h对细胞增殖能力的抑制作用最强(0.4273±0.0087vs. 0.4811±0.0046,P<0.01)(图9B)。据此选择0.05 mg/L Vp作用细胞24 h进行后续实验。

图9 CCK-8法检测Vp对HASMC细胞增殖能力的影响Fig.9 Effect of Vp on the proliferation ability of HASMC cells detected by CCK-8 method
2.6 各组HASMC细胞凋亡率比较 流式细胞术检测结果显示,与对照组比较,HDM组细胞凋亡率明显降低(5.14%±0.82%vs. 6.75%±0.21%,P<0.05);与HDM组比较,HDM+Vp组细胞凋亡率明显增高(6.29%±0.49%,P<0.05);而对照组与HDM+Vp组与对照组细胞凋亡率差异无统计学意义(图10)。
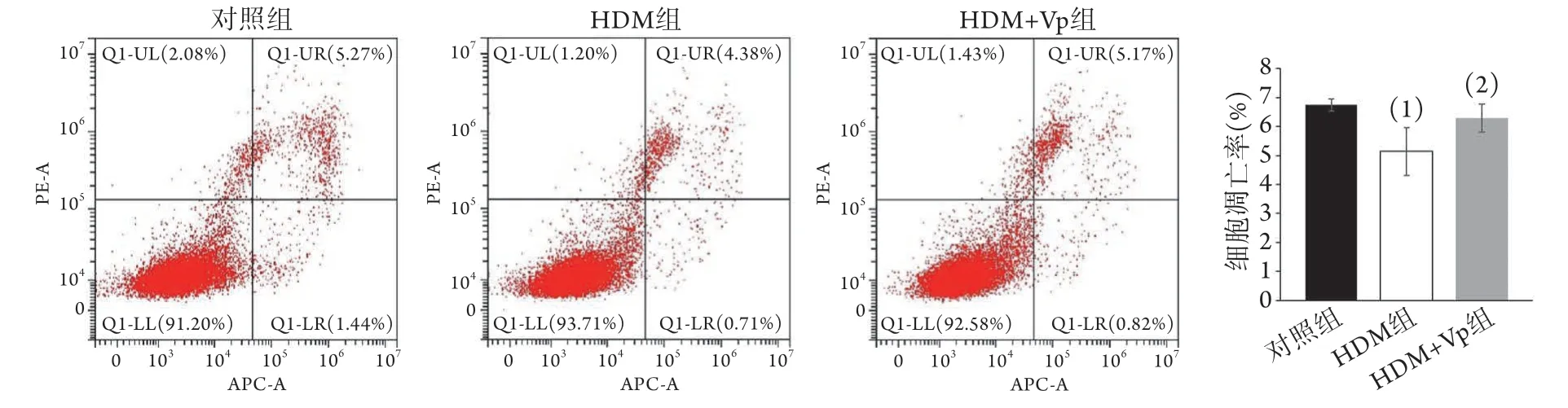
图10 各组HASMC细胞凋亡率比较Fig.10 Comparison of the apoptosis rate of HASMC cells in each group
2.7 各组HASMC细胞中YAP、OPN、SMMHC蛋白相对表达量比较 Western blotting检测结果显示,与对照组比较,HDM组细胞中YAP、OPN蛋白相对表达量明显升高(3.14±0.48vs. 1.51±0.61,P<0.01;5.87±2.42vs. 0.94±0.23,P<0.01),SMMHC蛋白相对表达量明显降低(0.80±0.19vs.2.96±0.96,P<0.01)。与HDM组比较,HDM+Vp组YAP、OPN蛋白相对表达量明显降低(2.02±0.53、2.93±1.09,P<0.05),SMMHC蛋白相对表达量明显升高(2.11±0.85,P<0.05);而HDM+Vp组与对照组上述指标差异无统计学意义(P>0.05)(图11)。
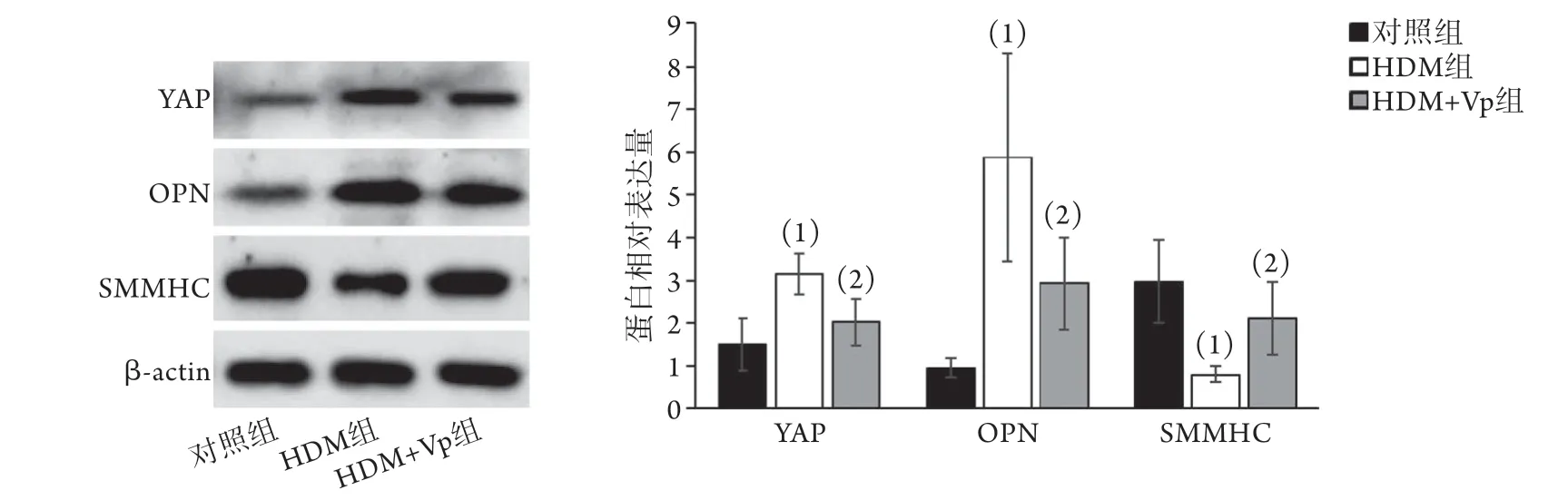
图11 各组HASMC细胞中YAP、OPN、SMMHC蛋白相对表达量比较Fig.11 Comparison of the relative expression levels of YAP, OPN and SMMHC proteins in HASMC cells of each group
3 讨 论
哮喘是一种以可逆性气流受限及气道高反应性为特征的气道炎症性疾病[17]。随着疾病进展,气道组织发生异常修复致使结构改变,形成气道重塑,将可逆性气流受限变为不可逆,同时肺功能下降[18];气道重塑和肺功能下降可增加哮喘再次发作的频率及严重程度,并形成恶性循环。ASMC增生和肥大是气道重塑最显著的病理学特征[6,19],可引起气道壁增厚、气道平滑肌收缩功能增强,进而出现气管腔狭窄、阻力增大,同时重塑后的平滑肌细胞对激素等药物的敏感性下降,最终出现持续性气流受限,这也是哮喘病情持续加重的重要因素。
YAP存在于多种哺乳动物体内,具有诱导细胞增殖、促进组织器官生长的作用,其过表达可导致多种疾病甚至形成肿瘤[20-21]。YAP主要受Hippo信号通路的调控,当外界信号刺激细胞膜上的膜蛋白受体时,通过磷酸化级联反应使Hippo信号通路核心成员哺乳动物不育系20样激酶(mammalian sterile 20-like kinases,MST)、大肿瘤抑制因子(large tumor suppressor,LATS)逐级磷酸化,YAP被磷酸化后可转化为失活状态的p-YAP,并在细胞质中与蛋白结合,进而被泛素化降解失去生理功能[22-23]。当Hippo信号通路被抑制或核心成员缺失时,p-YAP水平降低,YAP水平升高并转运进入细胞核,与核内的转录因子结合,激活靶基因,导致细胞过度增殖并诱发相应疾病[24-26]。Vp在临床上被用于治疗黄斑变性,近年来发现其能改变YAP的空间构象,干扰YAP的核移位及其与TEAD的结合,从而抑制靶基因的表达及细胞增殖[27-28]。Hippo/YAP信号通路参与多种疾病的发生发展[29-31],但是否参与哮喘的进展尚不明确。
本研究采用HDM建立实验性哮喘小鼠模型,并使用Vp干预Hippo信号通路的活性,结果发现,小鼠肺组织发生明显炎症改变,支气管旁胶原纤维沉积增多,支气管基底膜、气道平滑肌及支气管管壁明显增厚,提示采用HDM建立的小鼠哮喘模型具有显著的气道重塑改变,与其他研究结果相符[32-33]。本研究动物实验发现,实验性哮喘组小鼠肺组织细胞质内p-YAP蛋白表达减少,而细胞核YAP蛋白表达增多,提示YAP在哮喘模型细胞核内呈强阳性表达,此外,本研究还发现实验性哮喘组小鼠肺组织的p-YAP/YAP比值下降,提示p-YAP去磷酸化后核移位可能是气道重塑的发病机制之一。而用Vp干预后,小鼠肺组织炎症减轻,支气管旁胶原纤维沉积减少,支气管基底膜、气道平滑肌及支气管管壁明显变薄,提示Vp可抑制HDM引起的气道重塑。进一步研究发现,Vp干预后细胞质p-YAP蛋白表达稍降低,细胞核YAP蛋白表达明显降低,导致p-YAP/YAP比值明显升高,提示Vp抑制气道重塑的机制可能与降低YAP的表达、减少YAP核移位有关。细胞实验发现,经HDM刺激后HASMC的增殖能力增强、凋亡率下降,同时YAP蛋白表达增加,而Vp干预可抑制HDM诱导的细胞增殖,导致细胞凋亡率增高,YAP蛋白表达降低,与动物实验结果一致。
ASMC的表型转化也是哮喘发病的重要机制之一。正常情况下,ASMC处于收缩表型,可调控气道管径、改善肺通气功能,其主要表型标志物为SMMHC;但在哮喘模型中,ASMC可转化为合成型,分泌多种趋化因子和细胞因子,参与哮喘的发病过程,其主要表型标志物为OPN。本研究检测小鼠肺组织及HASMC中YAP、SMMHC、OPN的表达发现,Vp对YAP的抑制作用可在一定程度上逆转哮喘ASMC的表型转化,提示YAP可能是ASMC表型转化的关键因素之一。
综上所述,本研究结果表明,肺组织p-YAP去磷酸化导致YAP核移位增多可能是气道重塑的重要机制,而Vp可通过降低YAP的表达水平、减少YAP核移位、逆转HASMC的表型转化而抑制实验性哮喘小鼠的气道重塑。该结果为哮喘气道重塑的发生机制及治疗提供了新的思路和理论依据,但不足之处在于研究分组未涉及正常小鼠及细胞+Vp处理组,且仅探讨了哮喘气道重塑过程中YAP、p-YAP表达的变化,该通路的具体分子机制尚不明确,有待后续进一步研究。

