基于网络药理学和分子对接技术探讨参知健脑方防治阿尔茨海默病的作用机制
刘川铭,李谢 ,卢熙奎,曾点点,李畏娴
1 大理大学药学院,云南大理 671000;2 大理大学公共卫生学院,云南大理 671000;3 昆明市第三人民医院药学部,云南昆明 650041
阿尔茨海默病(AD)是一种以进行性认知功能障碍和记忆损害为特征的神经退行性疾病。AD 的主要病理特征是β-淀粉样蛋白(Aβ)在神经元胞外聚集形成淀粉样斑块以及胞内微管相关蛋白Tau 的过度磷酸化形成神经原纤维缠结(NFTs),还包括突触功能障碍、线粒体损伤、miRNA 的失调、特异性神经递质减少和神经炎症等多种病理过程[1]。因此,如何防治和延缓AD 已成为现今的研究热点之一。参知健脑方是基于王永炎院士提出的“正虚毒损络阻”病机学说而创立的中药复方,全方由人参、知母、赤芍三味中药组成。多项研究[2-4]表明,人参、知母和赤芍中的活性成分均具有改善痴呆动物模型学习记忆的能力,从而改善其认知功能。本研究借助网络药理学的方法对参知健脑方中的主要活性成分、作用靶点、相关生物信号通路等几个方面的关联性进行了探讨,探究人参、知母、赤芍中潜在活性成分治疗AD 的作用机制,并采用分子对接方法进一步验证。
1 材料与方法
1.1 参知健脑方中活性成分筛选与潜在作用靶点预测 利用中药系统药理学数据库(TCMSP,https://old. tcmsp-e. com/tcmsp. php)、本草组鉴(HERB,http://herb. ac. cn/)和中医药整合药理学研究平台(TCMIP,http://www. tcmip. cn/TCMIP/index. php/)等数据库,分别以“人参”“知母”“赤芍”作为关键词检索其含有的活性成分,并通过查阅文献进行手工筛选以确定活性成分。如有文献报道白藜芦醇是一种神经保护特性的多酚化合物,具有抗氧化、抗炎、抗癌和抗淀粉样蛋白等作用[5],而人参皂苷Rg1 可通过抑制内质网压力介导的途径来抑制NFTs和Aβ的积累[6]。使用TCMSP 数据库时,以口服生物利用度(OB)≥30%,类药性(DL)≥0.18 作为筛选条件[7]。随后利用SwissTarget(http://swisstargetprediction.ch/)、PharmMapper(http://www. lilab-ecust. cn/pharmmap⁃per/)和 SEA(https://sea. bkslab. org/)等数据库查询各活性成分的潜在作用靶点,并将靶点导入Uniprot数据库(https://www.uniprot.org/)进行校正,获取靶点官方基因名。
1.2 AD 潜在靶点的收集 利用DisGeNET(https://www. disgenet. org/home/)数据库以“Alzheimer's dis⁃ease”作为关键词进行检索,获取跟AD 相关的靶点,将上述获得的药物靶点与疾病靶点分别导入Ven⁃ny2.1.0(https://bioinfogp. cnb. csic. es/tools/venny/)平台进行映射取交集,获取药物治疗疾病的关键作用基因。
1.3 药物—活性成分—疾病—靶点网络图的构建 将上一步得到的关键作用基因,即药物活性成分作用靶点与疾病相关靶点的共有基因,以及对应的活性化合物导入Cytoscape3.7.1 软件中,构建药物—活性成分—疾病—靶点网络图。
1.4 蛋白相互作用(PPI)网络构建与分析 将上述映射得到的关键作用基因以gene symbol 形式上传至STRING 数据库(https://string-db.org/),物种选择为“人类(Homo sapiens)”,设置最低相互作用阈值“high confidence(≫0.7)”,并隐藏游离节点,得到蛋白相互作用信息。将得到的相互作用参数导入Cy⁃toscape3.7.1 软件构建 PPI 网络图,通过“Network Analyzer”插件对网络结构进行拓扑分析,选取度值(degree)高于平均数的靶点作为核心靶点。
1.5 GO 分析与KEGG 通路富集分析 将上述关键作用基因上传至DAVID 数据库(https://david.ncifcrf.gov/)进行富集分析,筛选P<0.01 的前 20 个条目,借助微生信在线平台(http://www. bioinfor⁃matics.com.cn/)进行数据可视化处理,以阐释参知健脑方中活性成分治疗AD 的生物功能以及相关信号通路。
1.6 分子对接验证 通过PDB 数据库(http://www. rcsb. org/)下载核心靶点的蛋白质结构,利用PyMOL 软件对蛋白质进行去除水分子、分离原配体等操作,并借助ChemOffice 软件绘制活性化合物的3D 结构并使其能量最小化,通过Autodock-Vina 1.1.2 软件进行分子对接,并选取其中结合能最小的对接模型,一般认为结合能小于-5 kJ/mol 时配体与受体可以较好地结合,最后采用PyMOL 软件实现对接结果可视化,建立对接相互作用模式图。
2 结果
2.1 参知健脑方中活性成分的获取结果 通过TCMSP、HERB、TCMIP 数据库以及查阅相关文献,共获取人参活性成分27 个、知母活性成分17 个、赤芍活性成分 15 个,利用 SwissTarget、PharmMapper 和SEA等平台挖掘活性成分对应的作用靶点分别为人参833 个、知母687 个、赤芍493 个。药物部分活性成分信息见表1~3。

表1 人参活性成分部分筛选结果

表2 知母活性成分部分筛选结果

表3 赤芍活性成分部分筛选结果
2.2 参知健脑方治疗AD 的作用靶点 利用Dis⁃GeNET数据库以“Alzheimer's disease”作为关键词进行检索,获取跟AD 有关的靶点共2 601 个,人参、知母、赤芍的作用靶点合并去重后与AD 相关靶点取交集,最终获得425 个关键作用靶点。利用Venny 2.1.0 在线作图工具绘制出药物—AD 共有靶点的Venn图。见图1。
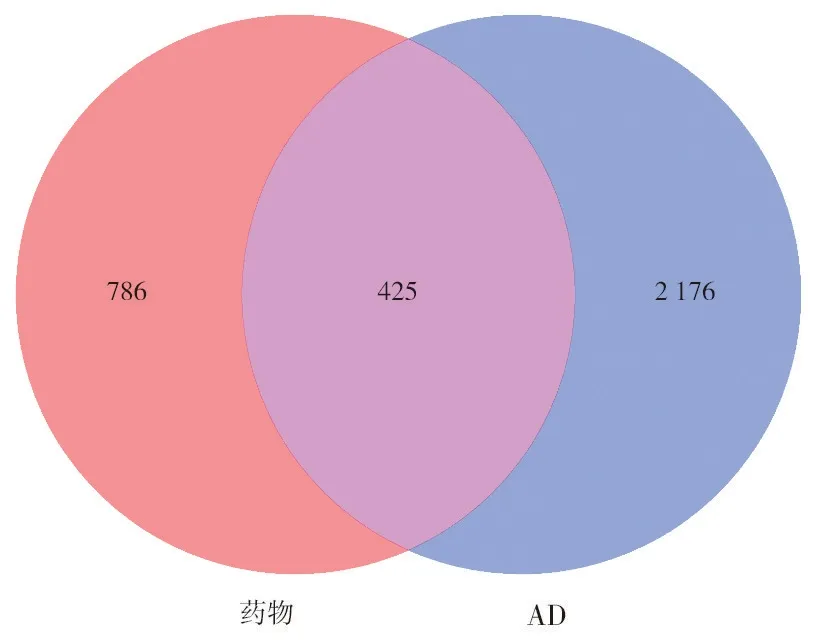
图1 药物-AD共有靶点Venn图
2.3 参知健脑方中治疗AD的关键有效成分 利用Cytoscape3.7.1 软件构建药物—活性成分—疾病—靶点网络图,得到一个488 个节点、2 826 条边的网络。见图2。节点之间的连线表示药物—活性成分—AD—靶点之间的靶向关系,连线越多越密集,表明该节点在网络中占据核心地位。通过cytoHub⁃ba 插件对网络进行分析,选取degree 值大于平均节点连接度的成分作为参知健脑方治疗AD 的关键有效成分,排名靠前的化合物分别为白藜芦醇、山奈酚和芍药苷等。详见表4。
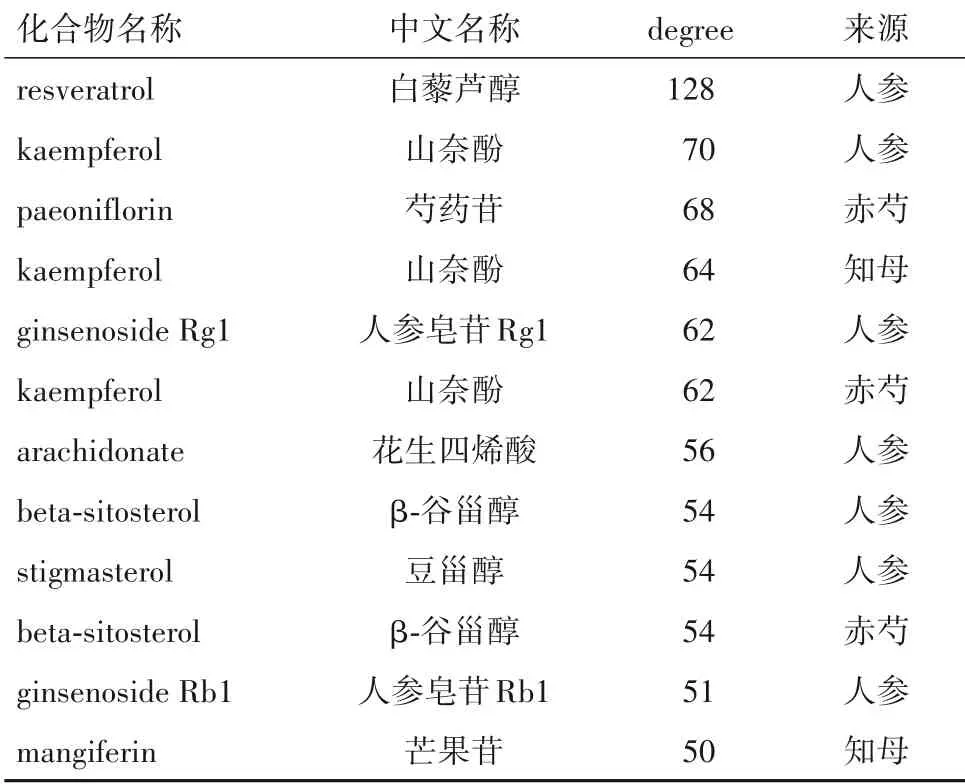
表4 参知健脑方治疗AD主要活性成分的节点度排名

图2 药物—活性成分—AD—靶点网络图
2.4 参知健脑方治疗AD 关键靶点的PPI网络分析结果 参知健脑方治疗AD 关键靶点的PPI 网络图见图3。该网络共包含100 个节点791 条边,其中节点颜色深浅与degree成正相关。颜色越红,则degree越高,表明这些蛋白占据该网络的核心地位。利用“Network Analyzer”插件对网络结构进行拓扑分析,选取degree 高于平均数的靶点作为核心靶点,筛选得到APP、MAPK1、TNF等核心靶点。见表5。

表5 参知健脑方治疗AD核心靶点的拓扑学性质

图3 参知健脑方治疗AD关键靶点的PPI网络分析图
2.5 参知健脑方治疗AD 关键作用基因的GO 与KEGG 分析结果 将上述425 个关键作用基因上传至DAVID 数据库进行生物信息学分析,共获取914个GO 条目,其中包括生物过程(BP)637 个,主要涉及对缺氧的响应、细胞凋亡过程的负向调节、细胞膜钙离子浓度的正向调节以及对氧化应激的响应等方面;细胞组成(CC)108 个,主要涉及细胞质膜、细胞膜膜筏、神经元胞体和投射神经元等;分子功能(MF)169 个,主要涉及酶结合、乙酰胆碱结合、蛋白酪氨酸激酶活性和氧化还原酶活性等。见图4A。
KEGG 信号通路富集分析共获得53 条通路,根据P<0.01,取排名前20 的通路借助微生信在线平台进行数据可视化处理。见图4B。通路结果中主要涉及AD、细胞凋亡、钙信号通路和TNF 信号通路等。
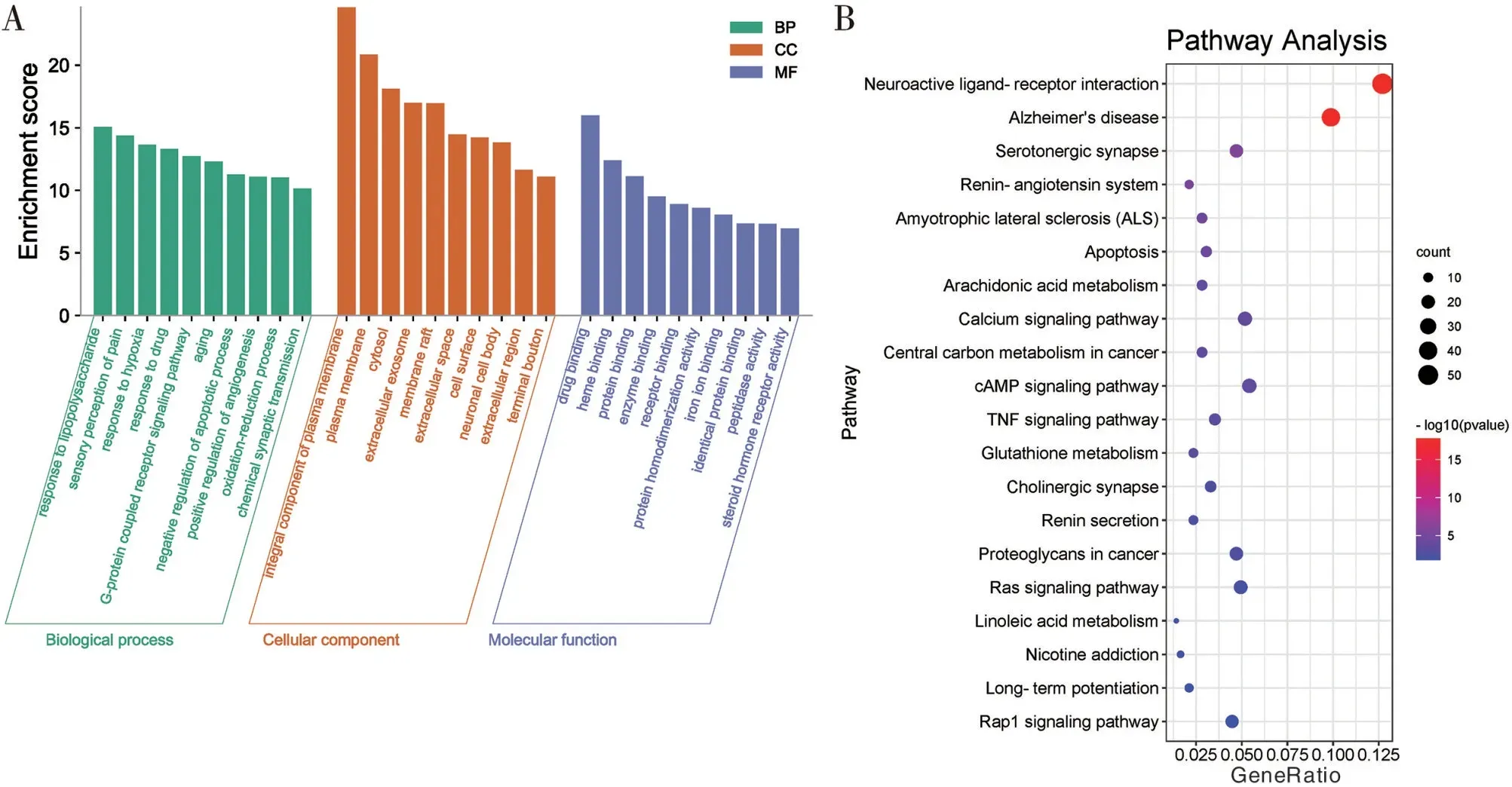
图4 关键作用基因的GO与KEGG分析
2.6 AD 相关核心靶点与主要有效成分的分子对接 选取节点连接度排名靠前的6 个核心成分,分别与排名靠前的8 个核心靶点进行分子对接,蛋白基本信息见表6。分子对接结果显示,各化合物与目标受体蛋白对接的结合能均小于-5 kJ/mol,以结合能值最低的药物—靶点组合绘制分子对接模式图,见图5A~D。
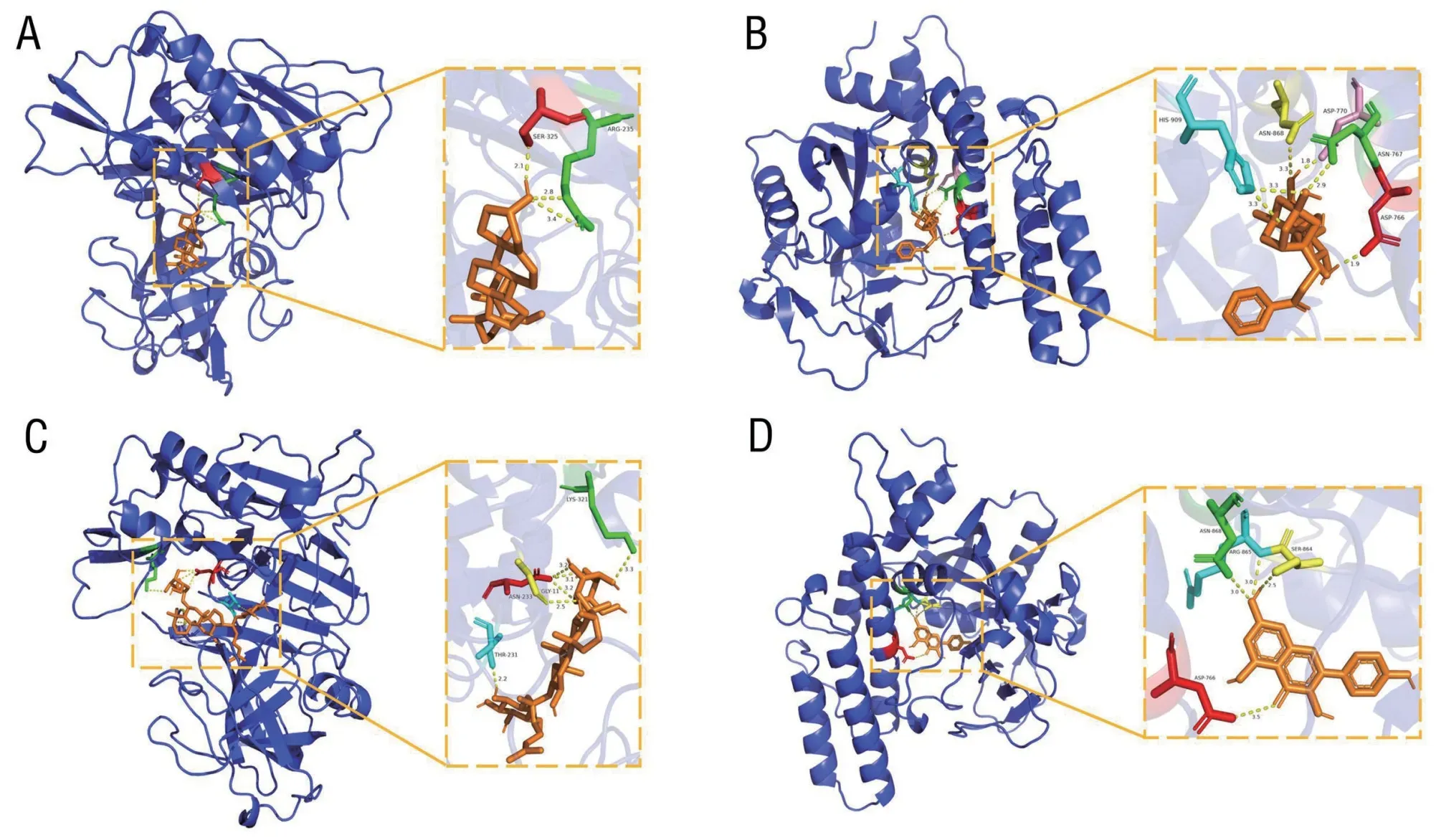
图5 核心成分与核心靶点的分子对接模式图

表6 PPI网络中度值排名靠前的疾病相关靶点蛋白信息
3 讨论
网络药理学是系统生物学的重要组成部分,其整合了靶标、药物和疾病作为网络中的节点,它们之间的联系作为边,利用网络分析来观察药物对疾病网络的干预和影响,从而推断药物活性成分对疾病的治疗作用和作用机制。
本研究预测参知健脑方中发挥治疗AD 的有效成分主要为白藜芦醇、山奈酚、芍药苷、人参皂苷Rg1 和β-谷甾醇。白藜芦醇作为SIRT1 的有效激活剂[8],通过激活 SIRT1 依赖性的 ADAM10 的转录表达,增加了α-分泌酶的生成并提高其活性,从而降低 Aβ 的产生[9]。白藜芦醇还可通过调节 AMPKSIRT1介导的自噬信号通路或miRNA介导的信号通路来控制Tau的过度磷酸化、神经炎症、BACE1活性和 Aβ 在 AD 中的积聚,从而对抗 AD[10]。氧化应激是细胞死亡的一个关键机制,脑内ROS 的过量产生被认为是多种神经退行性疾病发病的根本原因,YANG 等[11]采用不同浓度的白藜芦醇处理含有Aβ1-42的PC12 细胞,核因子红系 2 相关因子(Nrf)与抗氧化反应元件(ARE)的结合可调节一组抗氧化/解毒基因的表达,这些基因协同作用以通过连续的酶促反应清除ROS。有研究[12]以Aβ25-35损伤的嗜铬细胞瘤(PC-12)细胞作为AD 的体外模型以探究山奈酚对细胞凋亡的保护机制,研究结果表明山奈酚可通过ER/ERK/MAPK 信号通路以剂量依赖性的方式保护PC-12 细胞免受Aβ25-35诱导的细胞凋亡。KOUHESTANI 等[13]研 究 了 山 奈 酚 对 卵 巢 切 除(OVX)大鼠AD 模型的认知障碍、细胞凋亡、脂质过氧化和神经炎症标志物的影响,结果表明山奈酚能够减轻链脲佐菌素(STZ)诱导的OVX 大鼠的记忆障碍,脑组织中超氧化物歧化酶和谷胱甘肽等抗氧化酶的水平明显升高,而TNF-α 和丙二醛水平显著降低,山奈酚在此实验中表现出了神经保护作用。芍药苷通过抑制由糖原合成酶激酶-3β(GSK-3β)和NF-κB 信号通路以及核苷酸结合域样受体蛋白3 炎症小体介导的神经炎症,对APP 和PS1 双转基因小鼠表现出神经保护作用[14],此外,芍药苷可通过降低细胞内Ca2+的含量,抑制钙蛋白酶活化,从而干扰钙蛋白酶/蛋白激酶 B(Akt)/GSK-3 信号通路,最终减少了冈田酸诱导的人神经母细胞瘤细胞(SH-SY5Y)中过度磷酸化的Tau 蛋白[15]。人参皂苷Rg1 是人参总皂苷中活性最显著的相关成分,其对突触功能可塑性及神经发生、Aβ水平、线粒体功能、胆碱能神经系统、氧化应激与神经炎症过程等方面的影响可用于治疗AD[16]。Ach 是副交感神经系统中的主要神经递质,AD患者脑内该神经递质水平较正常人具有明显的异常,CHOI等[17]的研究结果表明Rg1对诱导AD的AChE、BChE、BACE1均具有明显的抑制作用,且具有用于开发AD 预防或治疗药物的潜力。β-谷甾醇作为植物甾醇,是甾醇类成分中的主要成分之一,具有多种生物活性和药理作用[18]。SHI 等[19]的研究发现,以胆固醇螯合剂2-羟丙基-β-环糊精(HPβCD)为载体,β-谷甾醇进入线粒体后可提高线粒体内膜的流动性,增加线粒体跨膜电位和ATP 含量,线粒体中ATP 水平的治疗性提升则有益于改善AD等神经退行性疾病。
由PPI 网络拓扑分析筛选得到20 个核心靶点,其中APP、MAPK 和TNF 等排名靠前的核心靶点可能在AD 的治疗过程中发挥较为重要的作用。APP作为淀粉样前体蛋白是一种Ⅰ型单通道跨膜蛋白,在人体中广泛存在,其通过淀粉样代谢途径得到的Aβ1-42具有较强的毒性和疏水性,并且更易聚集,其聚集体在脑内被小胶质细胞吞噬并释放出炎症因子引起神经损伤,产生慢性退行性神经病变,最终可导致AD 的发生。上调α-分泌酶活性并抑制β-分泌酶(如BACE1)和γ-分泌酶活性是减少Aβ 形成的重要因素,因此通过影响APP 代谢过程中的Aβ 分泌酶可能作为AD 的潜在治疗靶点。APP 在内质网和高尔基体网络中可进行泛素化、磷酸化、糖基化和棕榈酰化等一系列的翻译后修饰[20],在 Aβ 的沉积过程中具有重要的调节作用,针对APP 翻译后修饰相关调控过程的研究将有助于AD 药物靶点的选择。TNF-α是脑淀粉样斑块附近小胶质细胞和星形胶质细胞释放的最主要的炎症细胞因子之一,小胶质细胞聚集在AD 患者和动物模型的淀粉样斑块周围,表达细胞表面受体,如CD36、A1 型清道夫受体、RAGE(晚期糖基化终产物受体)和Toll 样受体(TLRs),这些受体能够与Aβ 相结合,结合后的Aβ激活小胶质细胞以增加MHCⅡ类分子的表达以及细胞因子(如TNF-α、IL-1β、IL-6)和趋化因子(如CCL2、MIP-1α)的产生,从而触发外周单核细胞通过血脑屏障的迁移[21]。活化的神经胶质细胞引起的大脑急性炎症反应是有益的,可以修复大脑的受损区域并有助于恢复大脑稳态,但如果炎症反应呈现慢性持续状态且不受控制,小胶质细胞被长期激活,不断地释放促炎介质,增加氧化应激和亚硝化应激,将加重AD 等神经退行性疾病。MAPK1 和MAPK3 是MAPK 的家族成员,在许多有关细胞增殖的信号通路中具有重要作用,可参与细胞增殖、分化、转移、癌变 和 凋 亡 ,MAPK1/ERK2 和 MAPK3/ERK1 是 在MAPK/ERK 级联中发挥重要作用的两个MAPKs。MAPK 信号通路主要由ERK 信号通路、p38 信号通路和JNK 信号通路组成,p38MAPK 是该家族中Aβ诱导毒性的最重要的调节器,p38 诱导NF-κB 的激活、谷氨酸兴奋性毒性和突触可塑性的破坏,这些都是证明p38MAPK是打破Aβ毒性恶性循环的潜在靶点[22]。LIU 等[23]对注射 Aβ 的大鼠采用腹腔注射硫氢化钠进行治疗,NaHS 抑制IκB-α 的降解和 NF-κB的激活,以及抑制Aβ 诱导的细胞外信号调节激酶(ERK1/2)活性和p38MAPK 活性,显著减轻了Aβ1-42所引起的认知功能障碍和神经炎症。有研究表明[24],阻断 ERK1/2 和 p38 通路还可减少小胶质细胞产生的炎性细胞因子,从而减轻脑内小胶质细胞的炎症反应。CAT(过氧化氢酶)是一种存在于人体正常组织中的抗氧化酶,可抑制脂质过氧化物在细胞中的聚集,从而减轻氧化应激对神经元和细胞的损伤。据报道[25],Aβ 刺激细胞氧化损伤的机制可能是:Aβ与过氧化氢酶的直接结合导致其催化活性降低,从而产生氧化应激条件,此外,全长的β 淀粉样肽在其N 位末端可与Cu2+结合并将其还原为Cu+,而β 淀粉样-Cu+的复合物可导致过氧化氢的产生,因此,过氧化氢酶与AD 的发病机制有直接或间接的关系。
关键作用靶点通过DAVID 数据库进行KEGG通路富集分析,结果显示,排名靠前的KEGG 通路富集结果即为AD 相关信号通路,体现出参知健脑方对治疗AD 具有较强的靶向性。此外,其他富集通路还涉及细胞凋亡、肾素—血管紧张素系统(RAS)、羟色胺能神经突触通路、钙信号通路、cAMP 信号通路和 TNF 信号通路。有研究[26]表明,AD 患者脑内RAS 活性增强,RAS 被激活后,脑内 ACE 和 AngⅡ表达增加可直接损害AD 患者的认知功能。细胞内钙水平的增加会触发囊泡递质的释放,耗尽细胞内的递质储存,这一过程可能会导致神经元功能衰竭,此外Aβ 可破坏细胞的钙平衡,大量Ca2+内流可激活Ca2+依赖性酶,进而引发线粒体功能紊乱和细胞凋亡[27]。据报道[28],5-HT 活性增强能够改善正常老龄人群和AD 患者的记忆力,而由5-HT 消耗所引起的脑内5-HT 水平的下降则使他们的记忆力受到了损害。cAMP 作为细胞内的第二信使,是由GPCRs 与神经递质、激素等信号分子的配体结合后刺激激活腺苷酸环化酶(AC)催化ATP 环化而形成的,其在代谢、分泌、钙稳态和基因转录等生理过程中起到关键的调节作用。在神经元中,cAMP 可通过增加海马突触和小脑浦肯野纤维神经元突触的神经递质释放来诱导长时程增强(LTP)[29],LTP则是神经元突触可塑性的直接表现形式,LTP 增强会促进学习记忆能力,而LTP 减弱会导致学习记忆能力的下降。TNF按其结构可分为 TNF-α 和 TNF-β,其中 TNF-α 可抑制肿瘤细胞的增殖并导致细胞坏死,还能促进IL-1、IL-2 和IL-6 的产生和分泌,诱导炎症反应。TNF-α可增强星形胶质细胞的反应,推动神经炎症过程,有研究[30]发现,TNF-α的表达水平与AD患者的症状呈正性相关,抑制TNF-α 的表达可改善AD 患者的认知能力。
综上所述,参知健脑方中的有效成分可能作用于APP、MAPK、TNF 等靶点,通过调节细胞凋亡、钙信号通路和TNF 信号通路等途径来减少Aβ 的生成和减轻氧化应激引起的神经损伤,从而抑制炎症反应和细胞凋亡,最终起到神经保护和改善认知能力的作用。此外,基于分子对接预测得到的结果显示,这些成分与靶点之间有较好的结合能力,可能为治疗AD 过程中发挥重要作用的关键药效成分。鉴于网络药理学数据库对药物作用机制的预测仍存在一定的局限性,所以后期仍需要对主要活性成分以及关键靶点进行进一步的验证。
利益冲突所有作者声明不存在利益冲突
作者贡献声明刘川铭:研究设计,文章撰写;李谢:参与研究设计,绘制文章中的图片;卢熙奎:参与研究设计,并完善文章部分内容;曾点点:指导论文撰写,绘制文章中的图片;李畏娴:论文指导

