右下肢巨大未分化多形性肉瘤伴发热1例
段娜娜,康艳丽,王绍欣,王宏运,赵富利
(1.河南科技大学第一附属医院 全科医学科,河南 洛阳 471000;2. 河南科技大学临床医学院 内科学教研室,河南 洛阳 471000)
未分化多形性肉瘤(undifferentiated polymorphic sarcoma,UPS)是一种高度恶性的软组织肉瘤,生长速度较快,可发生于身体任何位置,多发生于四肢,表现为无痛性进行性增大的包块,若压迫周围组织或神经可出现局部压迫症状,预后差。本病例发病部位为右下肢,表现为无痛性进行性增大的包块,因发热于我院就诊,查体肿块大小约为20 cm×18 cm×10 cm,质韧,活动度差,行外科手术切除,术后未再发热,病理检查结果提示未分化多形性肉瘤。
1 临床资料
1.1 病史资料患者,女,56岁,以“发现右大腿肿块2个月,伴发热1周”为主诉于2020年10月23日就诊于河南科技大学第一附属医院。2个月余前搓澡时发现右大腿外侧有一肿物,大小约4 cm×4 cm,质韧,边缘不清,行走时感轻微痛感,无皮温升高、红肿、瘙痒破溃等其他伴随症状,未就诊。1周前无明显诱因出现发热,体温最高达38.7 ℃,多于午后出现,伴乏力、纳差,无畏寒、寒战、头晕、头痛、咳嗽、咳痰、胸闷、呼吸困难、尿急、尿痛、关节疼痛、皮疹等其他伴随症状,病程中可自行退热,就诊于渑池县人民医院,查右下肢彩超示:右下肢凸起处皮下混合回声包块。右下肢MRI提示:右侧大腿中段巨大占位性病变,多考虑神经源性,神经纤维肉瘤?临近病灶部分股骨干骨质变薄。给予左氧氟沙星静脉输注,效果欠佳,为进一步诊治遂就诊于河南科技大学第一附属医院。入院诊断为“1.发热待查;2.右下肢包块待查”。查体:右大腿中段可见皮肤紧张凸起,可触及一大小约20 cm×18 cm×10 cm包块,质韧,无触压痛,活动度差,肿物表面皮肤紧绷,静脉血管局部可见显现。余未见明显阳性体征。
1.2 治疗经过入院后完善检查,血常规提示:白细胞24.5×109L-1,中性粒细胞百分比88%,淋巴细胞百分比6.0%,红细胞数目3.13×1012L-1,血红蛋白78 g·L-1,平均红细胞体积77.3 fL,平均红细胞血红蛋白24.9 pg,血小板数目572.0×109L-1。血培养:需氧及厌氧培养均为阴性。生化:谷丙转氨酶66 U·L-1,谷草转氨酶61 U·L-1,碱性磷酸酶785 U·L-1(建议进一步行PET-CT检查,患者及家属商议后拒绝),谷氨酰转移酶313 U·L-1,白蛋白28 g·L-1,超敏C反应蛋白300.33 mg·L-1。余肾功能、电解质未见明显异常。红细胞沉降率121.0 mm·h-1。血细胞凝集:D-二聚体0.69 mg·L-1,部分凝血酶原时间50.4 s。肿瘤标志物:铁蛋白1 388.7 μg·L-1,神经元特异性烯醇化酶27.74 μg·L-1,甲胎蛋白、癌胚抗原、糖类抗原199、糖类抗原125、糖类抗原724、非小细胞肺癌相关抗原21-1、肿瘤异常蛋白均未见明显异常。尿常规、粪便常规、感染性疾病筛查、糖化、抗核抗体谱、血管炎等结果均未见明显异常。淋巴结彩超示:双侧颈部可见数个淋巴结回声(左侧其一大小约17.1 mm×7.5 mm,右侧其一大小约16.1 mm×7.8 mm),双侧锁骨上窝未见明显肿大淋巴结。胸部及上腹部CT平扫未见明显异常。股骨CT平扫示:右侧大腿中段前部股中间肌见梭形低密度影,大小约17.9 cm×12.9 cm×7.5 cm,边缘光滑,周围组织结构受压移位,右侧股骨未见明显骨质破坏。结合病史、症状体征及辅助检查,右大腿肿物考虑恶性可能性大,发热考虑与原发病有关,排除手术禁忌证,经患者及家属同意后在全麻下行“右大腿肿瘤切除术”,术后体温逐渐恢复正常。
1.3 术中所见肿物已侵及至深筋膜,仔细清除筋膜层肿物,探查可见肿瘤蒂部及邻近股骨面无明显包膜,右股四头肌被肿瘤广泛侵犯,股二头肌部分亦被侵犯,股动静脉及坐骨神经周围被肿瘤组织包裹,仔细切除肌肉上所附着的肿瘤组织,仔细剔除近血管神经部分肿瘤组织,尽可能将肿瘤切除干净。
1.4 大体检查薄膜完整,大小约16 cm×11 cm×6 cm,切面灰红灰黄,伴出血坏死。
1.5 镜下所见手术切除组织经取材、脱水、包埋、切片、脱蜡,行苏木精-伊红染色(HE染色)后封固,标本切片制作完备后,分别于不同倍数电子显微镜下观察并摄片。瘤细胞及细胞核呈多样性,核大异性明显,易见核分裂象和病理性核分裂象,可见多核瘤细胞伴慢性炎症细胞浸润。右下肢巨大多形性肉瘤患者术后病理镜下观察结果见图1。
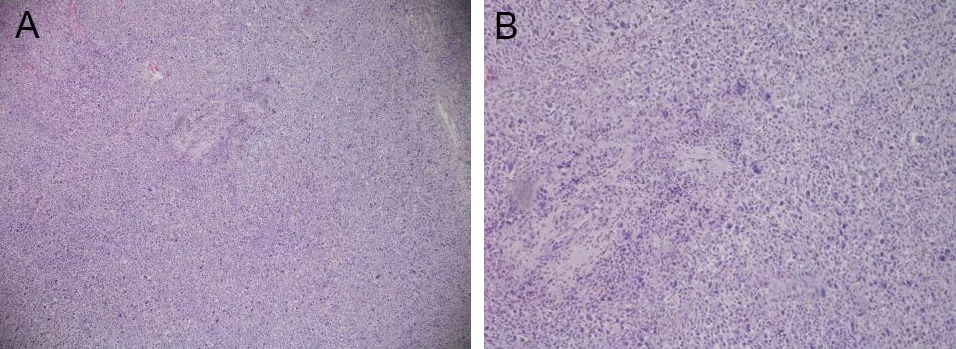
A为HE染色40×;B为HE染色100×。

A为角蛋白(-);B为波形蛋白(+);C为肌形成蛋白(-);D为肌调节蛋白(-);E为结蛋白(-);F为平滑肌肌动蛋白少量(+);G为可溶性酸性蛋白(+);H为钙调理蛋白少量弱(+);I为钙调结合蛋白(-);J为黑色素标志物(-);K为CD68部分(+);L为CD34脉管(+)。
1.6 病理诊断切除肿物送病理检查,结果回报:(右大腿)结合免疫组化结果符合多形性未分化肉瘤。
1.7 治疗后转归术后第2天体温逐渐正常,后未再发热,发热原因考虑为肉瘤组织坏死吸收所致。术后2周行化学治疗,采取方案为:吡柔比星联合异环磷酰胺。目前已化疗7个周期,化疗期间均复查右大腿MRI、胸腹部CT,未发现复发及胸腹部转移情况,现患者病情稳定,仍在随访中。
2 讨论
UPS发病率偏低,占成年人软组织肉瘤的19.22%[1],好发年龄为50~70岁,发病率男性高于女性,恶性程度高,易转移和复发,预后一般较差。UPS最常发生部位为下肢,尤其是大腿,其次是躯干、头颈部和腹膜后,病变主要位于深部肌肉和筋膜,少数位于皮下组织[2]。临床表现无特异性,易误诊漏诊。目前UPS病理诊断标准为:无特异分化方向的高级别肿瘤[2]。镜下可见瘤细胞及细胞核呈多样性,核大异性明显,易见核分裂象和病理性核分裂象,可见多核瘤细胞伴慢性炎症细胞浸润(图1);瘤细胞多呈长梭形、梭形,排列呈旋涡状、条束状、编席状等(图2)。UPS目前缺乏特异性免疫组化标记[3],波形蛋白是间叶组织的标记,CD68是恶性纤维组织细胞瘤诊断的首选指标,波形蛋白和CD68阳性表达被兼容于UPS,并有助于UPS诊断[3]。
UPS的诊断需要结合病史、临床表现、体征、实验室结果、影像学及病理免疫学检查。早期临床表现往往无特异性,一般在疾病进展后才表现出来[4],表现为无痛性进行性增大的软组织包块,常有局部压迫症状,时间可长短不等,也可伴有疼痛等,其影像学表现多不典型,主要依靠多种免疫组化分析来排除不同的分化方向,是一种排他性诊断[5],UPS诊断的金标准仍是病理组织学检查,组织学分型与预后相关。UPS目前最主要的治疗方法是扩大性手术切除,同时辅以放化疗[6-10]。其中术中肿瘤切除的完整性及切缘是否干净直接影响患者的预后。随着分子生物学的进步以及靶向药物的临床应用,已有相关研究表明靶向药物治疗可延长患者的生存期并提高其生活质量,为晚期不能耐受手术及放化疗的患者提供更多治疗方案选择。
发热是机体在致热源的作用下或各种原因引起的体温调节中枢的功能障碍,使体温升高超出了正常范围。该病例因“发热待查”入院,入院时无明显感染症状,完善相关辅助检查,B超及CT检查均未发现感染及其他占位病灶,排除了感染相关性发热及结缔组织病;术前白细胞数目、中性粒细胞百分比及超敏C反应蛋白均升高,红细胞沉降率较快,术后体温逐渐恢复正常,考虑发热与原发病有关,为肿瘤热。另外,患者慢性病程2个月余,入院时存在小细胞低色素性贫血、低血清白蛋白水平、肝功能异常等,均考虑为肿瘤消耗所致,且消耗较快。另外,血小板升高、部分凝血酶原时间延长与肿瘤呈高凝状态相符。
本病例年龄、病史、发病部位均符合UPS的诊断特点,术后病理及免疫组织学检查确诊为多形性未分化肉瘤。该病例肿瘤瘤体极大,呈16 cm×11 cm×6 cm,且伴发热,术中可见肿瘤侵犯股四头肌及股二头肌,包绕股动静脉及坐骨神经,行肿瘤切除术,术后第2天体温恢复正常。术后两周采用“吡柔比星联合异环磷酰胺”方案化疗,过程顺利,无特殊不适。因该病预后差、复发率高且进展快,结合患者病史、肿瘤负荷及术中情况,建议患者定期肿瘤科随诊治疗。
因发热而就诊发现UPS的报道病例较少,通过该病例的介绍,临床医生在进行发热待查患者诊治时,应加强系统问诊及查体,避免漏诊及误诊。

