抗PD-1/PD-L1相关糖尿病临床特征
王天天,马晓君,缪康琪,张云飞,胡艳美
(郑州大学第一附属医院 内分泌科,河南 郑州 450052)
免疫检查点抑制剂(immune checkpoint inhibitors,ICPis)目前已经成为肿瘤科医生最常用的肿瘤治疗药物之一。ICPis主要包括程序性死亡蛋白1(programmed cell death protein 1,PD-1)及程序性死亡蛋白配体1(programmed cell death-ligand 1,PD-L1)的抗体、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抗体等[1]。ICPis可引起免疫相关不良反应(immune-related adverse events,irAEs)[2],其中1型糖尿病(type 1 diabetes mellitus,T1DM)是一种较为罕见的内分泌相关irAEs,称之为ICPis诱导的1型糖尿病(immune checkpoint inhibitor-induced type 1 diabetes,ICIT1D),常伴有危及生命的酮症酸中毒(diabetic ketoacidosis,DKA)。在所有ICPis治疗过程中,与ICIT1D发生主要相关的是抗PD-1/PD-L1治疗[3]。一项回顾性分析显示ICIT1D发病率为0.9%~1.0%[4]。世界卫生组织(World Health Organization,WHO)安全报告数据库显示ICIT1D病例有增加趋势[5]。目前国内关于ICIT1D的报告病例十分有限,ICIT1D 病例数非常少,一旦发生则威胁生命。了解ICIT1D的临床特征,进行早期识别和治疗,对改善患者预后具有重要意义。因此,本研究通过探讨抗PD-1/PD-L1相关糖尿病临床特征,帮助临床医生早期识别和治疗ICIT1D。
1 对象和方法
1.1 研究对象选取郑州大学第一附属医院2019年1月至2022年1月收治的应用PD-1/PD-L1抑制剂后出现T1DM的14例实体肿瘤患者,按照患者年龄、性别进行1∶3配比,选取接受抗PD-1/PD-L1药物治疗后未发生ICIT1D的42例实体肿瘤患者,同时选取医院内分泌科同期初诊的106例T1DM患者。ICIT1D入组标准:(1)病理结果提示为实体瘤,且经过肿瘤内科医生评估后,患者同意应用PD-1/PD-L1抑制剂治疗;(2)入组前无其他ICPis预处理史,如CTLA-4抗体;(3)接受PD-1/PD-L1抑制剂治疗前空腹血糖(fasting blood glucose,FPG)、餐后2 h血糖(2 hours postprandial blood glucose,2 h PG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)均在正常范围,在接受PD-1/PD-L1抑制剂治疗后由专业内分泌科医生诊断为T1DM;(4)签署知情同意书。未出现ICIT1D患者入组标准:(1)应用抗PD-1/PD-L1药物治疗且病理诊断为实体瘤;(2)入组前无其他ICPis预处理史,如CTLA-4抗体;(3)接受抗PD-1/PD-L1治疗前后FPG、HbA1c均在正常范围;(4)签署知情同意书。排除标准:(1)入组前已由专业内分泌科医生诊断为糖尿病或血糖调节受损;(2)因病情变化或个人经济等因素需暂停应用PD-1/PD-L1抑制剂治疗;(3)非实体肿瘤。 T1DM患者入组标准:(1)在2019年1月至2022年1月新发病且由医院内分泌科初次诊断为T1DM;(2)T1DM诊断标准采用中国T1DM诊治指南(2012年版)[6]。T1DM患者排除标准:既往有糖尿病病史。
1.2 研究方法(1)记录ICIT1D患者从开始接受PD-1/PD-L1抑制剂治疗至诊断为T1DM的时间。(2)收集ICIT1D患者和T1DM患者资料,包括年龄、性别、FPG、HbA1c、空腹C肽(fasting C-peptide,FC-P)、谷氨酸脱羧酶抗体(glutamate decarboxylase antibodies,GADA)、胰岛素抗体(insulin antibodies,IAA)、胰岛细胞抗体(islet-cell antibodies,ICA)、蛋白酪氨酸磷酸酶自身抗体(protein tyrosine phosphatase antibodies,IA-2A)、锌转运体-8自身抗体(zinc transporter 8 antibodies,ZnT8A)、尿酮体、外分泌胰酶,定期随访患者胰岛功能、降糖方案及发生ICIT1D后是否继续用药情况。(3)收集ICIT1D及非ICIT1D患者资料,包括年龄、性别、肿瘤类型、药物类型、甲状腺自身免疫抗体[甲状腺过氧化物酶抗体(thyroid teroxidase antibodies,TPOAb)、甲状腺球蛋白抗体(thyroglobulin antibodies,TgAb)]、糖尿病家族史、其他内分泌irAEs情况。

2 结果
2.1 ICIT1D患者基线和临床资料14例ICIT1D患者中,2例为肺鳞癌,2例为小细胞肺癌,2例为神经内分泌癌,2例为胃腺癌,2例为胆管细胞癌,1例为肾细胞癌,1例为骨肉瘤,1例为前列腺癌,1例患者为卵巢癌。13例患者应用抗PD-1药物进行免疫治疗,1例患者应用抗PD-L1药物进行免疫治疗。14例ICIT1D患者起病时表现为多种症状,其中4例患者表现为无症状的高血糖,4例患者表现为口渴、多饮、多尿,6例患者以DKA起病。本研究入组14例ICIT1D患者从第1次接受PD-1/PD-L1抑制剂治疗到诊断为ICIT1D的时间间隔为(242.64±124.47)d。
2.2 ICIT1D患者和T1DM患者临床特征与T1DM患者相比,ICIT1D发病年龄较晚,差异有统计学意义(P<0.05)。在可获取胰岛自身抗体检测结果的12例ICIT1D患者中,仅2例患者抗体阳性,其中GADA和ICA阳性者1例,IAA阳性者1例。与T1DM患者相比,ICIT1D患者HbA1c、FC-P水平及胰岛自身抗体阳性率更低,差异有统计学意义(P<0.05),而FPG和DKA发生率更高,但差异无统计学意义(P>0.05)。见表1。
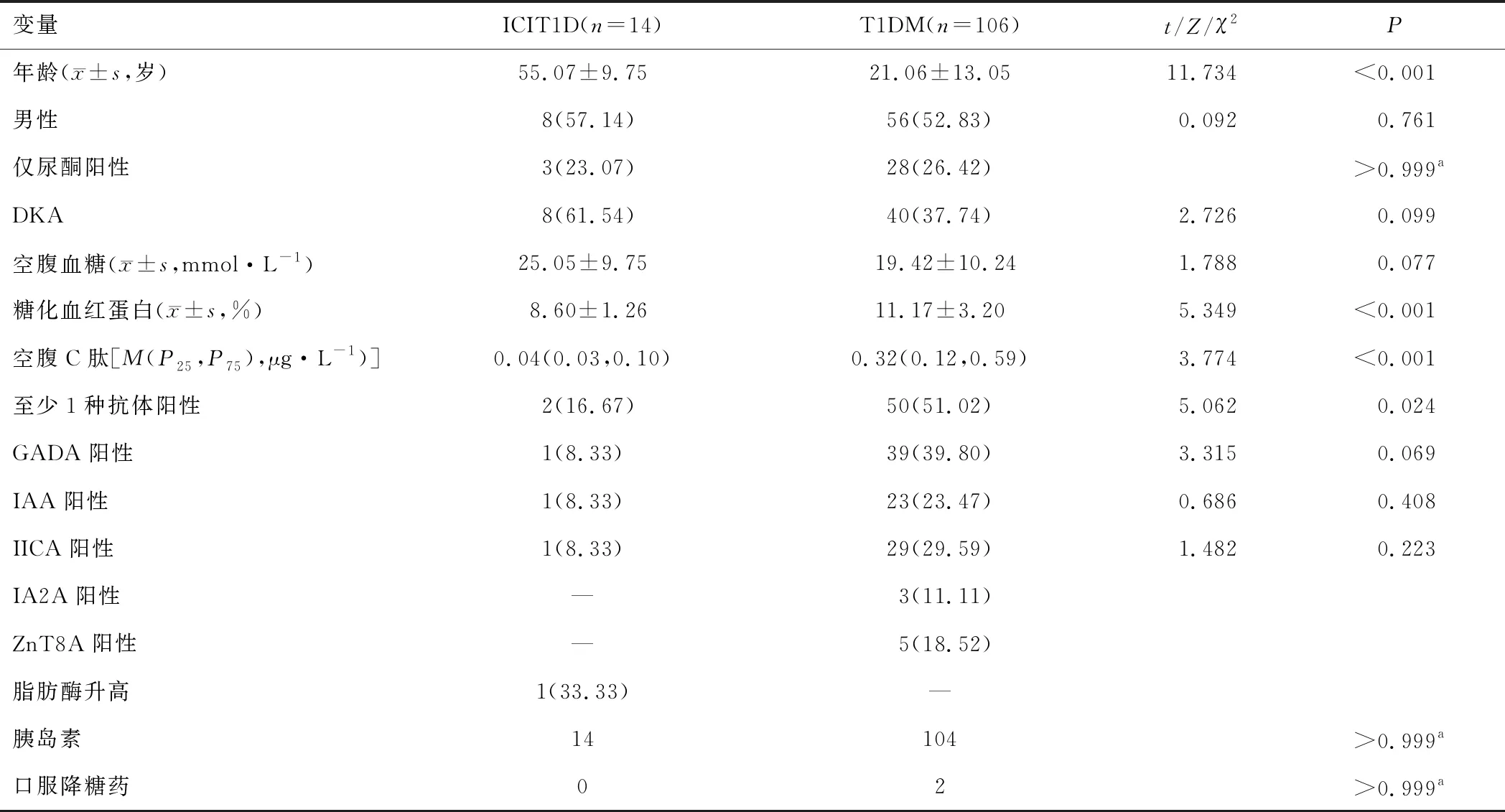
表1 ICIT1D与T1DM患者临床特征比较
2.3 ICIT1D患者与非ICIT1D患者临床特征ICIT1D患者与接受抗PD-1/PD-L1免疫治疗后未发生ICIT1D的患者的肿瘤类型及其他内分泌irAEs发生率比较,差异有统计学意义(P<0.05),年龄、性别、用药类型、体质量指数(body mass index,BMI)、甲状腺自身免疫抗体、糖尿病家族史差异无统计学意义(P>0.05)。14例ICIT1D患者中有10例患者存在其他内分泌irAEs,其中7例患者出现甲状腺功能障碍,2例患者出现垂体炎,1例患者出现原发性肾上腺功能不全。在42例未发生ICIT1D患者中有11例患者出现甲状腺功能障碍。见表2。
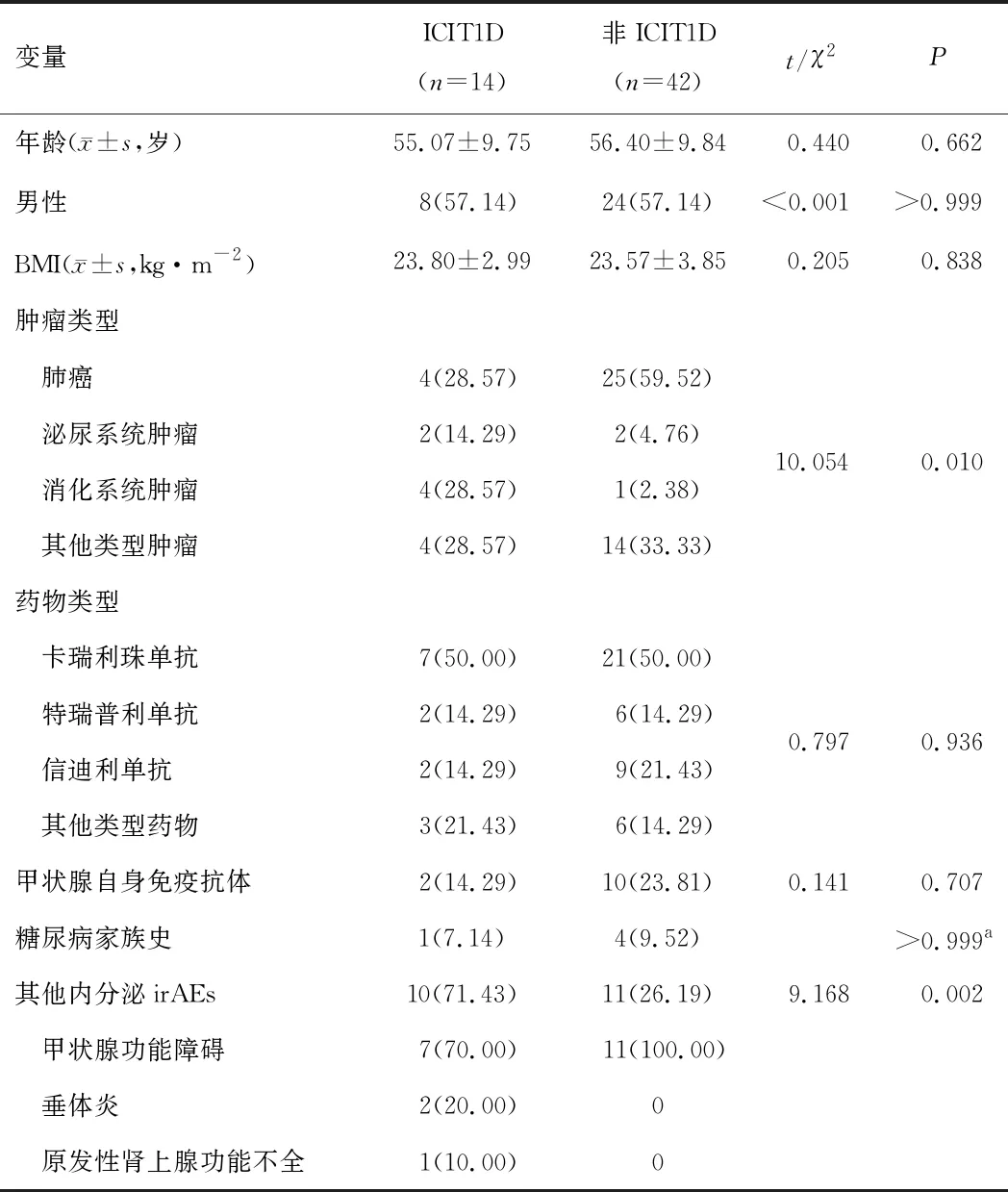
表2 ICIT1D与非ICIT1D患者临床特征比较
2.4 ICIT1D患者随访结果本研究中有3例患者在诊断为ICIT1D后定期至医院检测FC-P水平,其中2例患者在确诊后停止用药,1例患者在确诊后仍继续接受抗PD-1药物治疗。在2例停药患者中,1例从发病到目前为止18个月时间FC-P一直低于0.01 μg·L-1,1例在发病后209 d FC-P水平从0.06 μg·L-1降至0.03 μg·L-1。继续应用抗PD-1药物治疗的患者在发病53 d后FC-P水平从0.08 μg·L-1降至低于检测水平。14例入组ICIT1D患者均需要应用外源胰岛素,且截至2022年3月无患者脱离胰岛素。在可获取发生ICIT1D后是否继续用药的12例患者中,4例患者在诊断为ICIT1D后仍继续接受抗PD-1药物治疗,7例患者停止治疗,1例患者在停用特瑞普利单抗治疗241 d后重新开始接受治疗。
3 讨论
目前尚不清楚ICIT1D的发病机制。一些小鼠模型研究已经证实了PD-1在T1DM发展中的作用,PD-1和PD-L1阻断可迅速诱发糖尿病前期非肥胖糖尿病小鼠发生T1DM[7]。PD-1/PD-L1抑制剂可能发挥着相同的作用,通过阻断PD-1通路促进胰岛反应性T细胞激活,破坏胰岛β细胞,从而导致ICIT1D的发生。最近的研究表明, T1DM患者中PD-1的低表达可能会增加T细胞的增殖和激活,导致β细胞的破坏,从而发生T1DM[8]。目前关于ICIT1D的研究多为欧美以及日本人群,国内相关报道非常少,尽管ICIT1D病例非常少,但其DKA发生率较高,可威胁生命,因此研究我国人群PD-1/PD-L1抑制剂相关糖尿病的临床特征,早期识别和治疗ICIT1D,对于改善患者预后具有重大意义。
本研究以2019年1月至2022年1月收治的14例应用PD-1/PD-L1抑制剂治疗后出现T1DM的实体肿瘤患者为研究对象,分别将其与同期内分泌科初诊T1DM患者及接受抗PD-1/PD-L1药物治疗后未发生ICIT1D的患者的临床资料进行比较。结合ICIT1D患者起病时的临床表现,若患者有ICPis用药史并出现烦渴、多饮、多尿等临床症状,需考虑该患者发生ICIT1D的可能。本研究中ICIT1D患者发病年龄为(55.07±9.75)岁,与美国[9]报道的发病年龄(61.7岁)相当。与T1DM患者相比,ICIT1D患者发病年龄较晚,与肿瘤患病年龄相关,需与2型糖尿病相鉴别。在可获取是否发生DKA的13例ICIT1D患者中有8例(61.54%)出现DKA,较初诊T1DM(37.74%)患者DKA更为常见,但二者差异无统计学意义,可能是本研究纳入样本量较小所致。比利时的一项研究显示35例ICIT1D中有30例(85.7%)患者以DKA起病[10],美国的一项研究中76%患者出现DKA[9],上述研究结果均表明ICIT1D患者DKA发生率更高。本研究中与T1DM患者相比,ICIT1D患者起病时HbA1c及FC-P水平更低,ICIT1D患者起病之初HbA1c水平仅轻度升高,而FC-P水平短期内迅速下降,提示ICIT1D患者高血糖持续时间短,糖尿病进展速度快,β细胞破坏迅速,可用于协助分型诊断。本研究中2例停药患者及1例继续接受抗PD-1治疗的患者FC-P水平均呈下降趋势或一直低于检测水平。14例ICIT1D患者均需应用外源胰岛素,且截至2022年3月,这14例患者仍需进行外源胰岛素治疗,提示PD-1/PD-L1抑制剂对胰岛β细胞的破坏可能是不可逆转的,ICIT1D患者胰岛素的缺乏可能是永久性的,这与Akturk等[9]的研究结论基本一致。Trinh等[11]报告了1例应用英夫利昔单抗成功治疗的免疫检查点抑制剂相关糖尿病患者,但该患者是在关节内注射类固醇后出现糖尿病,因此该病例是否证明了ICIT1D病情的逆转尚不清楚[12]。在有外分泌胰酶检测结果的3例ICIT1D患者中,仅1例脂肪酶轻度升高。日本一项全国性调查结果显示19例ICIT1D患者中有10例在发病时至少存在1种外分泌胰酶水平升高[13]。这表明在大多数ICIT1D患者中可能存在胰腺外分泌毒性[14]。胰腺影像学已经在许多ICIT1D患者中被描述过[15-18],胰腺的CT、MRI或超声可显示胰腺进行性萎缩、肿大,也可以显示为正常或变化不显著。因此,对于需要进行PD-1/PD-L1抑制剂治疗的患者常规检测其外分泌胰酶水平并进行胰腺影像学评估有可能帮助临床医生尽早识别ICIT1D的发生。
T1DM是一种自身免疫性疾病,通过遗传和免疫因素之间复杂的相互作用引起。在遗传学方面,T1DM进展风险是由特异性人类白细胞抗原(human leukocyte antigen,HLA) DR/DQ等位基因决定的,在许多ICIT1D病例中患者的HLA分型具有遗传易感性。在一项64例患者的队列研究中,62%的患者表达高危Ⅱ类HLA等位基因HLA-DR4[19]。因此,可以认为具有T1DM易感HLA基因型的患者发生ICIT1D的风险增加。也有一些研究发现ICIT1D发生在具有保护性HLA基因型的患者中[20]。但迄今为止进行HLA分型的患者人数有限,本研究也缺乏ICIT1D患者的 HLA分型资料,因此未来需要进一步研究来评估HLA分型在预测ICIT1D发展中的临床作用。在免疫学方面,T1DM的诊断主要依据患者血清中胰岛自身抗体的检测结果。在本研究中,98例T1DM患者中有50例(51.02%)存在1种或多种抗体,它们既可以用于对T1DM患者的诊断或预后评估,也可以用于对T1DM发病前高危人群的预测。本研究中仅2例ICIT1D患者的胰岛自身抗体检测结果为阳性,其中1例患者GADA和ICA阳性,1例患者IAA阳性,与T1DM患者相比,ICIT1D患者抗体阳性率极低。在日本的一项研究中,22例ICIT1D患者中仅有1例患者GADA阳性[13]。而在比利时[10]和美国[21]的报道中约50%的ICIT1D患者胰岛自身抗体阳性。上述研究结果表明亚洲胰岛自身抗体阴性的患者与西方胰岛自身抗体阳性的患者ICIT1D的发病机制可能存在差异,且东西方国家ICIT1D患者之间HLA基因型的差异对胰岛自身抗体的产生可能存在一定的影响。但这一结论仅为推测,仍需积累数据进行深入研究。
本研究中 ICIT1D患者与非ICIT1D患者相比,二者肿瘤类型差异存在统计学意义,表明不同类型的肿瘤患者接受抗PD-1/PD-L1药物治疗后是否发生ICIT1D存在差异,由于本研究样本量较小,且目前尚无相关研究表明具体哪些肿瘤类型在免疫治疗后更易发生ICIT1D,因此未来仍需积累数据进行深入研究。既往研究表明对于已经患有1种自身免疫疾病的患者,出现第2种自身免疫疾病的风险更高[22]。在本研究中,与未发生ICIT1D的患者相比, ICIT1D患者其他内分泌irAEs发生率更高。因此内分泌科医生在诊断ICIT1D患者时应常规完善甲状腺、肾上腺相关内分泌检查及影像学检查,有助于及时发现其他可能存在的内分泌irAEs。
综上所述,ICIT1D患者发生威胁生命的DKA较为常见,且本研究中14例ICIT1D患者截止到2022年3月均仍需接受外源胰岛素治疗,因此在开始免疫治疗之前肿瘤科医生应告知患者有发生ICIT1D的可能,并对患者及家属进行T1DM和DKA相关宣教,一旦出现威胁生命的DKA相关症状应及时至内分泌科就诊。此外,患者在接受PD-1/PD-L1抑制剂治疗期间应定期检测血糖,日本糖尿病协会建议在每次就诊(2~3周)时检测患者血糖水平,而美国临床肿瘤学会建议在诱导期间每个疗程12周及之后每3~6周检测血糖水平[13]。本研究中有4例患者在诊断为ICIT1D后仍继续接受抗PD-1药物治疗,1例患者在停药241 d后重新开始免疫治疗。相关指南建议若免疫治疗对患者肿瘤病情至关重要,可在威胁生命的内分泌疾病得到有效治疗后尽早重新开始免疫治疗[23]。
本研究中14例抗PD-1/PD-L1相关糖尿病患者发病年龄较晚,β细胞破坏迅速,DKA发生率较高,胰岛自身抗体阳性率低,出现ICIT1D的患者发生其他内分泌irAEs的风险更高。
然而,作为一项回顾性研究,本研究存在一定的局限性,仅纳入了单中心ICIT1D患者,因病例较为罕见,样本量相对较小;未对T淋巴细胞亚群功能行常规检测以及行HLA分型的患者人数有限导致研究对象HLA分型数据缺乏,因此无法评估细胞免疫功能及HLA基因型对ICIT1D的影响,未来还需更进一步积累数据。

