神经肌电图诊断糖尿病周围神经病变的临床作用分析
徐夏璇,翁秋燕
(深圳市龙华区中心医院功能科 广东 深圳 518110)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病极为常见的一种并发症,也是导致糖尿病患者生活质量下降和残疾的主要因素之一[1]。DPN可发生于糖尿病的各个病理阶段,但早期病情普遍较轻且无特异性表现,因此大部分合并DPN的糖尿病患者,都存在病情延误的情况[2]。由于糖尿病缺乏特异性治疗方案,临床治疗的核心思想是控制血糖,抑制或延缓并发症的发生,最终达到改善患者生活质量的目的,因此尽早诊断糖尿病周围神经病变对于改善糖尿病患者的预后具有重要的临床意义[3]。神经肌电图能够客观反映周围神经变化,是当前诊断糖尿病周围神经病变的主要方法。研究将以深圳市龙华区中心医院2019年12月—2021年2月收治的212例糖尿病患者根据是否合并DPN进行分组研究,以剖析神经肌电图的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2019年12月—2021年2月深圳市龙华区中心医院收治的212例糖尿病患者作为研究对象,并根据受试者是否合并糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)分为A组(合并DPN)98例,B组(不存在DPN)114例。A组中男性56例,女性42例,年龄48~74岁,平均年龄(61.9±6.9)岁,病程1~11年,平均病程(4.9±1.3)年;B组中男性67例,女性47例,年龄50~79岁,平均年龄(63.6±8.0)岁,病程1~8年,平均病程(4.1±2.4)年。两组病例除是否合并DPN外,其余资料差异均无统计学意义(P>0.05),具有可比性。
纳入标准:①患者均符合《中国2型糖尿病防治指南》(2017版)制订的关于2型糖尿病的诊断标准[4];②患者的认知状态及依从性良好;③受试者对于研究知情并自愿参与。排除标准:①合并先天性疾病、恶性肿瘤及肝肾功能障碍者;②有精神疾病及由于各种原因导致的依从性差者。
1.2 方法
两组对象均接受神经传导速度检测,检测前将室内温度控制在26~28 ℃,在整个操作过程中保证对象的肢体温度处于正常且相对恒定的状态,诱发仪器电位仪进行神经传导检测,包括正中神经、尺神经、腓总神经、胫神经的运动和感觉传导速度。
1.3 评价指标
比较两组对象正中神经、尺神经、腓总神经和胫神经的神经传导速度以及胫神经H反射和尺神经f波异常率。
1.4 统计学方法
采用SPSS 22.0统计软件分析数据。计量资料以均数±标准差(± s)表示,采用t检验;计数资料以频数(n)、百分比(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组正中神经传导速度比较
A组患者正中神经感觉及运动传导速度均低于B组,差异有统计学意义(P<0.05),见表1。
表1 正中神经传导速度( ± s,m/s)
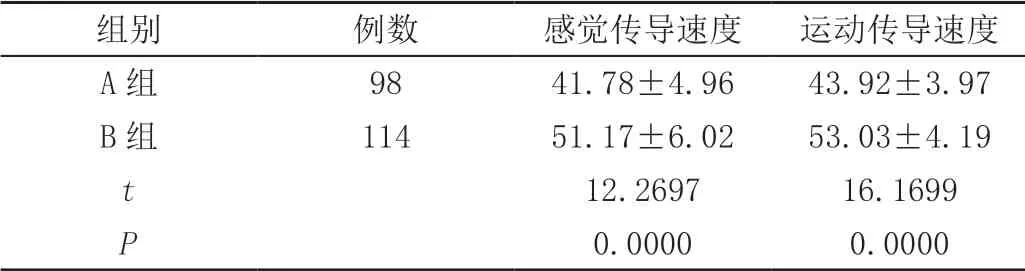
表1 正中神经传导速度( ± s,m/s)
2.2 两组尺神经传导速度比较
A组患者尺神经感觉及运动传导速度均低于B组,差异有统计学意义(P<0.05),见表2。
表2 尺神经传导速度( ± s,m/s)
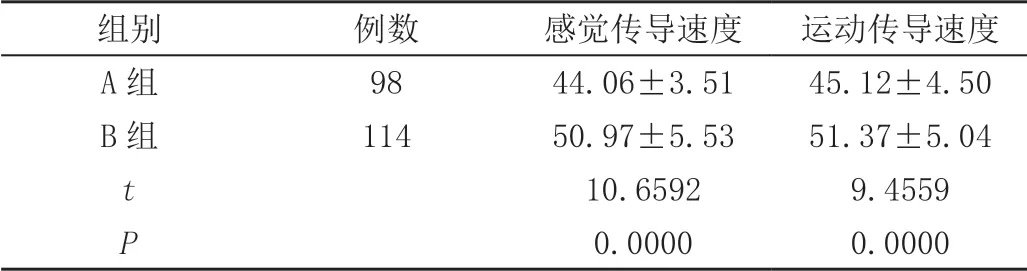
表2 尺神经传导速度( ± s,m/s)
2.3 两组腓总神经传导速度比较
A组患者腓总神经感觉及运动传导速度均低于B组,差异有统计学意义(P<0.05),见表3。
表3 腓总神经传导速度( ± s,m/s)
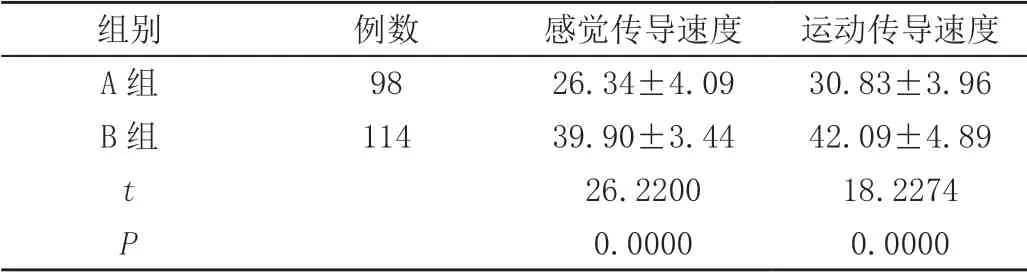
表3 腓总神经传导速度( ± s,m/s)
2.4 两组胫神经传导速度比较
A组患者胫神经感觉及运动传导速度均低于B组,差异有统计学意义(P<0.05),见表4。
表4 胫神经传导速度( ± s,m/s)
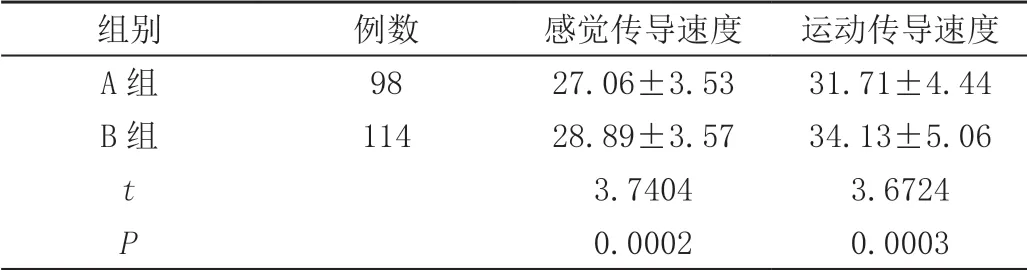
表4 胫神经传导速度( ± s,m/s)
2.5 两组胫神经H反射和尺神经f波异常结果
A组胫神经H反射和尺神经f波异常率均高于B组,差异有统计学意义(P<0.05),数据见表5。
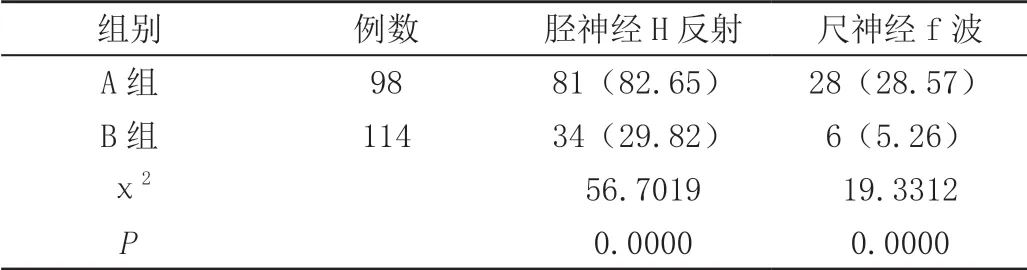
表5 胫神经H反射和尺神经f波异常率[n(%)]
3 讨论
糖尿病周围神经病变是糖尿病极为常见的一种并发症,可发生于糖尿病各个阶段,初期普遍不会出现特异性的症状表现,隐匿性较高,很容易导致病症迁延加重,糖尿病周围神经病变长时间得不到改善,很容易引起难治性神经损伤,严重影响患者的健康和生活质量。有研究表明糖尿病周围神经病变早期存在可逆性[5],同时多数患者在自觉症状出现前,就周围神经就已受到了不同程度的损伤,因此早期诊断并配合积极的治疗干预,对于改善糖尿病患者的中远期生活质量具有不可替代的临床意义。糖尿病周围神经病变的发病机制相对较为复杂,目前尚未完全掌握。随着临床研究的深入,由于高血糖状态所导致的代谢障碍、氧化应激、神经生长因子、血管病变等因素联合作用引发周围神经病变的结构出现改变或坏死,最终导致疾病发生及发展。此外,糖尿病患者的年龄和糖尿病病程也是诱发周围神经病变的高危因素,研究资料显示[6]:随着患者的年龄和病程的增加,代谢紊乱和“葡萄糖毒性记忆”等因素的影响也更明显,基于此这些因素促使糖尿病微血管病变并发症的发生。
在糖尿病周围神经病变的初筛过程中,神经病变的问卷调查(NTSS-6)是一种常用的症状评分调查,主要涉及神经病变的6个主要症状,包括酸痛、刺痛、电击疼痛、烧灼、麻木和其他异常疼痛,国外的研究发现NTSS-6是糖尿病周围神经病变症状筛查的有效手段,但是国内关于NTSS-6问卷表的研究相对较少,加上问卷表调查属于主观性判断,患者由于缺乏专业的医学知识,在症状的描述上很有可能与实际情况存在偏差,上述因素都会在很大程度上限制NTSS-6的临床实用价值,其他类似的问卷调查表,还包括S-LANSS调查表、密歇根糖尿病神经病变筛查表等,但都存在和NTSS-6问卷表类似的局限性。传统的神经传导速度检测是长期以来检测周围神经病变的主要方法,从以往的临床应用来看,SNAP、CMAP、DML、NCV波幅能够客观反映轴索与髓鞘的功能,受到病变发生的影响,相关指标也会发生相应的改变,神经传导速度能够确定损伤范围和受损的性质,但是单独应用也存在一定的局限性,临床上多采用联合方案进行检测。此外,从已有的研究资料来看[7-8],氧化应激在糖尿病的并发症发挥了重要的作用,因此通过评价糖尿病患者的MDA、DOS和神经功能参数早期检测周围神经病变也是一种可行的方案,宋娜等[9]在研究中发现,相对于健康体检者及单纯糖尿病患者,糖尿病合并周围神经病变的患者,MDA、IL-6、TNF-α水平有不同程度的升高,经logistic回归分析结果显示:上述三项指标均是导致Ⅱ型糖尿病周围神经病变的独立风险因素,ROC曲线分析结果证实,MDA、IL-6、TNF-α均是能够准确预测糖尿病周围神经病变的指标;但从临床应用的情况来看,免疫炎性反应和氧化应激检测更多的是作为辅助检测手段。
神经肌电图是现阶段医学体系下综合效果最好的神经检测方法,其优势在于能够准确记录神经肌肉活动中的生物电流,从而为肌肉无力、感觉确实、过敏和麻痹等症状的诊断提供客观的数据支持[10-11]。研究表明,糖尿病周围神经病变的发病率约为5%~8%,但不同文献对于相关发生率的报道存在较大的差异,考虑可能是检测方法或诊断标准不一致所致[12]。神经肌电图通过对肌肉生物电活动的情况从而判断神经肌肉功能的状态,同时还能准确区别其具体形态。文献资料记载:神经肌电图等电生理检测手段,能够大幅度提升糖尿病周围神经病变的早期发现率,通过轻微神经系统变化就能取得理想的诊断效果,检出率超过90.00%[13]。本次研究根据神经病变和神经传导速度之间的相关性,对糖尿病合并周围神经病变患者与单纯糖尿病患者分别进行了神经肌电图检测,神经肌电图能够作为糖尿病发生与否的辅助检测手段,而且能够对周围神经是否存在结节性脱髓鞘病变予以显示[14];就一般情况而言,糖尿病患者如果并发神经系统损害,均会出现不同程度的周围神经受损,神经肌电图基于该特性予以检测,能够取得理想的诊断效果。研究结果显示:A组患者的尺神经、正中神经、腓总神经、胫神经的传导速度均低于B组,感觉传导速度和运动传导速度组间比较差异均有统计学意义(P<0.05);另有研究表明,糖尿病周围神经病变患者很容易出现末端运动潜伏期延长和神经传导速度减缓等异常的可能,胫神经H反射能够客观反映运动纤维的功能状态,进而作为神经损害的判断依据之一[15-16];尺神经f波的波幅能客观反映近端神经病变,是当前糖尿病早期周围神经病变的主要诊断依据[17];研究结果显示:A组患者两项指标的异常率均显著高于B组(P<0.05),提示神经肌电图在糖尿病周围神经病变的诊断中可取得良好的效果。但须提到的一点是,有研究显示:胫神经H反射和尺神经f波异常率还受到患者的病程时间影响,即糖尿病病程越长异常率越高[18-19]。本次研究未针对不同病程的患者进行深入探讨,关于这一点有待后续大样本的研究数据跟进。
综上所述,糖尿病周围神经病变具有隐匿性及风险性高的特点,同时对于糖尿病患者的健康和生存质量影响巨大,早期诊断对于改善糖尿病患者的健康和生活质量具有重要的价值;神经肌电图通过经肌肉功能状态进行诊断可取得理想的临床效果,同时神经肌电图还具有操作难度小的优势,适宜大面积推广,值得在临床实践中推广及使用。

