既往胸部放疗对信迪利单抗联合多西他赛治疗Ⅳ期非小细胞肺癌病人预后的影响分析
郑纪红,韩强,冯金月,宋代颖,郭英,刘伊辉
目前肺癌仍是全球癌症相关死亡的主要原因,严重威胁着人类的身体健康,其中85%以上的肺癌由非小细胞肺癌(non-small cell lung cancer,NSCLC)组成[1]。因肺癌病人咳嗽、咳痰、胸痛、咯血等早期症状不明显,超过50%的肺癌病人确诊时已经处于晚期阶段[2]。NSCLC 的发生、发展机制仍不明确,但通常认为它与机体免疫系统互相作用与影响,并形成免疫抑制性微环境,因此抗肿瘤治疗更迫切地需求针对肿瘤微环境的药物[3]。近年来,随着人们对免疫治疗的研究不断深入,程序性死亡受体1(programmed death 1,PD-1)/程序性死亡配体1(programmed death ligand 1,PD-L1)抑制剂在晚期NSCLC 治疗中广泛应用,但免疫抑制剂单药治疗的客观缓解率不足20%,因此寻求提高免疫治疗应答率的治疗方案成为研究重点[4]。现已有多项研究表明放化疗联合免疫治疗均显著改善NSCLC 病人肿瘤微环境的免疫抑制性,通过下调免疫抑制调节性T 细胞数量和恢复T 细胞杀伤肿瘤细胞的能力来增强机体抗肿瘤免疫反应,是晚期NSCLC 治疗中较为有效的新策略[5-6]。信迪利单抗是一种抗PD-1 抗体,于2018 年经国家药品监督管理总局批准上市,这表明晚期NSCLC 的治疗进入中国自主创新的免疫时代。多西他赛为晚期NSCLC 标准二线治疗方案之一,其单药应用疗效差且不良反应发生率较高[7],一项II 期临床试验(NCT02574598 研究)证明多西他赛联合免疫治疗晚期NSCLC 可显著延长病人的生存期,且具有良好的安全性[8]。本研究回顾性分析信迪利单抗与多西他赛联合治疗Ⅳ期NSCLC 的有效性及安全性,为今后Ⅳ期NSCLC 病人二线治疗方案的选择提供更充分的理论依据。放疗可诱导肿瘤微环境的免疫调节,是免疫治疗的启动者,但目前关于既往放疗对免疫治疗的影响分析较少,本文通过分析既往胸部放疗对接受该联合方案治疗的Ⅳ期NSCLC 病人预后的影响,讨论既往胸部放疗在接受免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗病人预后中的临床价值。
1 资料与方法
1.1 一般资料回顾性分析2019 年2 月至2020 年1 月潍坊医学院附属医院收治的Ⅳ期难治性无基因突变NSCLC病人73例,均经病理组织学或细胞学明确诊断(组织学标本中PD-L1 表达情况不详),并有CT、磁共振成像(MRI)、正电子发射计算机断层显像(PET-CT)等影像学检查明确转移部位。纳入标准:①17 岁<年龄<80 岁;②一线抗肿瘤治疗方案失败,已接受信迪利单抗联合多西他赛治疗;③体力状况东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分为0~3 分;④存在至少1 个可测量评估的病灶;⑤无表皮生长因子受体或间变淋巴瘤激酶等基因突变;⑥重要脏器功能正常。排除标准:①合并其他恶性肿瘤者;②有免疫功能缺陷者;③合并活动性传染性疾病者。本研究符合《世界医学协会赫尔辛基宣言》相关要求,病人或其近亲属签署知情同意书。本研究失访病人3 例,最终共70 例病人纳入研究,所有病人至少接受2 周期信迪利单抗联合多西他赛治疗,依据既往是否行胸部放疗进行分组。如果病人在接受信迪利单抗之前接受了胸部放疗,则为放疗组(28 例),既往胸部放疗均应用医用电子直线加速器治疗,每次1.8~2.0 Gy,放疗剂量范围为45~70 Gy,放疗剂量中位数为60 Gy;主要危及器官受量分别为:脊髓剂量≤50 Gy,肺平均剂量≤20 Gy,双肺V20≤30%,心脏V30<40%、V40<30%。如果病人在接受信迪利单抗之前未行胸部放疗,则为无放疗组(42例)。
1.2 方法所有病人每周期治疗前均完善血常规、血生化、甲状腺功能、心电图等检查,如无明显异常,给予信迪利单抗注射液(规格:每支10 g/L,批号S20180016,信达生物制药生产)200 毫克/次联合多西他赛(规格:每支40 g/L,批号H200041129,齐鲁制药生产)75 mg/m2治疗,21 d 为1 个治疗周期,每2个周期进行1 次疗效评价,直到出现疾病进展或者无法耐受的不良反应。治疗中出现与多西他赛相关的3 级及以上的不良反应,下个周期减量20%。出现与信迪利单抗相关的3 级及以上的不良反应,暂停给药直至不良反应恢复至0~1 级或考虑永久停药。
1.3 观察指标及方法
1.3.1 观察终点 无进展生存时间(progressionfree survival,PFS)表示病人自该联合方案治疗开始起至疾病进展或疾病无进展末次随访的时间,随访截止日期为2021年4月。
1.3.2 疗效评价 所有病人每2个周期进行1次CT或MRI 检查,按实体瘤疗效评价标准(RECIST)1.1版,疗效分为:完全缓解、部分缓解、疾病稳定、疾病进展。总有效率定义为(完全缓解+部分缓解)/总例数×100%。疾病控制率(DCR)定义为(完全缓解+部分缓解+疾病稳定)/总例数×100%。
1.3.3 不良反应评价标准 不良反应采用美国国家癌症研究所通用毒性标准v4.0,主要不良反应包括骨髓抑制、肝脏毒性、乏力等。
1.4 统计学方法应用SPSS 20.0 软件统计。用χ2检验对两组计数资料进行比较;应用Kaplan-Meier法进行生存分析,行log-rank 检验,并绘制生存曲线,应用Cox 比例风险模型分析影响病人预后的因素,并计算各自的风险比(HR)和95%置信区间(CI)。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较两组病人的年龄、性别等一般资料比较,差异无统计学意义(P>0.05),两组具有可比性,见表1。
2.2 疗效比较放疗组总有效率、DCR 分别为46.43%、75.00%,无放疗组的总有效率、DCR 分别为40.48%、71.43%,但两组总有效率、DCR 比较差异无统计学意义(P>0.05),见表2。截至随访时间,仍有2 例病人继续接受联合方案治疗。放疗组和无放疗组病人中位无进展生存时间(mPFS)分别为7.9个月[95%CI:(7.1,8.7)]和6.5 个月[95%CI:(5.4,7.6)],log-rank P=0.004,差异有统计学意义;将放疗组的病人按放疗结束至开始信迪利单抗治疗的时间进行分层分析,分为时间间隔≤6 个月(12 例)和>6 个月(16 例),两者的mPFS 分别为8.6 个月[95%CI:(7.4,9.8)]和7.5 个月[95%CI:(6.7,8.3)],log-rank P=0.297,差异无统计学意义。
2.3 生存分析单因素分析中,与年龄、性别、病理类型、吸烟史等因素相比,既往胸部放疗[HR=0.490,95%CI:(0.296,0.810);P=0.005]是改善PFS预后的保护性因素,ECOG 评分不佳[HR=2.491,95%CI:(1.482,4.187);P=0.001]、脑 转 移[HR=1.795,95%CI:(1.026,3.138);P=0.040]是影响PFS预后的危险性因素(表3),并绘制生存曲线(图1~3)。依据单因素分析结果,将P<0.05 的因素(既往胸部放疗、ECOG 评分、脑转移)纳入多因素回归分析,结 果 示 既 往 胸 部 放 疗[HR=0.524,95%CI:(0.371,0.868);P=0.012]是改善PFS 的独立保护性因素,ECOG 评分不佳[HR=2.830,95%CI:(1.649,4.858);P<0.001]、脑 转 移[HR=1.941,95%CI:(1.085,3.473);P=0.025]是预后较差的独立危险性因素。
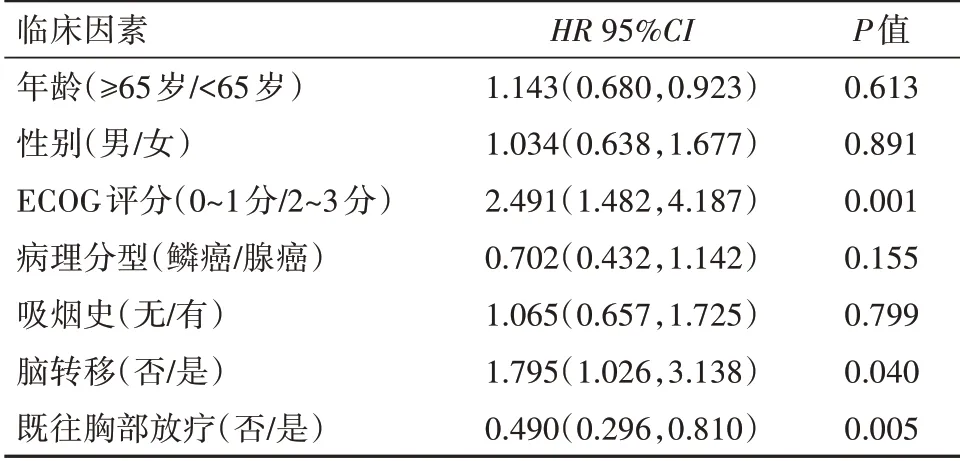
表3 与Ⅳ期无基因突变非小细胞肺癌70例PFS相关的单因素分析
2.4 不良反应分析两组各种不良反应比较差异无统计学意义,两组所有级别不良反应发生率分别为53.57%和54.76%,P=0.922,3 级及以上不良反应发生率分别为7.14%和9.52%,P=0.544,详见表4。上述不良反应给予对症处理后均好转或消失,总体安全性好。

表1 两组Ⅳ期无基因突变非小细胞肺癌病人一般资料比较/例

表2 两组Ⅳ期无基因突变非小细胞肺癌病人临床疗效比较
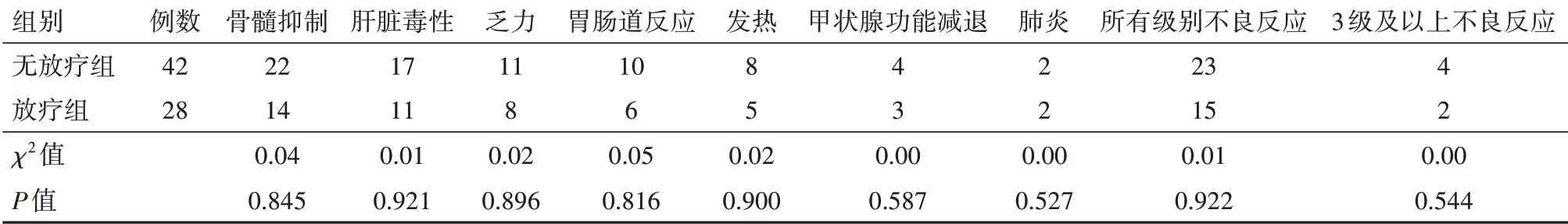
表4 两组Ⅳ期无基因突变非小细胞肺癌病人不良反应比较/例
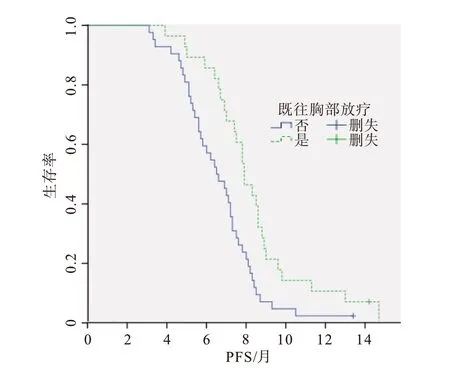
图1 既往胸部放疗对Ⅳ期无基因突变非小细胞肺癌70例无进展生存时间(PFS)的影响分析
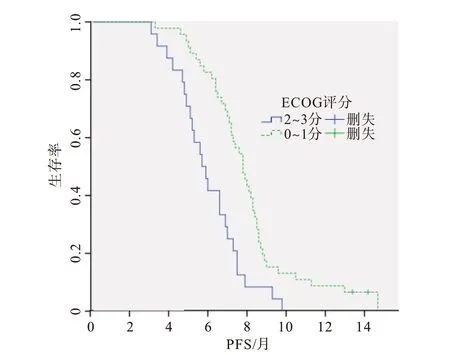
图2 不同东部肿瘤协作组(ECOG)评分对Ⅳ期无基因突变非小细胞肺癌70例无进展生存时间(PFS)的影响分析

图3 脑转移对Ⅳ期无基因突变非小细胞肺癌70例无进展生存时间(PFS)的影响分析
3 讨论
NSCLC 早期具有隐匿性的特点,临床分期多是晚期,提示预后相对不佳。在晚期NSCLC 中,高耐药性的发生导致了放化疗、靶向等传统治疗的失败,免疫治疗成为临床治疗中的重要一部分[9]。PD-1是一种下调效应T 细胞的抑制性检查点,肿瘤细胞可通过激活免疫检查点发生免疫逃逸[10]。信迪利单抗通过与机体免疫细胞表面的PD-1 结合,抑制PD-1 与肿瘤细胞表面的PD-L1 之间的相互作用,进而阻断了T 细胞抗肿瘤活性的抑制作用,使T 细胞重新激活并杀伤癌细胞[11]。一项临床前研究表明,信迪利单抗相对于其他抗PD-1药物,表现出对PD-1受体更高的亲和力和更强的抗肿瘤作用,且解离速度非常慢,这一特性决定了它对PD-1通路具有持久的阻断作用[12]。尽管抗PD-1 免疫治疗的效果多与病人PD-L1 表达水平有关,但有研究提示无论其表达情况如何,联合治疗可能是提高疗效、减少不良反应的有效措施[13]。
本研究结果示,两组病人的总有效率分别为46.43%、40.48%,DCR 分别为75.00%、71.43%,mPFS分别为7.9、6.5 个月,与NCT02574598 研究[8]结果相似,提示免疫与化疗联合治疗的病人生存获益明显。本研究中两组病人总有效率、DCR 比较均差异无统计学意义,表明既往胸部放疗无法预测接受ICIs 治疗的晚期NSCLC 病人的疗效。本研究提示放疗组病人有更好的PFS 获益(P=0.004)。这与Ratnayake 等[14]的回顾性研究结果一致,该研究发现给予纳武利尤单抗二线治疗的转移性非细胞肺癌病人中,既往或同期接受胸部放疗者PFS 获益明显(P=0.020)。本研究单因素及多因素分析结果均表明既往胸部放疗是改善病人PFS 预后的保护性因素。其可能存在的机制为:放疗诱导肿瘤释放特异抗原,将其转化为原位疫苗,放疗也可调节肿瘤新抗原的表达,进而激活先天性和适应性免疫反应,并维持机体免疫记忆,对肿瘤做出长期免疫应答,抗PD-1 治疗可增强机体抗肿瘤活性[15]。这种免疫记忆可能是既往放疗对病人生存期影响的机制之一,但具体的机制仍需研究证实[16]。本研究将放疗组的病人按放疗结束至开始ICIs治疗的时间进行分层分析,结果示病人的PFS 预后与该时间无明显关系。PACIFIC 研究表明放化疗与ICIs 续贯应用时,ICIs 应用时间越早,获益越明显[17]。因此本研究可能尚有不足,结论可能随着样本量增大而改变。
本研究还表明脑转移、ECOG 评分不佳是病人预后较差的独立危险性因素。脑为NSCLC 常见的转移器官之一,晚期阶段的NSCLC 病人脑转移率高达30%,严重影响病人的生活质量[18]。由于肺癌可诱导全身免疫抑制这一特点,推测脑转移可能在被发现之前的很长一段时间就已经发生[19]。然而,迄今为止的多数研究都集中在转移性肿瘤治疗的阶段。免疫治疗虽在晚期NSCLC 治疗中获得良好的效果,但在早期疾病中的作用仍不清楚,仍须进一步探究。本研究中两组病人的不良反应多为1~2级,少数病人发生3级及以上不良反应,表明病人对信迪利单抗、多西他赛的副作用尚可耐受。虽然有研究显示既往有胸部放疗的NSCLC 病人在接受帕博利珠单抗治疗后肺毒性发生率更高[17],但本研究中两组病人所有级别不良反应发生率、3 级及以上不良反应发生率比较均差异无统计学意义,提示既往胸部放疗与不良反应增加无关。
综上所述,信迪利单抗联合多西他赛二线以上治疗Ⅳ期无基因突变NSCLC 有良好的疗效和安全性;既往胸部放疗有助于接受ICIs 治疗的Ⅳ期NSCLC 病人预后的判断,具体机制还需进一步研究。本研究也存在一定局限:样本量偏少。

