水蛭素上调VEGF/Notch1信号通路促进人骨髓间充质干细胞成骨分化
任锟 吉鸿涛 韩磊 李彦杰
河南省中医院康复科,河南 郑州 450000
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是从骨髓中分离出来的干细胞,具有自我复制和多项分化的潜能[1]。诱导BMSCs向成骨细胞分化,是目前干细胞研究领域的热点之一。研究表明多种单味或复方中药能够调控BMSCs的成骨分化[2]。水蛭是一种传统中药,具有活血破瘀通经消积等功效,在骨科疾病治疗中有广泛的使用[3]。有研究表明水蛭能够提升骨损伤大鼠骨愈合相关基因的表达并促进骨折愈合[4]。目前还未有研究探讨水蛭对骨髓间充质干细胞的影响。水蛭素是水蛭的提取物和活性成分[5],本课题观察水蛭素对BMSCs细胞成骨分化的影响,并探讨其分子机制,为水蛭素的药理研究提供理论参考。
1 材料与方法
1.1 细胞和试剂
人骨髓间充质干细胞BMSCs(ATCC® PCS-500-012?)购于美国菌种保藏中心;水蛭素冻干粉购于上海源叶生物科技有限公司(批号:S31625);BCIP/NBT染色试剂盒购于南京建成生物工程研究所(批号:I023-1-1);茜素红染色液购于上海尚宝生物科技有限公司(批号:R23312)。Runx2(sc-390351)、Osterix(sc-393325)、COL1A1(sc-59772)、VEGF(sc-7269)、Notch1(sc-376403)、Jagged1(sc-390177)、CBF1(sc-271128)、β-actin(sc-84322)蛋白一抗和二抗(sc-2005)购于美国Santa Cruz公司。
1.2 MTT检测细胞增殖
实验于河南省中医院中心实验室完成。BMSCs细胞常规培养于含有10%胎牛血清,100 IU/mL青霉素和链霉素的DEME培养基中,置于37 ℃、5% CO2环境下培养。水蛭素冻干粉用DEME培养基配置为20 ATU/mL的母液。取对数期生长的BMSCs细胞分组培养。对照组:正常培养的BMSCs细胞;诱导组:细胞培养基中加入成骨诱导液(含100 mmol/L地塞米松,50 mg/L维生素C和10 mmol/Lβ-甘油磷酸钠);水蛭素组:细胞培养基加入成骨诱导液的同时分别加入低浓度(1 ATU/mL)、中浓度(10 ATU/mL)或高浓度(20 ATU/mL)水蛭素。每24 h换液一次,培养7 d。弃去原有培养基后每孔加入终浓度为5 g/L的MTT,37 ℃常规培养4 h。弃去上清,随后在每孔加入150 μL的二甲基亚砜(DMSO),振荡10 min使结晶充分溶解。酶标仪(Bio-Rad Laboratories,CA,USA)在490 nm波长处检测吸光度值。实验重复3次,细胞增殖率=(OD实验组/OD对照组)×100%。
1.3 流式细胞仪检测细胞凋亡
细胞分组培养一周后,加入0.5%胰蛋白酶进行消化收集细胞。加入Annexin V-FITC和碘化丙啶(PI)。避光染色后上机检测细胞凋亡率。
1.4 RT-PCR检测mRNA表达
细胞分组培养一周后,Trizol试剂盒提取总RNA并检测其浓度。反转录获得cDNA,PCR检测基因的表达。反应条件为95 ℃ 30 s,60 ℃ 1 min,72 ℃ 30 s,共进行45个循环,随后72 ℃延伸10 min。以内参基因β-actin为对照,用2-ΔΔCt法计算基因mRNA的相对表达水平。引物序列见表1。

表1 引物序列
1.5 BCIP/NBT试剂盒检测碱性磷酸酶
碱性磷酸酶(alkaline phosphatase,ALP)水平采用BCIP/NBT试剂盒进行检测。将BMSCs细胞以1×105个/孔接种于24孔板中,24 h后加入成骨诱导液和水蛭素分组处理,培养一周后,按试剂盒说明加入BCIP/NBT工作液进行染色,用PBS清洗后观察染色结果。实验重复3次。
1.6 茜红素染色检测矿化结节
细胞分组培养一周后,加入40 g/L的多聚甲醛在室温下孵育20 min,随后使用茜素红染色液于37 ℃染色5 min,倒置显微镜下观察细胞矿化结节并记录。
1.7 Western blot检测
BMSCs细胞分组培养一周后,加入PBS缓冲液清洗3次,随后加入蛋白裂解液反应30 min,然后用SDS-PAGE电泳分离蛋白。转膜1 h后,加入5%脱脂牛奶在室温下进行1 h的封闭。分别加入待测蛋白一抗4 ℃过夜,加入二抗室温孵育1 h。用凝胶成像仪对条带进行定量分析。实验重复3次。
1.8 统计学分析
用 SPSS 22.0统计学软件对数据进行分析,结果以均数±标准差表示,实验数据用单因素方差分析(One-Way ANOVA)进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 水蛭素对骨髓间充质干细胞增殖的影响
如图1所示,与对照组相比,加入成骨诱导液培养的诱导组BMSCs细胞增殖显著提升(P<0.05)。诱导培养基中添加低剂量的水蛭素后,BMSCs的细胞增殖较对照组没有明显改变,但在中剂量和高剂量水蛭素处理组中,细胞增殖提升,差异有统计学意义(P<0.05)。并且与中剂量水蛭素组相比,高剂量水蛭素组细胞增殖升高,差异有统计学意义(P<0.05)。在后续实验中,选取高剂量20 ATU/mL作为水蛭素处理浓度。
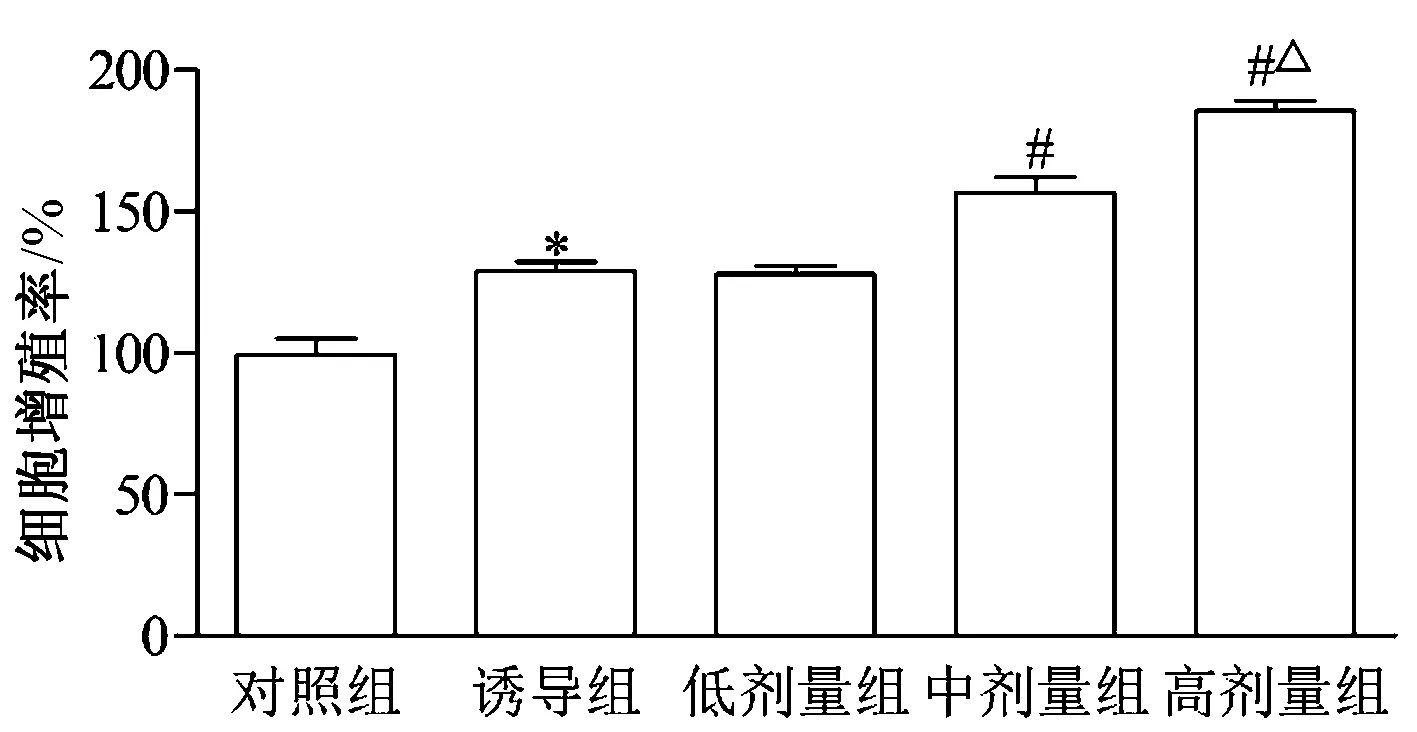
图1 水蛭素对骨髓间充质干细胞增殖的影响
2.2 水蛭素对骨髓间充质干细胞凋亡的影响
如图2所示,诱导组细胞凋亡低于对照组,水蛭素组BMSCs细胞凋亡低于诱导组,差异有统计学意义(P<0.05)。
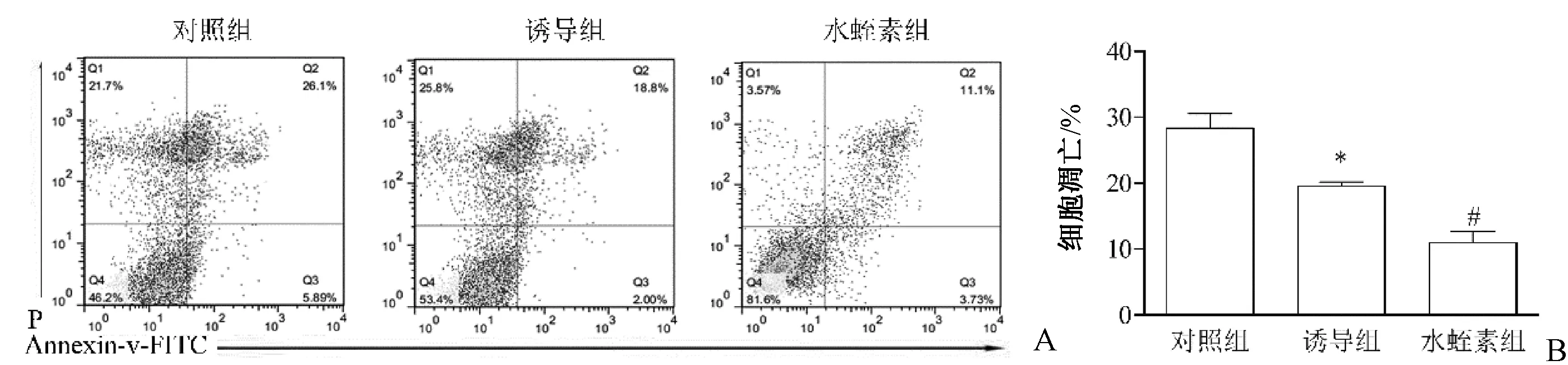
图2 水蛭素对骨髓间充质干细胞凋亡的影响
2.3 水蛭素对骨髓间充质干细胞成骨分化基因表达的影响
如图3所示,与对照组相比,诱导组BMSCs细胞中成骨基因Runx2、Osterix和COL1A1的mRNA和蛋白表达均显著提升(P<0.05)。同时,加入水蛭素处理的BMSCs细胞中成骨基因的mRNA和蛋白表达高于诱导组,差异有统计学意义(P<0.05)。
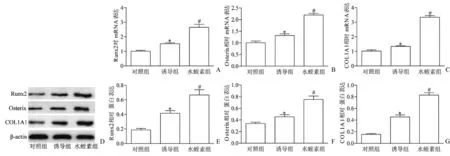
图3 水蛭素对骨髓间充质干细胞中成骨基因表达的影响
2.4 水蛭素对骨髓间充质干细胞中ALP蛋白表达的影响
BCIP/NBT染色测定ALP蛋白表达,结果见图4。与对照组相比,诱导组ALP表达显著增多。同样,水蛭素组的ALP蛋白表达较诱导组显著提升。

图4 水蛭素对骨髓间充质干细胞中ALP蛋白表达的影响(×100)
2.5 水蛭素对骨髓间充质干细胞中矿化结节的影响
如图5所示,茜红素染色后观察BMSCs细胞,对照组和诱导组均未见明显矿化结节,但诱导组较对照组颜色加深。水蛭素细胞可见明显大小不一的红褐色矿化结节。
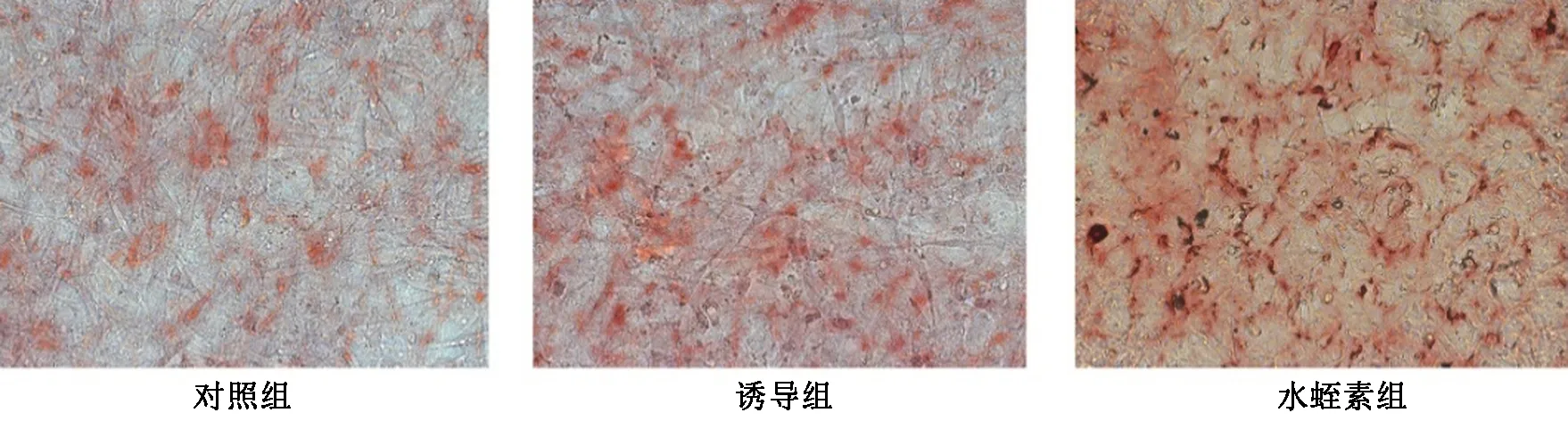
图5 水蛭素对骨髓间充质干细胞中矿化结节的影响(×200)
2.6 水蛭素对骨髓间充质干细胞中VEGF/Notch1信号通路的影响
如图6所示,与对照组比较,诱导组和水蛭素组BMSCs细胞中VEGF、Notch1、Jagged1和CBF1的mRNA和蛋白表达量均升高,并且水蛭素组高于诱导组,差异有统计学意义(P<0.05)。

图6 水蛭素对骨髓间充质干细胞中VEGF/Notch1信号通路的影响
3 讨论
骨髓干细胞因其在自体移植和体外培养等多方面的优势,在多种疾病的临床治疗中具有重要的应用前景[6]。中医临床上常用多种中药治疗促进骨损伤愈合,研究也证实了多种中药可通过提升骨髓间充质干细胞的成骨分化促进骨愈合[7]。有研究表明水蛭素可应用在骨愈合、骨关节炎及其他骨科疾病的治疗中,但关于其作用机制的研究较少[8]。
本研究选取人骨髓间充质干细胞BMSCs为靶标进行水蛭素药理作用研究。加入成骨诱导液的BMSCs细胞增殖水平显著提升,说明成骨诱导能够提升BMSCs的细胞增殖,此结果与前人一致[9]。水蛭素在低浓度时对细胞增殖没有影响,但是中高浓度的水蛭素明显促进成骨诱导BMSCs细胞的增值,可见水蛭素对BMSCs细胞增殖的提升作用具有一定的浓度依赖性。后续实验中选取了对BMSCs细胞增殖影响效果更大的高浓度水蛭素进行。成骨细胞分化成熟过程中也伴随着细胞凋亡的减少[10]。本实验结果发现水蛭素降低了成骨诱导的BMSCs细胞凋亡。
Runx2是成骨细胞分化早期的重要标志物之一,可激活一系列下游成骨基因的转录,参与成骨分化的调节[11]。Osterix和COL1A1在骨形成的胶原蛋白分泌和骨钙化等过程中起重要作用,同样是成骨分化的重要参与因子[12]。本研究发现水蛭素促进成骨诱导的BMSCs细胞中Runx2、Osterix和COL1A1的表达,证明水蛭素和成骨分化之间的联系。另外,ALP和矿化结节常被用于检测骨髓间充质干细胞分化水平[13]。本研究中水蛭素的处理明显提升了BMSCs细胞中ALP的水平,并且在加入水蛭素处理的细胞中,观察到明显的矿化结节。以上结果表明,水蛭素对BMSCs细胞的成骨分化有促进作用。
在骨愈合大鼠模型中,发现水蛭素可以正向调节VEGF的表达[4]。另有研究表明,水蛭素在血管内皮细胞中激活VEGF/Notch1信号通路[14]。VEGF/Notch1信号通路参与骨髓间充质干细胞分化的调节[15]。VEGF对BMSCs的增殖和分化均有促进作用[16]。成骨分化过程中,Notch1通路中的受体和Jagged1配体结合激活信号转导途径,进而激活下游因子CBF1的表达,促进细胞向成骨方向转化[17]。本研究结果显示,水蛭素显著提升了成骨诱导的BMSCs细胞中VEGF、Notch1、Jagged1和CBF1的表达,提示水蛭素对细胞成骨分化的调节作用可能是由上调VEGF/Notch1通路产生的。成骨分化的过程被多种细胞因子和信号通路所调节[18]。在今后的研究中应进一步实验确认水蛭素对VEGF/Notch1的调控在成骨分化中的作用,并探索水蛭素对其他成骨分化相关信号通路的影响。
综上,本研究以水蛭素对人骨髓间充质干细胞的作用为切入点,在成骨诱导的BMSCs细胞中测定出其对细胞增殖有促进作用,对细胞凋亡有抑制作用,提升细胞中成骨基因Runx2、Osterix和COL1A1的表达,同时促进细胞中ALP水平的提升和矿化结节的生成,并且上调细胞中VEGF/Notch1信号通路。此结果说明水蛭素能够促进人骨髓间充质干细胞的成骨分化,并且其作用可能是通过激活VEGF/Notch1通路产生的,为理解水蛭素的药理作用提供理论依据。今后,还需进一步建立动物模型探索水蛭素对骨髓间充质干细胞的作用,并探索其作为单方中药试剂或辅助试剂对骨科疾病可能的治疗作用。

