益生菌制剂通过PI3K/Akt信号通路改善骨质疏松大鼠的骨代谢和骨量
刘旭良 周元敏 曾祥英 王兆杰 宋慧东 李伯庭
1. 广州市第十二人民医院骨外科,广东 广州 510620
2. 广州市第十二人民医院放射科,广东 广州 510620
3. 广州市第十二人民医院供应室,广东 广州 510620
4. 广州市第十二人民医院消化内科,广东 广州 510620
骨质疏松症(osteoporosis,OP)是以骨量降低、骨质被破坏为特征的一种代谢异常性疾病,骨脆性增加引起的骨折是导致老年患者致死及致残的重要原因之一[1]。有研究[2]认为肠道菌群失调产生的大量炎症因子是导致OP患者破骨细胞骨吸收亢进、骨量丢失加重的易感因素。益生菌是对人体肠道机能有益的一类微生物的总称,可纠正肠道菌群失调,抑制炎症反应,维持肠道正常生理功能[3]。用益生菌制剂纠正肠道菌群失调及骨代谢异常,可能是治疗OP的一种新思路。但益生菌制剂通过何种途径预防、治疗及影响骨代谢,目前还不十分明确。
PI3K/Akt信号通路是参与炎症反应、细胞增殖凋亡及骨代谢异常的关键通路。已有研究证实,肠道菌群失调介导的肠炎症反应过程中,PI3K/Akt活化可加重肠道功能紊乱[4],且PI3K/Akt通路活化可抑制FoxO1的磷酸化活化及核转位,而引起破骨细胞死亡,影响骨代谢[5],提示PI3K/Akt的活化可能是肠道菌群调节骨代谢过程中的潜在调节机制。本研究拟从PI3K/Akt信号通路方面,探究益生菌制剂干预治疗OP大鼠的骨代谢异常的潜在机制,以期为OP的抑菌治疗提供新的思路。
1 材料与方法
1.1 材料
1.1.1主要试剂及仪器:白色念珠菌(货号:LA9490,北京索莱宝科技有限公司);PI3K/AKT通路激活剂(货号:M03755-LUP,北京百奥莱博科技有限公司);益生菌制剂-枯草芽孢杆菌二联活菌(妈咪爱)(货号:S20020037,0.5 g/片,北京韩美药品有限公司);革兰氏染液(货号:D008,上海雅吉生物科技有限公司);白细胞介素(IL)-6、IL-1、Ⅰ型原胶原氨基端延长肽(PINP)、β胶联降解产物(β-CTX)、碱性磷酸酶(ALP)和骨钙素(OC)等ELISA试剂盒购自上海心语生物科技有限公司;HE及抗酒石酸酸性磷酸酶(TRACP)染色液(货号:SY2022及T6823,北京伊塔生物科技有限公司及无锡菩禾生物医药技术有限公司);PI3K、Akt、叉头框蛋白O(FOXO)、骨保护素(OPG)、核因子κB受体活化因子(RANKL)等兔抗大鼠抗体均购自美国abcam公司;DPX-NT双能骨密度仪购自美国Lunar公司;菌落计数器购自西班牙IUL公司。
1.1.2实验动物:1月龄健康雄性SD大鼠90只,体重200~220 g,购自广东至远生物医药科技有限公司[生产许可证号:SCXK(粤)2021-0057],于广州市第十二人民医院动物房中常规饲养。实验过程符合国家和单位有关实验动物的管理和使用规定,经广州市第十二人民医院动物伦理委员会批准[批号:IACUC-01(202101015)],符合3R原则。
1.2 方法
1.2.1动物处理及分组:取SD大鼠75只,参照文献[6]灌胃109cfu/mL的白色念珠菌50 μL,1次/d,共7 d,建立肠道菌群失调模型(粪便含水量显著增高,粪便杆球菌比例低于1∶1,为造模成功)共75只,并随机分为模型组、益生菌制剂组、PI3K/AKT通路激活组、益生菌+通路激活组,另取15只大鼠予以自由饮用无菌生理盐水,作为正常对照组。正常对照组及模型组大鼠在分组后自由饮用无菌生理盐水;益生菌制剂组参照文献[7]按1 mL/200 g体重灌胃给予益生菌制剂-枯草芽孢杆菌二联活菌,连续14 d;PI3K/AKT通路激活组参照文献[8]经腹腔注射PI3K/AKT通路激活剂-rh IGF(20 μg/kg),1次/d,连续14 d进行干预治疗;益生菌+通路激活组腹腔注射PI3K/AKT通路激活剂-rh IGF的同时,灌胃给予益生菌制剂进行治疗。
1.2.2肠道菌群检测:收集大鼠新鲜粪便,精密称重后置于烘箱中烘干至恒重,检测含水量(%)=(烘干前重量-烘干后重量)/烘干前重量×100 %。用无菌竹签在洁净载玻片上涂布粪便,厚薄适宜,待自然干燥后固定,行革兰染色,用显微镜[100(物镜)×10(目镜)]观察记录菌群分布。
1.2.3血清血指标检测:将大鼠麻醉后,取腹主动脉血2 mL,按ELISA试剂盒说明书方法检测IL-6、IL-1、PINP、β-CTX、ALP及OC水平。
1.2.4骨质指标检测:运用DPX-NT双能骨密度仪对大鼠右侧股骨颈进行扫描(分辨率1.0 mm×1.0 mm,速度60 mm/s)以检测骨密度;处死大鼠,取右侧股骨,剔除表面的结缔组织,于马弗炉中550 ℃灰化至恒重,取出用分析天平称取重量。取左侧股骨头,置入10 %中性甲醛固定液固定24 h,30 %甲酸脱钙3 d,梯度乙醇脱水、二甲苯透明2 h,石蜡包埋,制成4 μm切片,常规HE及TRACP染色,制成病理标本,在400倍显微镜下观察,运用Image-pro-plus图像系统分析单位面积内TRACP染色切片中破骨细胞数目。
1.2.5Western blotting检测蛋白表达:将左后侧股骨头置于液氮中冻存后敲碎,在液氮液中碾磨成粉末,加入预冷的RIPA裂解液裂解,蛋白提取试剂盒提取蛋白,BCA法测蛋白浓度,制胶后,取20 μg蛋白行电泳、转膜(PVDF膜)反应,5 %脱脂奶粉封闭操作后,加入1∶600的PI3K、p-PI3K、Akt、p-Akt、FOXO1、p-FOXO1、OPG、RANKL一抗及β-actin(1∶1 200)内参抗体4 ℃孵育过夜,羊抗兔辣根过氧化物酶二抗(1∶1 600)室温孵育0.5 h,显影液和定影液浸泡PVDF膜,晾干后,运用ImageJ软件分析条带相对灰度值。
1.3 统计学处理
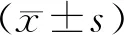
2 结果
2.1 益生菌制剂对大鼠粪便含水量及肠道菌群的影响
与正常对照组相比,模型组大鼠粪便含水量、肠杆菌、白色念球菌升高(P<0.05),肠球菌、双歧杆菌、乳酸杆菌减少(P<0.05)。与模型组相比,益生菌制剂组大鼠粪便含水量、肠杆菌、白色念球菌降低(P<0.05),肠球菌、双歧杆菌、乳酸杆菌升高(P<0.05);PI3K/AKT通路激活组大鼠粪便含水量、肠杆菌、白色念球菌较模型组升高(P<0.05),肠球菌、双歧杆菌、乳酸杆菌较模型组减少(P<0.05)。益生菌+通路激活组大鼠粪便含水量、肠杆菌、白色念球菌较益生菌制剂组升高(P<0.05),肠球菌、双歧杆菌(、乳酸杆菌较益生菌制剂组减少(P<0.05),见图1。
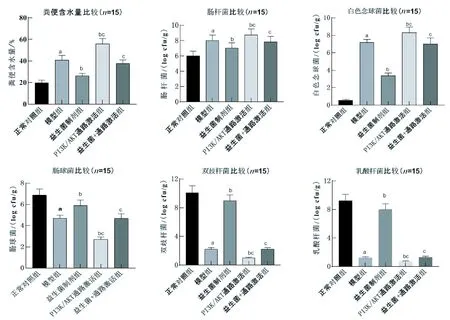
图1 大鼠粪便含水量及肠道菌群比较
2.2 益生菌制剂对大鼠血清炎症因子及骨生物学指标的影响
与正常对照组相比,模型组大鼠血清IL-6、IL-1、β-CTX水平升高(P<0.05),PINP、ALP及OC水平降低(P<0.05)。与模型组相比,益生菌制剂组大鼠血清IL-6、IL-1、β-CTX水平降低(P<0.05),PINP、ALP及OC水平升高(P<0.05);PI3K/AKT通路激活组大鼠血清IL-6、IL-1、β-CTX水平较模型组升高(P<0.05),PINP、ALP及OC水平较模型组降低(P<0.05)。益生菌+通路激活组大鼠血清IL-6、IL-1、β-CTX水平较益生菌制剂组升高(P<0.05),PINP、ALP及OC水平较益生菌制剂组降低(P<0.05),见图2。
图2 大鼠血清炎症因子及骨生物学指标比较
2.3 益生菌制剂对大鼠骨密度及骨灰质量的影响
与正常对照组[(226.17±12.42)mg/cm3,(769.86±25.93)mg]相比,模型组大鼠骨密度[(165.31±10.36)mg/cm3]及骨灰质量[(640.32±20.21)mg]降低(P<0.05)。与模型组相比,益生菌制剂组大鼠骨密度[(216.00±14.48)mg/cm3]及骨灰质量[(747.48±27.94)mg]升高(P<0.05);PI3K/AKT通路激活组大鼠骨密度[(105.34±8.66)mg/cm3]及骨灰质量[(569.64±17.86)mg]较模型组降低(P<0.05)。益生菌+通路激活组大鼠骨密度[(177.28±15.08)mg/cm3]及骨灰质量[(667.62±27.30)mg]较益生菌制剂组降低(P<0.05)。
2.4 益生菌制剂对大鼠骨病理学变化的影响
HE染色可见,正常对照组大鼠骨小梁排列有序且结构致密。模型组大鼠可见股骨远端骨小梁排列稀疏且减少,骨细胞结构模糊。益生菌制剂组大鼠骨小梁及骨细胞结构趋于正常,PI3K/AKT通路激活组大鼠骨小梁间隔增宽,粗细不均匀。益生菌+通路激活组大鼠骨小梁变化较模型组相近,见图3。
TRACP染色可见,破骨细胞阳性染色呈粉红色,模型组可见破骨细胞数目增多,骨吸收陷窝增大,破骨细胞数目[(16.38±1.05)个/mm2]高于正常对照组[(4.17±0.42)个/mm2],P<0.05。益生菌制剂组大鼠破骨细胞数目[(7.00±0.78)个/mm2]较模型组减少(P<0.05),PI3K/AKT通路激活组大鼠破骨细胞数目[(25.28±2.06)个/mm2]较模型组进一步升高(P<0.05)。益生菌+通路激活组大鼠破骨细胞数目[(16.08±1.08)个/mm2]较益生菌制剂组增多(P<0.05),见图3。

图3 股骨远端组织HE与TRACP染色图(×400)
2.5 益生菌制剂对大鼠PI3K/Akt/FOXO1通路蛋白及RANKL/OPG表达的影响
与正常对照组相比,模型组大鼠p-PI3K/PI3K、p-Akt/Akt、p-FOXO1/FOXO1、RANKL、RANKL/OPG表达升高(P<0.05),OPG表达降低(P<0.05)。与模型组相比,益生菌制剂组大鼠p-PI3K/PI3K、p-Akt/Akt、p-FOXO1/FOXO1、RANKL、RANKL/OPG降低(P<0.05),OPG表达升高(P<0.05);PI3K/AKT通路激活组大鼠p-PI3K/PI3K、p-Akt/Akt、p-FOXO1/FOXO1、RANKL、RANKL/OPG表达较模型组升高(P<0.05),OPG表达较模型组降低(P<0.05)。益生菌+通路激活组大鼠p-PI3K/PI3K、p-Akt/Akt、p-FOXO1/FOXO1、RANKL、RANKL/OPG表达较益生菌制剂组升高(P<0.05),OPG表达较益生菌制剂组降低(P<0.05),见图4,表1。

表1 大鼠p-PI3K/PI3K、p-Akt/Akt、p-FOXO1/FOXO1、RANKL、RANKL/OPG及OPG表达比较

图4 p-PI3K、PI3K、p-Akt、Akt、p-FOXO1、FOXO1、RANKL、OPG蛋白表达免疫印迹图
3 讨论
临床上常用促进骨形成药物或抑制骨吸收药物来纠正OP引起的骨代谢失衡,但这些药物虽能在一定程度上抑制骨量丢失的进一步恶化,但却并不能使丢失的骨量恢复[9]。肠道菌群可通过消化系统的分泌与吸收、机体的免疫调节,来影响雌激素类似物分泌及骨质形成微量元素如钙、磷的吸收及代谢、骨钙形成等过程[10]。相关研究还发现,炎性因子如IL-6和TNF-α是强烈的骨吸收刺激因子,老年OP患者或绝经后OP女性患者IL-6和TNF-α的升高,可抑制OPG产生,导致RANKL/OPG比例增加,破骨细胞吸收加速而出现骨丢失;而肠道菌群失调后可诱导肠内炎症的应答,导致IL-6和TNF-α等溶骨性细胞因子大量释放,这也解释了肠炎患者更易患OP的可能原因[11]。PINP是反应骨形成的指标,β-CTX可降解PINP而可用于骨吸收的判定。本研究发现,大鼠出现粪便含水量增加、粪便中肠杆菌、白色念球菌等致病菌升高,肠球菌、双歧杆菌、乳酸杆菌等益生菌减少等肠道菌群失调症状后,也出现OP症状(IL-6和TNF-α升高,ALP、OC、PINP等促骨形成因子减少,β-CTX及破骨细胞骨吸收升高,RANKL/OPG比例增加,股骨骨密度、骨灰质减少,股骨远端松质骨小梁断裂及骨细胞减少等病理损伤严重),提示肠道菌群失调性OP模型造模成功。
益生菌可激发糖类细菌活性、增加有机酸分泌、提高肠道酸性微环境、增强肠道抗菌能力、抑制病原菌生长繁殖,而维持肠道功能及菌群平衡。已有研究发现益生菌可抑制炎症反应,来降低破骨细胞形成,继而减少骨破坏,并逆转成骨细胞减少[12]。卵巢切除鼠补充益生菌制剂-鼠李糖乳杆菌可改善肠道通透性,减轻肠道炎症,改善骨密度[13]。Delgado-Ruiz等[14]发现益生菌治疗法可通过抑制IL-6分泌及肠道炎症反应,来抑制卵巢去势小鼠破骨细胞活性,而增加骨量,提示用益生菌制剂来治疗OP可能是未来的新趋势。本研究发现,用益生菌制剂-枯草芽孢杆菌二联活菌灌胃治疗后,大鼠粪便含水量及致病菌降低,益生菌升高提示菌群趋于正常,大鼠OP症状也较模型组明显缓解,证实肠道菌群调节剂-益生菌制剂可能成为治疗骨质疏松症的新靶点。
PI3K/Akt通路是参与炎症反应及骨代谢失衡的关键通路之一。大量研究发现肠道菌群失调后,血浆及肠道组织内IL-6和TNF-α升高可刺激PI3K活化,PI3K通过D3-磷酸肌醇PH结构域促进Akt磷酸化,并负性调节肌醇-5-磷酸酶(SH2),促进破骨细胞前体存活、分化、成熟及骨吸收,且PI3K/Akt通路的活化可通过诱导胱硫醚-β-合成酶(CBS)及转录因子Sp1表达来生成内源性硫化氢,从而抑制肠道动力、加速肠通透性损伤及细菌移位,导致机体更为严重的炎症反应[15-16]。另外,PI3K/Akt通路下游FoxO1活化可与激活转录因子4(ATF4)相互作用,来促进防御蛋白合成,而抵抗骨骼内的应激反应,维持成骨正常增殖,但PI3K/Akt通路的磷酸化途径活化,可直接阻断FoxO1依赖的DNA结合能力受损,引起成骨细胞凋亡、破骨细胞生成及骨吸收控制节点失衡,导致骨代谢异常及OP发生[17]。本研究发现,大鼠肠道菌群失调后,股骨组织中PI3K/Akt通路磷酸化活性升高,p-FoxO1升高而FoxO1活性降低,破骨细胞活性升高(破骨细胞数目增多,RANKL/OPG比例增加),而用激活剂进一步促进PI3K/Akt通路磷酸化活性后,FoxO1活性进一步降低,大鼠表现出更为严重的OP及菌群失调现象,提示PI3K/Akt通路活性升高,可加重肠道菌群失调及骨丢失。益生菌制剂干预治疗组,PI3K/Akt通路处于抑制状态,其菌群失调及骨丢失现象最轻,PI3K/Akt通路激活剂可明显减弱益生菌制剂的抗OP及菌群失调作用。
综上所述,益生菌制剂干预治疗,可减弱大鼠菌群失调并纠正OP引起的骨代谢异常,且其作用可能与抑制PI3K/Akt通路激活有关。这为有效防治肠道菌群失调诱导的骨量减少及OP的治疗提供新的思路,但肠道菌群失调患者极多,菌群种类繁杂,临床表现复杂多变,缺少特异性,PI3K/Akt通路在成骨及破骨中的调控作用争议也较多,肠道菌群引起骨量减少的具体机制还需进一步探究。

