失重下柚皮苷作用于T细胞干预的成骨细胞增殖分化研究
周森 孙奇峰 蒋雷 张亚龙 杨宇恒 尹文哲
哈尔滨医科大学附属第二医院骨科,黑龙江 哈尔滨 150001
长期失重环境导致机体出现骨量丢失问题,被认为是骨质疏松症(osteoporosis,OP)的诱导因素[1],机体免疫机能的降低同样困扰着人们进一步探索外太空。近年来,我国在中药防护骨量丢失方面做了探索性研究,已崭露头角。已有研究[2]表明,中药物质柚皮苷,可以增加骨量,促进骨折愈合。另外,柚皮苷对小鼠免疫能力有调节作用[3]。骨免疫学[4]指出,免疫反应同时影响着骨代谢,两个系统之间存在相互作用。柚皮苷既调节骨代谢同时又具有调节免疫作用,而其中的免疫因子又参与骨代谢,那么,这两者之间的共同细胞因子在骨代谢和免疫之间扮演何种角色?基于此,本研究拟对微重力下柚皮苷对T细胞干预下的成骨细胞增殖分化及其发生机制展开进一步的探讨。
1 材料与方法
1.1 材料与仪器
1.1.1实验材料:选取出生24 h内的 SD 乳鼠(雌雄不限)10只,用于成骨细胞取材。实验动物由哈尔滨医科大学附属第二医院实验动物中心提供。原代大鼠T淋巴细胞购于赛百慷(上海)生物技术股份有限公司;低糖DMEM培养液、胰蛋白酶、II型胶原酶、青-链霉素 (Solarbio公司);胎牛血清(四季青,浙江天杭生物科技股份有限公司);碱性磷酸酶(ALP)试剂盒(南京建成生物工程研究所);碱性磷酸酶检测试剂盒(碧云天生物技术有限公司);茜素红S染色液(0.2 %, pH 8.3,北京索莱宝科技有限公司);CCK-8试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒增强型(碧云天生物技术有限公司);柚皮苷(成都植标化纯生物技术有限公司);Mouse Anti-GAPDH-Loading Control antibody、Mouse Anti-PCNA antibody、Mouse Anti-Erk2 antibody、 Goat Anti-Mouse IgG/HRP antibody(北京博奥森生物技术有限公司);超敏ECL发光液(上海雅酶生物医药科技有限公司)。
1.1.2实验仪器:主要仪器: 旋转培养系统(RCCS,美国Equl 公司) ;CO2培养箱(德国 Heraeus 公司);培养瓶、培养板、培养皿(美国corning公司) ;Olympus IX70 光学倒置显微镜[Olympus(奥林巴斯)中国分公司];电泳仪、转膜系统(美国Bio-Rad公司) ;全自动数码凝胶成像系统 (上海天能科技有限公司,Tanon GIS2010) ;图像分析软件(德国 Leica 公司) ;酶标仪(奥地利,AUTHOS HT2) 。
1.2 方法
1.2.1成骨细胞培养:于75 %乙醇浸泡5 min后,在无菌条件下取得SD乳鼠头盖骨,仔细刮除表面结缔组织,反复用PBS冲洗,洗去血丝。置于含双抗的PBS培养皿中,用眼科剪将骨片剪成约1 mm3的组织块。转移至离心管中,1 200 r/min,离心5 min弃去杂质上清,加入2 mL无EDTA胰酶,37 ℃消化30 min,中间震荡一次。弃上清,骨片中加入0.1 % II型胶原酶2 mL,37 ℃消化1.5 h,每隔约30 min震荡一次,留取上清,1 000 r/min,离心10 min,重悬后接种。待贴壁细胞长至铺满瓶底80 %~90 %后,经胰蛋白酶消化,以1∶2比例传代后继续培养。取处于对数生长期成骨细胞(第三代),用于后续实验。
1.2.2原代成骨细胞鉴定
1.2.2.1碱性磷酸酶活性化学染色:取处于对数生长期的第三代成骨细胞,以4 %多聚甲醛固定液固定30 min,按碱性磷酸酶活性检测试剂盒要求进行染色检测。
1.2.2.2钙化结节染色(茜素红法):取处于对数生长期的第三代成骨细胞,弃去培养基,培养板用PBS冲洗3次,以4 %多聚甲醛固定液固定30 min,蒸馏水冲洗3次,37 ℃下0.2 %茜素红[茜素红-Tris-Hcl(pH 8.3)]染色30 min,蒸馏水冲洗。在低倍镜视野(×40)下进行矿化结节观察。
1.2.3柚皮苷溶液配制:称量10 mg柚皮苷粉末,用0.085 mL DMSO溶液充分溶解后,用0.22 μm过滤器过滤除菌,即可配得浓度为0.2 mol/L的柚皮苷母液。通过完全培养基稀释母液分别得到2×10-3、2×10-4、2×10-5、2×10-6、2×10-7mol/L 梯度浓度的干预液。所有干预液用0.22 μm微孔过滤器过滤除菌,4 ℃避光保存备用。
1.2.4药物浓度确定
1.2.4.1CCK-8 法检测细胞增殖情况:取处于对数生长期的第三代成骨细胞,消化后重悬细胞,调整细胞浓度为5×104/mL,以5×103个/孔接种于 96 孔培养板,每孔体积100 μL。分为干预组与对照组,干预组分别加入梯度浓度的柚皮苷干预液10 μL(终浓度分别为2×10-4、2×10-5、2×10-6、2×10-7、2×10-8mol/L),对照组加入等剂量不含血清的培养基溶液。孵育24 h后,每孔加入10 μL的CCK-8溶液,于培养箱内孵育1 h。酶标仪测定在450 nm处的吸光度,计算出细胞增值率。
1.2.4.2碱性磷酸酶活性测定和Western blot检测:取生长状态良好的第三代成骨细胞,接种置6孔板中,细胞生长至皿底的80 % ~ 90 %时,干预组分别加入梯度浓度的柚皮苷干预液(终浓度分别为2×10-4、2×10-5、2×10-6、2×10-7、2×10-8mol/L),对照组加入等剂量不含血清的培养基溶液,继续培养24 h。提取细胞总蛋白,通过BCA蛋白浓度测定试剂盒测定蛋白浓度。应用ALP检测试剂盒检测各组ALP细胞活力。加入5×上样缓冲液后沸水煮10 min,使用80 V恒压待样品进入分离胶后加压至120 V恒压电泳全程后转膜,加入含5 %脱脂奶粉的TBST缓冲液,室温封闭1 h。加入1∶1 000 稀释的抗小鼠 PCNA(北京博奥森生物技术有限公司),4 ℃冰箱孵育过夜。TBST 清洗膜 3 次。加入 1∶10 000稀释的羊抗鼠二抗孵育 1 h,TBST 清洗 3 次,运用超敏ECL发光液(上海雅酶生物医药科技有限公司)检测不同样品蛋白表达。
1.2.5失重模型的建立:采用RCSS细胞培养系统,以30 r/min均匀培养48 h,期间随时观察细胞,若有气泡产生应及时清除。将对照组置于培养瓶中,在正常重力下常规培养。
1.2.6成骨细胞与T淋巴细胞直接共培养
1.2.6.1分组:取生长状态良好的第三代成骨细胞随机分成正常重力不加药组、正常重力加药组、失重不加药组、失重加药组。待细胞铺满至瓶底,将T细胞以5×105个/mL浓度与其直接共培养。加药组加入柚皮苷干预液。失重组置于回转器内。
1.2.6.2ALP碱性磷酸酶活性测定:四组细胞培养48 h后,提取总蛋白,通过BCA蛋白浓度测定试剂盒测定蛋白浓度,应用ALP检测试剂盒检测各组ALP细胞活力。
1.2.6.3Western blot检测:失重组细胞培养48 h后,弃去培养基,用PBS 清洗后,吸尽残余液体,加入适量RIPA裂解液,用细胞刮刮下细胞后转移至1.5 mL EP管中。按照说明书使用BCA试剂盒测量蛋白浓度,加上样缓冲液,在100 ℃下变性处理蛋白10 min。制胶完成后,按总蛋白量20 μg上样。使用80 V恒压待样品进入分离胶后加压至120 V恒压电泳至完成电泳,20 V半干转转膜20 min后,使用5 %脱脂奶粉封闭 1 h。然后敷目的一抗 ,4 ℃冰箱保存过夜,次日使用TBST洗膜3次,每次10 min,室温下二抗孵育2 h,再使用TBST洗膜3次,每次10 min ,显影后采集图像。
1.3 统计学分析
采用 GraphPad Prism 8.0进行统计分析。每个实验独立重复 3 次。多组间比较采用单因素方差分析,两组之间比较采用t-test进行分析。以P<0.05 判断为差异具有统计学意义。
2 结果
2.1 原代成骨细胞鉴定
2.1.1碱性磷酸酶染色:可见大量染色阳性细胞出现,细胞膜及胞浆内颗粒染色呈蓝黑色颗粒,块状深染颗粒,见图1。

图1 成骨细胞(第3代)碱性磷酸酶染色(× 40)
2.1.2茜素红染色:细胞汇合时均呈多层重叠生长,细胞局部堆集成灶状,形成钙结节,茜素红染色改结节染成橘红色,见图2。
图2 成骨细胞(第3代)茜素红染色(× 40)
2.2 药物浓度确定
2.2.1CCK-8测定细胞增殖:不同梯度浓度柚皮苷干预液组细胞增殖率均明显升高(2×10-4、2×10-6、2×10-7、2×10-8mol/L组,P<0.05 ; 2×10-5mol/L组,P<0.01)。其中2×10-7mol/L组细胞增殖率最高。见图3。
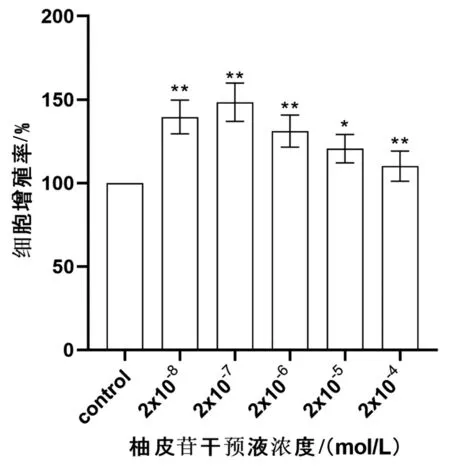
图3 各浓度柚皮苷干预液对成骨细胞增殖率的影响
2.2.2ALP活力测定:不同梯度浓度柚皮苷干预液组ALP活力值均高于对照组(2×10-5、2×10-6、2×10-8mol/L组,P<0.05; 2×10-4、2×10-7mol/L组,P<0.01)。其中2×10-7mol/L组ALP活力值最高。见图4。
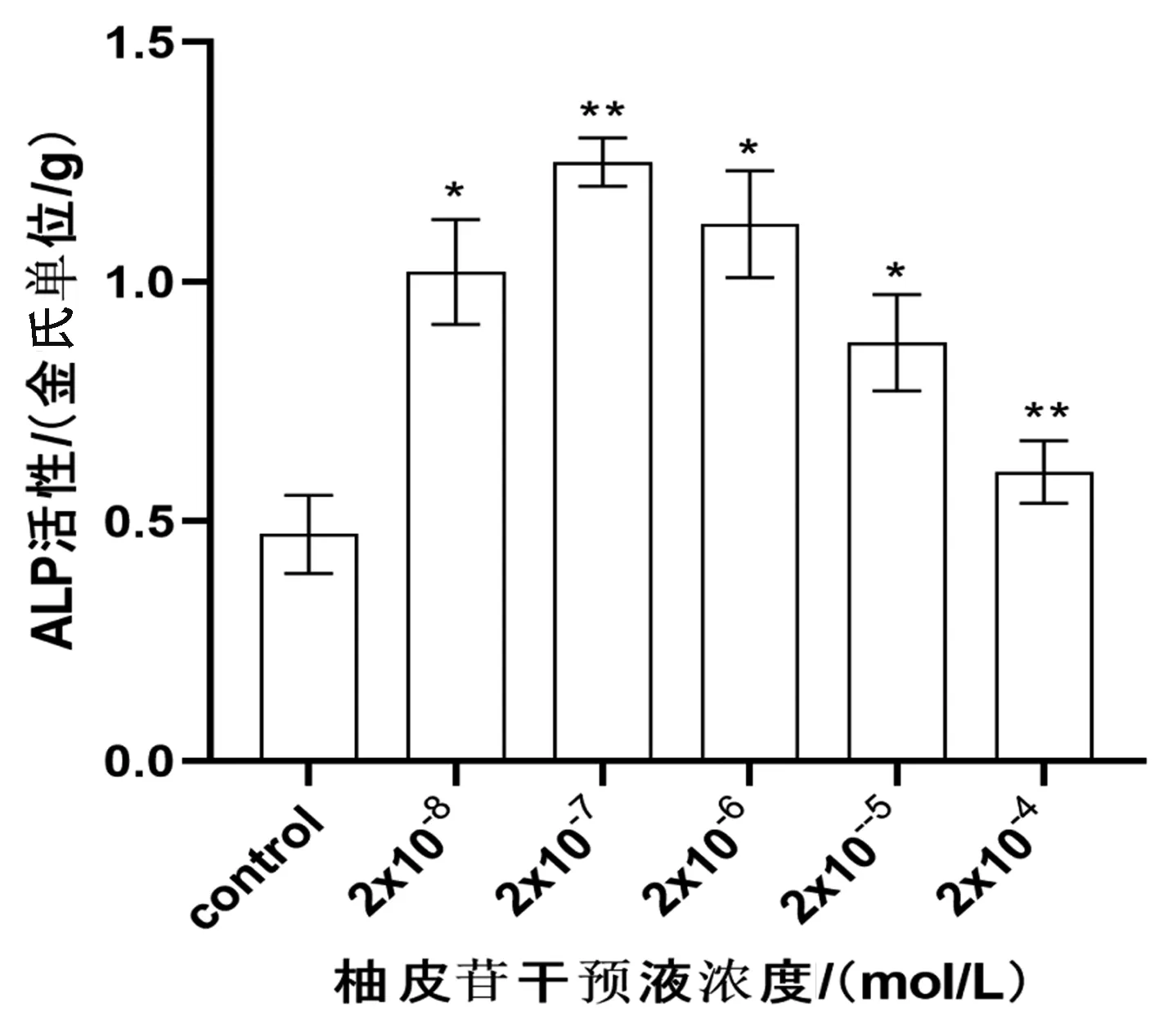
图4 各浓度柚皮苷干预液对成骨细胞ALP活性的影响
2.2.3各组PCNA蛋白水平表达:成骨细胞经过各组浓度梯度柚皮苷干预液干预24 h后,通过Western blot检测蛋白PCNA表达情况,柚皮苷干预液可显著上调PCNA蛋白表达(P<0.01)。其中2×10-7mol/L组的表达最高。见图5。结合CCK-8细胞增殖率实验与ALP活力测定实验,在2×10-7mol/L浓度时,柚皮苷干预液对成骨细胞增殖分化的影响最高,在后续研究中将参照这个浓度进行相关实验。
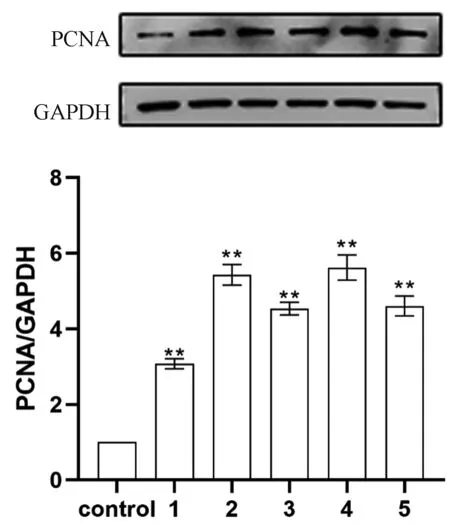
图5 各组PCNA蛋白表达电泳图及条带量化结果
2.3 微重力下成骨细胞与T淋巴细胞直接共培养
2.3.1ALP活性:加药组ALP活性显著高于未加药干预组(正常重力不加药组与正常重力加药组相比、失重不加药组与失重加药组相比,P<0.01);失重组ALP活性显著低于正常重力组(正常重力不加药组与失重不加药组相比、正常重力加药组与失重加药组相比,P<0.05)。见图6。
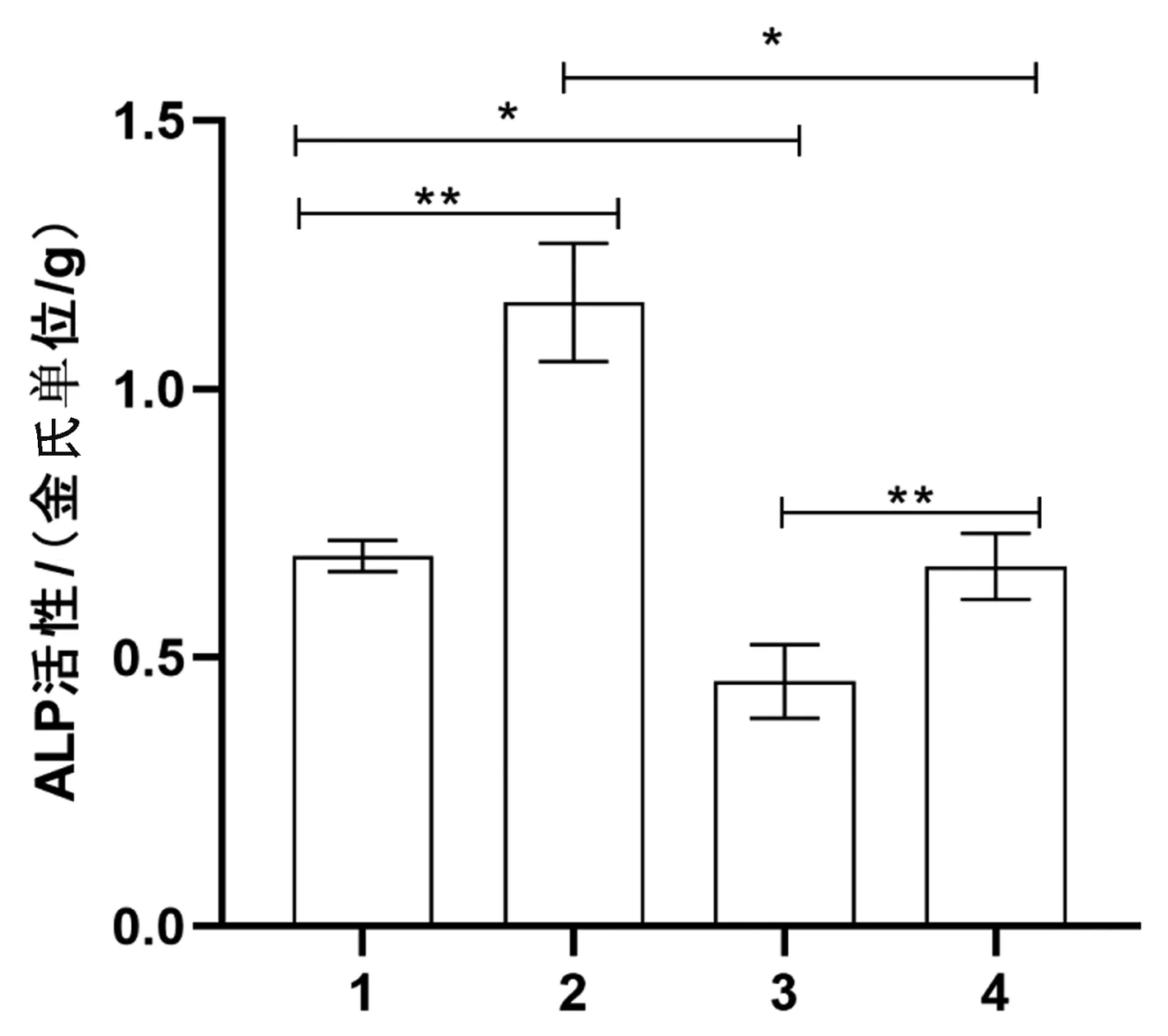
图6 各组ALP活性表达
2.3.2失重组测定PCNA蛋白表达:加药组显著高于未加药组(P<0.01),柚皮苷促进了T淋巴细胞干预下的成骨细胞增殖。进一步测定通路蛋白ERK2表达,加药组显著高于未加药组(P<0.01)。表明ERK2蛋白参与此过程。见图7。

图7 失重组PCNA、ERK2蛋白表达电泳图及条带量化结果
3 讨论
骨质疏松症是一种全身代谢性骨病,其特征是骨量、骨质量和微结构退化[5]。由成骨细胞和破骨细胞共同参与的骨重建失衡导致了这种病理性骨病[6]。与化学合成的药物相比,中医药用于防治骨质疏松症因具有不良反应少、适合长期服用和治疗效果稳定的特点,逐渐成为一种主流治疗手段[7]。柚皮苷是骨碎补的主要作用成分,可以有效促进骨髓基质细胞的增殖并促使其向成骨细胞分化[8]。柚皮苷的干预有效促进了已分化成骨细胞的正常功能,表现为提高骨钙素的表达[9]。有报道[10]表明通过检测人骨髓间充质干细胞在不同浓度柚皮苷作用下的增殖分化情况,在一定浓度范围内,促进成骨相关的作用和柚皮苷浓度呈计量依赖关系。不同浓度梯度柚皮苷干预液作用成骨细胞后,通过CCK-8检测细胞增殖情况、ALP活力检测观察细胞分化情况。此外,还进行了PCNA蛋白表达分析,以证实柚皮苷对成骨细胞增殖的影响[11]。本课题组认为柚皮苷干预液在2×10-7mol/L浓度时,对成骨细胞的增殖分化作用最佳。
骨免疫学说[4]指出,在骨质疏松症发生发展的过程中,免疫系统参与病理和慢性病的形成。有报道[12]提出,T淋巴细胞可以刺激骨髓间充质干细胞成骨分化。同样,柚皮苷对免疫系统的多个环节都有一定的保护或增强作用[3],能够提高T淋巴细胞亚群 CD3、CD4、IL-2、TNF-α水平,而这其中一些又是骨代谢因子。柚皮苷既调节骨代谢同时又具有调节免疫的作用,而其中的免疫因子又参与了骨代谢[13]。在骨代谢方面,ERK1/2蛋白通路与IL-6、IL-2、OPG 等免疫因子有关[5,14]。因此,本研究旨在探讨两者之间的共同细胞因子在骨代谢和免疫之间的关联及其作用。
使用Synthecon RCCS三度空间微重力培养系统构建细胞微重力环境[15],通过分组观察微重力和药物对T淋巴细胞介导下的成骨细胞增殖分化的影响。在正常重力下,对比药物对成骨细胞影响,结果表明柚皮苷干预液可以显著提高成骨细胞的碱性磷酸酶活性,提高成骨细胞PCNA蛋白表达,促进成骨细胞增殖及分化;在柚皮苷干预下,对比重力对成骨细胞影响。在失重状态下,其可以明显降低成骨细胞的碱性磷酸酶活性,抑制成骨细胞分化。进一步观察失重组通路蛋白ERK2的表达,发现柚皮苷干预组的ERK2表达远高于对照组。说明在微重力下,T淋巴细胞介导成骨细胞在柚皮苷干预下产生的增殖分化可能与ERK2通路蛋白激活有关。

