儿童重症肺炎支原体肺炎支气管肺泡灌洗液中炎症细胞因子变化及临床意义分析
王洁 王丹丹 张薇 纵书芳 王寅
肺炎支原体(mycoplasma pneumoniae,MP)是引起儿童呼吸道感染的常见病原体,肺炎支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)成为儿童社区获得性肺炎的主要类型之一,占15%~40%[1-3]。近年来,儿童MPP 发病率呈现逐年增长趋势,且重症MMP(severe mycoplasma pneumoniae pneumonia,SMMP)占比也逐年升高,不仅增加治疗难度,且除肺部症状及体征外,还极易引起心肌炎、肝炎等肺外并发症[4]。SMPP 的发病机制尚不完全明确,多项研究表明细胞免疫所介导的炎症反应与其发生及发展有关,且有研究显示MMP 患儿的支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中多项炎症细胞因子呈现明显异常变化[5]。目前,相关研究多集中于病情严重程度与BALF 中炎症细胞因子水平的相关性研究,涉及SMMP患儿BALF 中炎症细胞因子水平变化与MP-DNA 载量、转归等的关系研究较少。因此,本研究就此开展相关研究和分析,以期为儿童SMPP 的临床诊治提供一定的参考依据,现报告如下。
1 资料与方法
1.1 一般资料 选取2020 年1 月~2021 年6 月在本院接受支气管肺泡灌洗术的66 例SMPP 患儿为SMPP组。纳入标准:①符合《儿童肺炎支原体肺炎诊治专家共识(2015 年版)》[6,7]中对SMMP 的诊断标准;②具有支气管镜术以及肺泡灌洗指征;③年龄1~14 岁,首次发病;④痰培养显示未合并细菌、病毒、真菌等感染;⑤临床资料完整。排除标准:①合并支气管哮喘、肺结核等其他呼吸系统疾病患儿;②入院时已行气管插管或切开、机械通气(mechanical ventilation,MV)患儿;③合并血液系统疾病、免疫系统疾病、心脑血管系统疾病、恶性肿瘤患儿;④合并严重心、肝、肺、肾等原发性疾病患儿;⑤近期严重创伤、手术患儿;⑥荨麻疹、湿疹及过敏性鼻炎等过敏状态患儿。另选同期因支气管异物入院需行支气管镜术以及肺泡灌洗的非SMPP 患儿66 例为非SMPP 组,异物吸入时间≤1 d,近6 个月内无肺部感染史,其余排除标准同SMPP组。SMPP 组患儿年龄1~13 岁;非SMPP 组患儿年龄1~13 岁。两组患儿一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。SMPP 组根据中华医学会儿科急救学组提出的小儿危重病例评分(pediatric critical illness score,PCIS)[8]进一步分为非危重组(81~100 分,34 例)、危重组(71~80 分,25 例)与极危重组(0~70 分,7 例);病程中发生呼吸衰竭需行MV 患儿作为MV 组(29 例),无需MV 患儿为非MV 组(37 例)。本次研究获得患儿家长的知情同意,且研究设计经过医院伦理委员会审核并批准通过。
表1 两组患儿一般资料比较[n(%),]

表1 两组患儿一般资料比较[n(%),]
注:两组比较,P>0.05
1.2 主要仪器与试剂 人细胞因子酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA) 试剂盒由美国R&D 公司提供;离心机为美国 Eppendorf 公司生产;纤维支气管镜为日本Olympus 公司生产;Rayto全自动酶标仪(RT6100);实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪由美国BD 公司提供;电子支气管镜(BF-XP260F)由奥林巴斯提供。
1.3 研究方法
1.3.1 BALF 采集 两组患儿均接受纤维支气管镜检查或治疗,根据《支气管肺泡灌洗液细胞形态学检验中国专家共识(2020)》[9]和《中国儿科可弯曲支气管镜术指南(2018 年版)》[10]中关于儿童BALF 的采集标准要求施行。选取一侧支气管或患侧支气管肺段,采用37℃无菌生理盐水(总量<3 ml/kg)分3 次进行灌洗,留取灌洗液5 ml,采用双层无菌纱布进行过滤去除黏液,然后转移至离心管中。BALF 样品在4℃温度下,以转速1200 r/min 离心10 min,分离上清液,保存于4℃冰箱中于24 h 内统一测定。
1.3.2 检测方法 采用双抗体夹心ELISA 法检测BALF 中炎症细胞因子,包括白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-2(interleukin-2,IL-2)、白细胞介素-4(interleukin-4,IL-4)、白细胞介素-6(interleukin-6,IL-6)、干扰素-γ(interferon-γ,IFN-γ)。MP-DNA 载量采用PCR 荧光探针法进行检测,具体操作步骤按照试剂说明书严格执行。SMPP 组于急性期和恢复期各测1 次。
1.4 观察指标 比较SMPP 组患儿急性期和非SMPP组患儿BALF 中炎症细胞因子水平;SMPP 组不同病情、不同危重程度患儿急性期BALF 中炎症细胞因子及MP-DNA 载量,急性期与恢复期BALF 中炎症细胞因子水平。分析SMPP 组患儿急性期BALF 中炎症细胞因子与MP-DNA 载量的相关性。
1.5 统计学方法 采用SPSS22.0统计学软件对研究数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t检验;不符合正态分布的计量资料采用非参数检验;计数资料以率(%)表示,采用χ2检验;相关性采用Pearson 线性相关性分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患儿BALF 中炎症细胞因子水平比较SMPP组患儿急性期BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN-γ 均显著高于非SMPP 组,差异具有统计学意义(P<0.05)。见表2。
表2 两组患儿BALF 中炎症细胞因子水平比较()
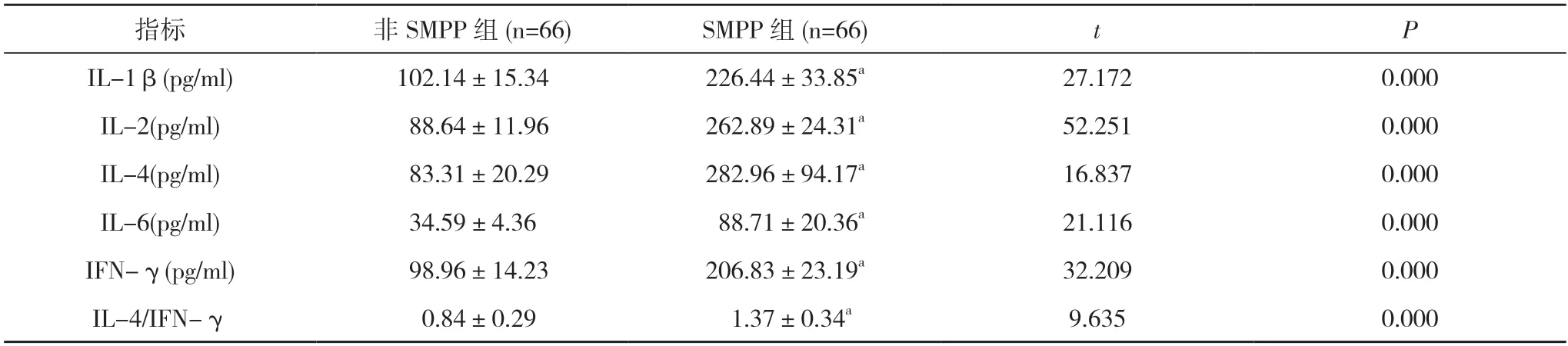
表2 两组患儿BALF 中炎症细胞因子水平比较()
注:与非SMPP 组比较,aP<0.05
2.2 SMPP 组不同病情患儿急性期BALF 中炎症细胞因子及MP-DNA 载量比较 MV 组患儿急性期BALF中MP-DNA 载量、IL-1β、IL-6 水平显著高于非MV 组,差异具有统计学意义(P<0.05);两组患儿急性期BALF中IL-2、IL-4、INF-γ 及IL-4/IFN-γ 比较差异无统计学意义(P>0.05)。见表3。
表3 SMPP 组不同病情患儿急性期BALF 中炎症细胞因子及MP-DNA 载量比较()

表3 SMPP 组不同病情患儿急性期BALF 中炎症细胞因子及MP-DNA 载量比较()
注:与非MV 组比较,aP<0.05
2.3 SMPP 组不同危重程度患儿BALF 中炎症细胞因子水平及MP-DNA 载量比较 随着病情程度的加重,SMPP 患儿急性期BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN-γ 及MP-DNA 载量呈显著升高趋势,非危重组、危重组、极危重组比较差异均具有统计学意义(P<0.05)。见表4。
表4 SMPP 组不同危重程度患儿急性期BALF 中炎症细胞因子水平及MP-DNA 载量比较()
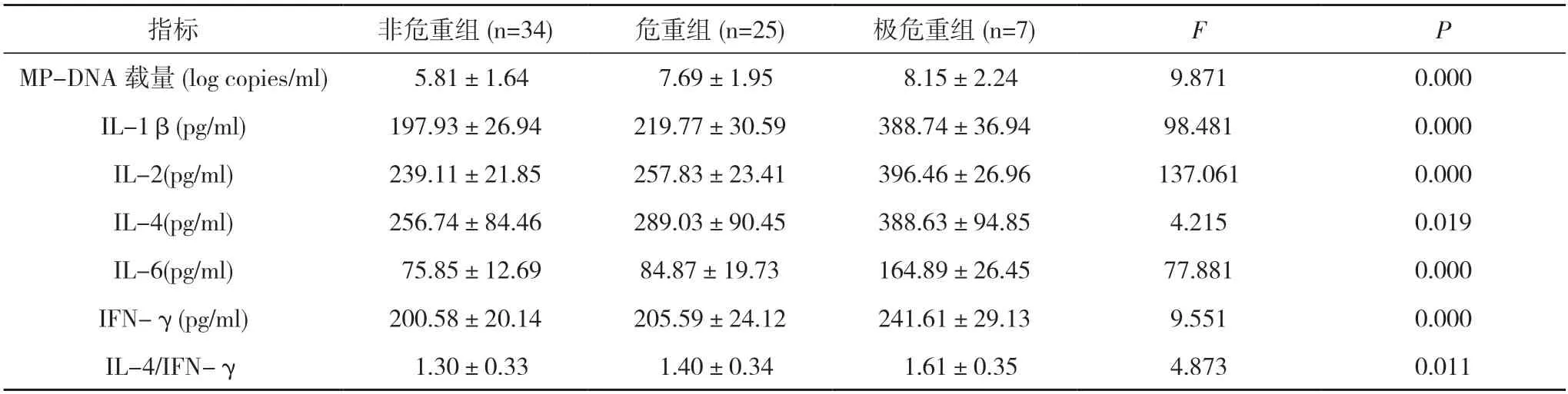
表4 SMPP 组不同危重程度患儿急性期BALF 中炎症细胞因子水平及MP-DNA 载量比较()
注:三组比较,P<0.05
2.4 SMPP 组患儿急性期与恢复期BALF 中炎症细胞因子水平比较 SMPP 组患儿恢复期BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ 和IL-4/IFN-γ均明显低于急性期,差异具有统计学意义(P<0.05)。见表5。
表5 SMPP 组患儿急性期与恢复期BALF 中炎症细胞因子水平比较(,n=66)
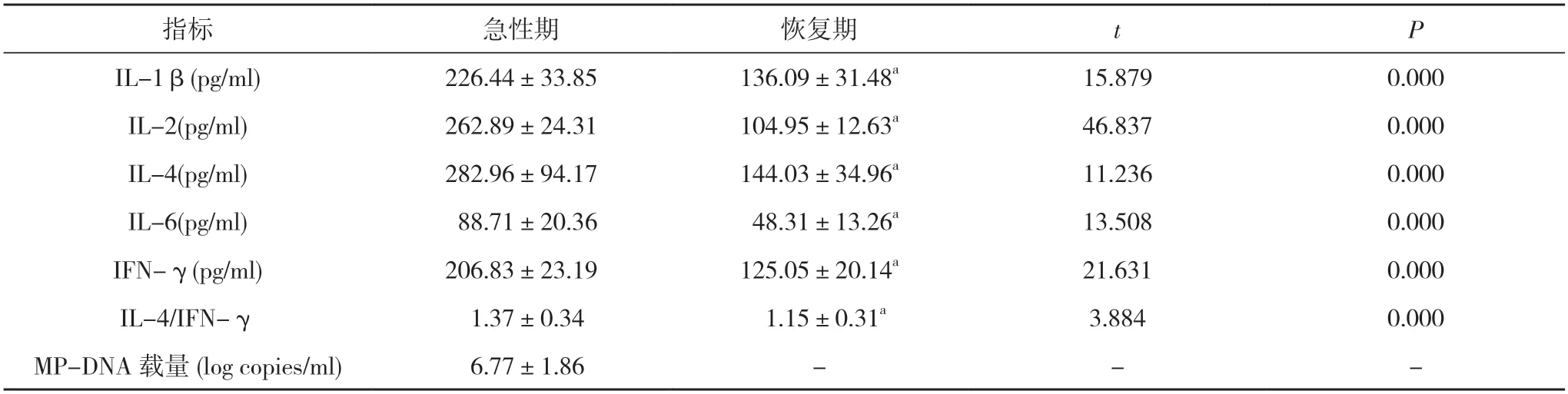
表5 SMPP 组患儿急性期与恢复期BALF 中炎症细胞因子水平比较(,n=66)
注:与急性期比较,aP<0.05
2.5 SMPP 组患儿急性期BALF 中炎症细胞因子与MP-DNA 载量的相关性分析 Pearson 相关性分析显示:SMPP 组患儿急性期BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN-γ 均 与MP-DNA 载量呈显著正相关性(r=0.513、0.402、0.336、0.509、0.502、0.324,P<0.05)。
3 讨论
MPP 的发病机制目前尚不完全明晰,主要认为与上皮细胞吸附、病原直接侵入及免疫学因素等有关,而免疫应答紊乱被认为是MPP 发生及发展的重要因素之一[11]。在MPP 感染初期,因免疫失衡与免疫逃逸等可导致MP 逃避宿主的免疫监视,从而导致病情进展[12]。不同于血液标本,BALF 直接来源于病变周围,能够更为客观、准确、直接地反映感染后呼吸系统免疫紊乱情况[13]。
抗炎与促炎系统平衡情况直接影响肺炎患者的病情变化及临床转归,多种炎性标记物如IL-1β、IL-2、IL-4、IL-6、IFN-γ 等细胞因子被作为评价肺炎病情严重程度的生物指标[14]。IL-2、IL-γ 均是代表性的Th1 细胞因子,可促进自然杀伤(NK)细胞增殖、提高T 细胞杀伤活性,促进机体清除感染源;IL-1β、IL-4、IL-6 均是代表性的Th2 细胞因子,能够刺激B细胞及T 细胞等分化成熟,具有抗炎效应[15]。因此,Th1 和Th2 细胞因子平衡有利于机体防御反应。从理论角度而言,Th1 型细胞因子具有促炎作用,而Th2 细胞因子具有抗炎效应,故两者平衡有利于机体防御反应。但IL-4 等过表达时,可大量激活B 细胞释放免疫球蛋白E(IgE)、免疫球蛋白G1(IgG1)等,诱发喘息症状[16]。IL-6 对于宿主早期炎症反应具有重要调节作用,在细菌感染后数小时内即可达峰,而在非细菌感染中仅在重症感染时有明显增高,故IL-6 过表达也往往提示感染较为严重[17]。研究表明,MMP 急性期呈现Th1/Th2 免疫应答平衡向Th2 应答漂移,这种免疫反应失衡反而加重肺损伤[18]。
本研究结果显示,SMPP 组患儿急性期BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN-γ 均显著高于非SMPP 组,差异具有统计学意义(P<0.05)。提示SMPP 可引起BALF 中多种细胞因子高表达,且呈现Th2 优势表达趋势,这与黄小霏等[19]报道基本相符。分析其原因,MP 感染后肺组织免疫功能紊乱,促炎因子升高,为保护机体免疫平衡,抑炎因子也呈升高趋势,导致细胞因子整体过表达。本研究还显示,SMPP 中MV 组患儿IL-1β 和IL-6 水平明显高于非MV 组,差异具有统计学意义(P<0.05)。提示BALF 中IL-1β 和IL-6 表达越高的SMPP 患儿可能具有更高的呼吸衰竭风险,但其他炎症因子可能对是否发生呼吸衰竭的评估价值有限。进一步采用PCIS 评分进行分组,随着病情加重,BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ 表达水平、IL-4/IFN-γ 值均呈现显著升高趋势,比较差异均具有统计学意义(P<0.05)。提示BALF中炎症细胞因子与SMPP 的病情严重程度有关,检测BALF 中炎症因子有助于评估SMPP 患儿的病情变化。进一步比较SMPP 组急性期与恢复期BALF 中炎症细胞因子表达情况显示,恢复期后IL-1β、IL-2、IL-4、IL-6、IFN-γ 表达明显降低,且IL-4/IFN-γ 比值下降,更趋向平衡。进一步证实在SMPP 患儿中,BALF细胞因子表达情况与病情、转归等均有一定关系,这为临床评估病情和治疗干预提供了一定的理论依据。MP-DNA 载量是评价MP 活动状况的主要指标,本研究中,MV 组患儿BALF 中MP-DNA 载量明显高于非MV 组患儿,且随着病情加重呈显著增高趋势。进一步相关性分析显示,MP-DNA 载量与IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN -γ 均具有显著正相关性(P<0.05),方柯南等[20]研究也获得了类似结论。提示MP-DNA 载量高可能与SMPP 患儿的过度免疫反应有关,但其是否与患儿全身免疫功能亢进的发生及维持有关尚不明确。
综上所述,儿童SMPP 急性期BALF 中MP-DNA 载量越高,BALF 中IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN -γ 越高,且病程中因呼吸衰竭需行MV 的患儿BALF 中MP-DNA 载量及炎症因子水平明显高于无需MV 的患儿。提示检测BALF 中MP-DNA 载量及IL-1β、IL-2、IL-4、IL-6、IFN-γ、IL-4/IFN-γ 等细胞因子水平对病情评估具有一定的指导意义。

