Toll样受体3活化对人脐静脉内皮细胞凋亡的影响及其机制
张 宇,刘雪涛
(河南中医药大学第一附属医院病理科,河南 郑州 450000)
Toll样受体(toll-like receptor,TLR)3是TLR家族成员,可参与识别病毒双链RNA(double-strand RNA,dsRNA)[1-2],在人和小鼠的抗病毒感染过程中发挥着重要作用[3]。WANG等[4]研究了TLR3在西尼罗河病毒感染中的作用,结果发现,TLR3基因缺陷型小鼠外周血中病毒的拷贝数高于野生型小鼠,而神经中枢中病毒的拷贝数低于野生型小鼠,其机制可能为野生型小鼠中西尼罗河病毒通过刺激TLR3诱导血管内皮细胞损伤,破坏血脑屏障,从而促进病毒进入神经中枢。TLR3可损伤血管内皮[5-6],且dsRNA可以诱导脐静脉内皮细胞发生凋亡[7],但机制尚未明确。聚肌胞苷酸[polyriboinosinic:polyribocytidylic acid,Poly (I:C)]是双链RNA的合成类似物,常用于模拟双链RNA病毒对细胞的感染[8]。在哺乳动物中,诱导细胞凋亡的途径主要有外源性途径和内源性途径,外源性途径通过细胞外信号激活细胞内的caspase,内源性途径通过线粒体释放凋亡酶激活因子激活caspase,这些活化的caspase可将细胞内的关键蛋白降解,从而引起细胞凋亡[9]。外源性细胞凋亡途径的受体已经明确的有CD95、肿瘤坏死因子受体1(tumor necrosis factor recepeor 1,TNFR1)、肿瘤坏死因子相关凋亡诱导配体受体 ( tumor necrosis factor-related apoptosis-inducing ligand recepeor,TRAILR) 1[也称死亡受体(death receptor,DR)4]、TRAILR2(也称DR5),以上受体相应的配体分别为CD95配体(CD95 ligand,CD95L)、肿瘤坏死因子(tumor necrosis factor,TNF)-α及肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)[10]。袁明明等[11]研究发现,原发性肝细胞癌细胞中TLR3的表达与凋亡指数呈正相关,与基质金属蛋白酶-2、微血管密度和内皮干细胞数量呈负相关,提示TLR3参与原发性肝细胞癌的发生、发展。目前尚未明确TLR3对血管内皮细胞凋亡的影响及其信号转导机制。基于此,本研究使用Poly (I:C)活化TLR3,探讨TLR3活化对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)凋亡的影响及其细胞外信号转导的分子机制,以期为临床预防和治疗病毒感染所致血管内皮损伤提供理论依据。
1 材料与方法
1.1 细胞、试剂与仪器HUVECs由中南大学肿瘤研究所肿瘤免疫生物实验室提供。达尔伯克改良伊格尔培养基(Dulbeco′s modified Eagle medium,DMEM)、新生小牛血清购自福州海克隆生物制品有限公司,胰蛋白酶、Poly(I:C)购自美国InvivoGen公司,鼠抗人TLR3抗体购自荷兰Hycult Biotechnology公司、鼠抗人caspase-3抗体购自美国Cell Signaling公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠抗体购自美国KPL公司,鼠抗人β-actin抗体购自深圳晶美生物工程有限公司,RNA提取试剂盒及TRIzol试剂购自美国赛默飞世尔科技公司,反转录试剂盒购自加拿大Fermentas公司,Western blot相关试剂均购自上海碧云天生物技术研究所,电化学发光(electrochemiluminescence,ECL)试剂盒购自美国Pierce公司;反转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)仪购自德国Eppendorf公司,紫外凝胶成像系统购自美国Pharmacia公司。本研究所用引物均由上海博尚生物技术有限公司合成。
1.2 实验方法
1.2.1 细胞培养HUVECs培养于含体积分数10%新生小牛血清、100 kU·L-1青霉素、100 kU·L-1链霉素和100 kU·L-1庆大霉素的DMEM中,于37 ℃、饱和湿度、含体积分数5%CO2的细胞培养箱中无菌培养。
1.2.2 细胞分组及处理取对数生长期的 HUVECs 接种于6 孔细胞培养板中,每孔1.0×106个细胞,随机分为A组、B组、C组、D组、E组和F组,分别用含终浓度0.000、0.001、0.010、0.100、1.000、10.000 mg·L-1Poly(I:C)培养基培养24 h备用。
1.2.3 Western blot法检测6组HUVECs中TLR3及pro-caspase-3、caspase-3 P17蛋白相对表达量取6组6孔板中梯度浓度Poly(I:C)培养24 h的细胞,吸去培养液,用预冷的磷酸盐缓冲溶液洗涤3次;每孔加入100 μL细胞裂解液冰上裂解30 min;简短脉冲式超声7~8次,每次2~3 s;将所有蛋白收集于EP管中,100 ℃煮沸5 min,冰上冷却后,4 ℃ 10 000×g离心10 min,取上清液至另一EP管内,置于-20 ℃保存备用。取20 μL蛋白样品,使用聚丙烯酰胺凝胶电泳,电泳后将蛋白转印至硝酸纤维素膜上,用质量分数5%脱脂奶粉室温封闭2 h,加入鼠抗人TLR3一抗(滴度1500)及鼠抗人caspase-3一抗(滴度1400),4 ℃孵育过夜;使用Tris缓冲生理盐水(Tris-buffered saline and tween-20,PBST)于侧摆摇床上缓慢摇动洗涤3次,每次 5~10 min。 加入HRP标记的二抗(滴度11 000),室温孵育1 h,使用PBST洗涤3次,每次 5~10 min。使用ECL试剂显色,应用紫外凝胶成像系统拍照,Image J软件分析各条带灰度值,以目的蛋白灰度值与内参β-actin灰度值的比值表示目的蛋白相对表达量,并计算caspase-3 P17与pro-caspase-3蛋白相对表达量比值(caspase-3 P17/pro-caspase-3)。实验重复3次,取均值。
1.2.4 RT-PCR法检测6组HUVECs中TRAIL、DR4和DR5 mRNA相对表达量收集6组梯度浓度Poly(I:C)培养24 h的细胞,根据RNA提取试剂盒说明书提取总RNA。取2 μg RNA反转录为cDNA,根据反转录试剂盒进行操作。以cDNA为模板,配制20 μL反应体系,于RT-PCR仪上进行扩增。反应体系:2×PCR mix 10 μL,10 μmol·L-1上下游引物各1 μL,cDNA模板1 μL,ddH2O 7 μL。反应条件:95 ℃预变性1 min;95 ℃变性30 s,60 ℃退火30 s,68 ℃延伸1.5 min,30个循环;68 ℃再延伸10 min。 TRAIL上游引物序列为5′-TTCACAGTGCTCCTGCAGTCT-3′,下游引物序列为5′-AGTTTATTTTGCGGCCCAGA-3′;DR4上游引物序列为5′-CAATGGGAACATAGCCCTTTG-3′,下游引物序列为5′-AAACACACCCTGTCCATGCA-3′;DR5上游引物序列为5′-TCTGATCACCCAACAAGCCCT,下游引物序列为5′-ACAATCACCGACCTTGACCA-3′;内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-AATCCCATCACCATCTTCCA,下游引物序列为5′-CCTGCTTCACCACCTTCTTG-3′。将扩增产物进行琼脂糖凝胶电泳,紫外凝胶摄像仪成像,应用Image J 软件分析各目的基因条带灰度值,以目的基因条带灰度值与内参GAPDH灰度值的比值表示目的基因mRNA相对表达量。实验重复3次,取均值。

2 结果
2.1 6组HUVECs中TLR3及pro-caspase-3、caspase-3 P17蛋白相对表达量比较结果见表1、图1和图2。B组、C组、D组、E组、F组细胞中TLR3蛋白相对表达量显著高于A组,C组、D组、E组、F组细胞中TLR3蛋白相对表达量显著高于B组,D组细胞中TLR3蛋白相对表达量显著高于C组,E组、F组细胞中TLR3蛋白相对表达量显著低于D组,F组细胞中TLR3蛋白相对表达量显著低于E组,差异有统计学意义(P<0.05)。
B组、C组细胞中caspase-3 P17/pro-caspase-3显著低于A组,D组、E组、F组细胞中caspase-3 P17/pro-caspase-3显著高于A组、B组、C组,F组细胞中caspase-3 P17/pro-caspase-3显著低于D组、E组,差异有统计学意义(P<0.05)。

表1 6组HUVECs中TLR3蛋白相对表达量及caspase-3 P17/pro-caspase-3比较
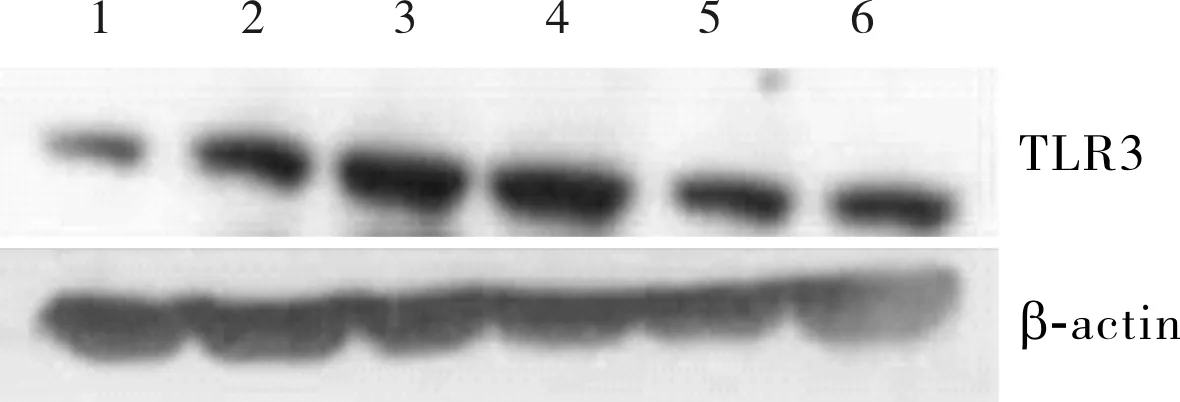
1:A组;2:B组;3:C组;4:D组;5:E组;6:F组。

1:A组;2:B组;3:C组;4:D组;5:E组;6:F组。
2.2 6组HUVECs中TRAIL、DR4、DR5 mRNA相对表达量比较结果见表2和图3。B组、C组、D组、E组、F组细胞中TRAIL mRNA相对表达量显著高于A组,C组、D组、E组、F组细胞中TRAIL mRNA相对表达量显著高于B组,E组、F组细胞中TRAIL mRNA相对表达量显著高于C组和D组,F组细胞中TRAIL mRNA相对表达量显著低于E组,差异有统计学意义(P<0.05);C组与D组细胞中TRAIL mRNA相对表达量比较差异无统计学意义(P>0.05)。
C组、D组、E组、F组细胞中DR4 mRNA相对表达量显著高于A组和B组,D组、E组、F组细胞中DR4 mRNA相对表达量显著高于C组,E组、F组细胞中DR4 mRNA相对表达量显著高于D组,F组细胞中DR4 mRNA相对表达量显著高于E组,差异有统计学意义(P<0.05);A组与B组细胞中DR4 mRNA相对表达量比较差异无统计学意义(P>0.05)。
B组、C组、D组、E组、F组细胞中DR5 mRNA相对表达量显著高于A组,B组、C组、D组细胞中DR5 mRNA相对表达量比较差异无统计学意义(P>0.05);E组、F组细胞中DR5 mRNA相对表达量显著高于B组、C组、D组,差异有统计学意义(P<0.05);E组与F组细胞中DR5 mRNA相对表达量比较差异无统计学意义(P>0.05)。

表2 6组HUVECs中TRAIL、DR4和DR5 mRNA相对表达量比较
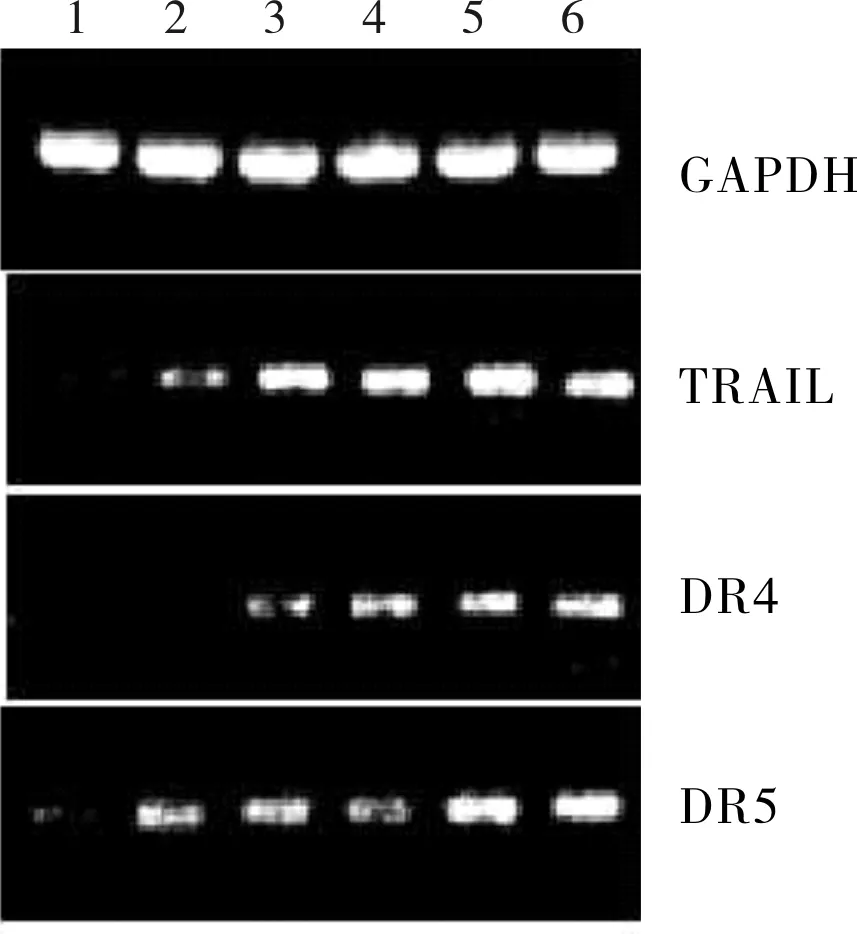
1:A组;2:B组;3:C组;4:D组;5:E组;6:F组。
3 讨论
TLR3主要表达于树突状细胞、吞噬细胞及自然杀伤细胞,参与机体天然免疫[12-13]。此外,TLR3还广泛表达于神经细胞、成纤维细胞及各种上皮细胞[14-16]。有研究显示,TLR3相关通路活化后不仅可以促进免疫相关细胞释放大量的炎症因子如TNF、白细胞介素、前列腺素、一氧化氮,引起炎症反应,同时可造成神经、循环、呼吸、消化等系统组织损伤[17]。有研究发现,Poly(I:C)活化TLR3可诱导乳腺癌细胞、前列腺癌细胞、非小细胞肺癌细胞凋亡,其机制均涉及caspase-3[18-20]。Poly(I:C)活化TLR3还可抑制肾细胞癌细胞增殖[21]。除肿瘤方面,在非肿瘤方面也有不少TLR3与细胞凋亡的相关研究。刘叶等[22]研究发现,过表达TLR3可上调高糖诱导的心肌细胞中miR-186-5p表达,从而抑制心肌细胞凋亡。朱祎婧等[23]研究发现,激活TLR3可通过β干扰素TIR结构域衔接蛋白-核因子-κB信号通路抑制胰岛β细胞增殖、促进细胞凋亡,从而介导细胞损伤。由此可见,TLR3与细胞凋亡的相关研究受到广泛关注,但TLR3涉及的相关凋亡机制目前尚未完全阐明。
TLR3在抗病毒感染中的作用是双面的:一方面TLR3可通过天然免疫和获得性免疫抑制病毒复制、促进病毒清除[3-4],另一方面TLR3可介导血管内皮细胞和其他组织细胞凋亡、损伤,从而介导病毒扩散[5-6]。因此,阐明TLR3诱导细胞凋亡的信号转导机制,就有可能找到TLR3信号转导途径中不影响免疫反应但介导细胞凋亡的关键信号分子,并以此分子为靶点,研究靶向抑制剂,使得在不影响免疫反应的同时预防血管内皮细胞损伤,从而抑制病毒扩散,延缓疾病的发展。
本研究结果发现,B组、C组、D组、E组、F组细胞中TLR3蛋白相对表达量显著高于A组,C组、D组、E组、F组细胞中TLR3蛋白相对表达量显著高于B组,D组细胞中TLR3蛋白相对表达量显著高于C组,说明采用Poly(I:C)干预可活化HUVECs的TLR3表达,且TLR3表达量随着Poly(I:C)干预浓度的升高呈上升趋势。
Caspase 家族是一类独特的半胱氨酸蛋白酶,是哺乳动物凋亡机制的基本组成部分,可作为细胞凋亡或程序性细胞死亡的效应物,其中 caspase-3 是调控凋亡最关键的酶之一[24]。非活性状态的pro-caspase-3和活性状态的cleaved-caspase-3均存在于细胞质中,当pro-caspase-3被剪切为 P17和P12亚基后,可产生活性[25]。本研究结果显示,B组、C组细胞中caspase-3 P17/pro-caspase-3显著低于A组,D组、E组、F组细胞中caspase-3 P17/pro-caspase-3显著高于A组、B组、C组,F组细胞中caspase-3 P17/pro-caspase-3显著低于D组、E组,说明随着Poly(I:C)干预浓度的升高,TLR3表达的增加,caspase-3的活化呈升高趋势,从而可促进HUVECs凋亡。
本研究结果显示,B组、C组、D组、E组、F组细胞中TRAIL mRNA相对表达量显著高于A组,C组、D组、E组、F组细胞中TRAIL mRNA相对表达量显著高于B组,E组、F组细胞中TRAIL mRNA相对表达量显著高于C组和D组,F组细胞中TRAIL mRNA相对表达量显著低于E组;C组、D组、E组、F组细胞中DR4 mRNA相对表达量显著高于A组和B组,D组、E组、F组细胞中DR4 mRNA相对表达量显著高于C组,E组、F组细胞中DR4 mRNA相对表达量显著高于D组,F组细胞中DR4 mRNA相对表达量显著高于E组;B组、C组、D组、E组、F组细胞中DR5 mRNA相对表达量显著高于A组,E组、F组细胞中DR5 mRNA相对表达量显著高于B组、C组、D组,说明随着Poly(I:C)干预浓度的升高,TLR3表达升高可上调HUVECs中TRAIL、DR4、DR5 mRNA的表达,提示Poly(I:C)活化TLR3引起的HUVECs凋亡可能涉及外源性凋亡途径TRAIL-DR4/DR5。
同时,本研究结果发现,E组、F组细胞中TLR3蛋白相对表达量显著低于D组,F组细胞中TLR3蛋白相对表达量显著低于E组;F组细胞中caspase-3 P17/pro-caspase-3显著低于D组、E组;F组细胞中TRAIL mRNA相对表达量显著低于E组,说明TLR3、caspase-3 P17/pro-caspase-3及TRAIL mRNA相对表达量在Poly(I:C)剂量增加到一定浓度时反而有所下降。分析其原因,可能是高剂量Poly(I:C)所致细胞凋亡数量的增多,使蛋白和mRNA的分解增多。另外,本研究中,caspase-3 P17/pro-caspase-3虽然整体是增高趋势,但B组、C组细胞中caspase-3 P17/pro-caspase-3显著低于A组,分析其原因可能是在Poly(I:C)浓度低时pro-caspase-3的合成速度大于裂解活化速度,但随着Poly(I:C)浓度的升高、细胞凋亡增强,pro-caspase-3裂解活化速度大于合成速度,从而导致caspase-3 P17/pro-caspase-3比值呈显著上升趋势,其中的机制将是以后研究的方向。
未来,可进一步研究内源性凋亡途径是否也参与了TLR3诱导的HUVECs凋亡,在TLR3下游、TRAIL、DR4、DR5上游是否存在更核心的凋亡调控分子,如果能够发现更多机制、找到更多有价值的信号转导分子,那么在治疗炎症和肿瘤方面将会得到更多的靶点,为临床治疗疾病提供更多的依据和启发。
综上所述,Poly(I:C)活化TLR3可能引起HUVECs凋亡,其机制可能涉及外源性凋亡途径TRAIL-DR4/DR5,因此在临床治疗工作中,TRAIL、DR4、DR5可以作为有意义的治疗靶点,例如在炎症病变的治疗中,可使用TRAIL、DR4、DR5拮抗剂抑制其活化,减少细胞凋亡的发生,从而降低或避免组织损伤但不影响抗病毒作用,对于延缓或阻止病毒感染具有十分重要的意义;而在肿瘤的治疗中可使用TRAIL、DR4、DR5激动剂,促进血管内皮细胞和肿瘤细胞的凋亡,达到消减肿瘤的作用。

