常规超声联合血清甲胎蛋白评估改良二乙基亚硝胺给药法诱导大鼠肝细胞肝癌模型的可行性
苏天琳,王中会,晁 旭,樊莹莹,黄 峰,杨兵社,
(1.陕西中医药大学医学技术学院,陕西 西安 712046;2.陕西中医药大学基础医学院,陕西 西安 712046;3.陕西中医药大学第二附属医院科研科,陕西 咸阳 712000;4.陕西中医药大学第二附属医院超声科,陕西 咸阳 712000)
世界卫生组织 (World Health Organization,WHO) 2019年报告显示,癌症是世界上绝大多数国家居民70岁前死亡的第一大原因[1]。根据2020年全球185个国家的统计数据,原发性肝癌的发病率和病死率分别位居第6位和第3位,其中肝细胞肝癌(hepatocellular carcinoma,HCC)占原发性肝癌的75%~85%[2]。HCC动物模型可以更好地帮助人们了解HCC的病理机制及其治疗药物的药理机制[3]。目前,HCC的动物建模方法主要包括化学诱导模型、植入模型(同基因和异种移植模型)、病毒模型、遗传模型等。其中化学诱导剂二乙基亚硝胺(diethylnitrosamine,DEN)主要是通过使脱氧核苷酸烷基化以及活性氧的形成诱发HCC[4-6],这种造模方式具有技术简单、发病机制和临床病理接近人类 HCC演变过程的特点,且具有癌细胞分化程度较低、造模成功率高的优点[7-8]。目前,国内外文献中DEN诱导HCC多采用单一剂量给药法,其动物死亡率为33.3%~62.1%[9-13],较高的死亡率难以保证后续实验的样本数量。研究发现,约97.22%的HCC动物造模以病理切片苏木精-伊红(hematoxylin-eosin,HE) 染色作为评估标准,2.78%的HCC动物造模以实体瘤组织形成作为评估标准[14]。但前者进一步损失了实验的样本量,且无法全面了解所有样本的造模情况;后者仅凭瘤体生成作为造模成功标志,缺乏严谨的诊断依据。基于此,本研究采用根据动物体质量变化动态调整DEN剂量的方法诱导HCC,并采用常规超声联合甲胎蛋白(alpha-fetoprotein,AFP)评估造模结果,以期为减少建立HCC动物模型过程中和评估造模结果中的损失动物样本量提供实验方法。
1 材料与方法
1.1 实验动物无特定病原体级Sprague-Dawley(SD)雄性大鼠175只,购自西安交通大学医学部实验动物中心(许可证号:2008-001),体质量120~130(124.4±3.0) g,饲养于陕西中医药大学第二附属医院动物实验室,室温20~22 ℃,相对湿度40%~70%,自由饮食饮水;每周对大鼠进行称重、记录。本研究获得陕西中医药大学实验动物伦理委员会审核批准(编号:SUCMDL20210810001)。
1.2 主要试剂与仪器大鼠肝癌化学诱导剂DEN购自TCL科技集团股份有限公司,AFP酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自上海茁彩生物科技有限公司,40 g·L-1多聚甲醛购自武汉博士德生物工程有限公司,HE染色试剂盒购自上海碧云天生物科技有限公司;TM-STC30001电子天平(精度0.1 g)购自南京汤姆斯衡器有限公司,M7 Series型便携式彩色多普勒超声诊断仪购自深圳迈瑞生物医疗电子股份有限公司(线阵探头,频率9.0 MHz)。
1.3 实验方法
1.3.1 动物分组和造模将SD大鼠适应性饲养1周后随机分为空白对照组(n=8)、对照组(n=69)和模型组(n=98)。对照组大鼠给予单一剂量DEN(50 mg·kg-1)腹腔注射。模型组大鼠给予改良DEN给药法诱导大鼠HCC,即根据体质量变化动态调整DEN给药剂量:初始用药剂量为50 mg·kg-1,然后每周根据体质量变化调整给药剂量:若大鼠体质量未见下降或下降幅度小于每周5 g时,按50 mg·kg-1的剂量给药;若每周大鼠体质量下降5~20 g,则按25 mg·kg-1剂量给药;若大鼠体质量下降超过每周20 g,则暂停给药1周。空白对照组大鼠腹腔注射等量生理盐水。第1~4周每周给药2次,第5~15周每周给药1次,连续给药15周。如果造模过程中大鼠死亡,对其进行解剖并行肝脏病理组织切片。
1.3.2 大鼠肝脏超声检查给药15周后,对存活大鼠行常规超声成像:胸腹部剃毛建立超声窗,100 g·L-1水合氯醛(0.3 mL·100 g-1)腹腔注射麻醉,用高频线阵超声探头对大鼠行上腹部肝脏超声探查,观察肝实质及肝包膜回声、肝内有无结节及结节数目、大小、回声、血流信号等,采集并存储图像。

1.3.4 肝脏大体和组织病理形态观察造模结束后,随机抽取空白对照组(7只)、对照组(14只)、模型组(14只)存活大鼠,禁食12 h,将稀释好的水合氯醛(剂量为 3 g·kg-1)腹腔注射麻醉后颈椎脱臼处死大鼠,剖开大鼠腹腔剥离肝脏并称重,计算肝脏指数,肝脏指数=肝湿重(g)/体质量(g)×100%。观察肝脏大体形态学变化,若肝实质有癌结节,则切取癌结节及癌结节边缘的癌旁组织,大小约0.8 cm×0.8 cm×0.3 cm,置于40 g·L-1多聚甲醛固定液中固定 48 h;若无癌结节,则在肝右叶恒定部位切取组织并固定;所有肝脏组织标本常规固定34 h后置于脱水机中进行梯度脱水,二甲苯透明,石蜡包埋。使用切片机将组织蜡块切成4.0 μm厚的切片,水浴锅中摊平切片并平贴于载玻片,烘干后再梯度脱水,行HE染色,中性树胶封片,光镜下观察并拍照。

2 结果
2.1 3组大鼠死亡率比较造模期间,空白对照组大鼠无死亡,死亡率为0.0%(0/8);对照组大鼠死亡24例,死亡率为34.8%(24/69);模型组大鼠死亡19例,死亡率为19.4%(19/98)。对照组大鼠死亡率显著高于空白对照组,差异有统计学意义(χ2=4.043,P<0.05);模型组与空白对照组大鼠死亡率比较差异无统计学意义(χ2=1.890,P>0.05);模型组大鼠死亡率显著低于对照组,差异有统计学意义(χ2=5.019,P<0.05)。对照组和模型组大鼠死亡都分为2个阶段:第1阶段死亡大鼠解剖未见肝脏癌结节,可见肠管胀气及腹腔少量淡黄色液体,死因是药物的急性不良反应;第2阶段死亡大鼠解剖均见肝脏弥漫结节伴有腹腔出血,死因是肝硬化或肝癌并发腹腔出血。
2.2 3组大鼠肝脏超声检查结果比较不同病理变化肝脏超声检查结果见图1。空白对照组大鼠均未见癌结节或肝硬化表现,超声影像正常。对照组30只、模型组48只大鼠肝脏可见癌结节,癌结节超声检出率分别为66.7%(30/45)、60.8%(48/79);对照组与模型组大鼠的肝脏癌结节超声检出率比较差异无统计学意义(χ2=0.278,P>0.05)。 将对照组与模型组大鼠按肝脏癌结节形状区分:圆形或类圆形71只,不规则形7只;按癌结节回声区分:高回声1只,等回声2只,低回声75只;按癌结节数量区分:单个癌结节32只,多个癌结节46只;按癌结节内是否观察到血流信号区分:可见血流信号5只,未见血流信号73只;按癌结节与正常组织边界是否清晰区分:边界清52只,边界欠清26只。测量大鼠肝脏癌结节的直径为2.5~17.2 mm。对照组4只、模型组7只大鼠可见肝脏回声光点变粗,包膜不光滑,呈肝硬化表现。对照组11只、模型组24只大鼠肝脏未见明显异常。
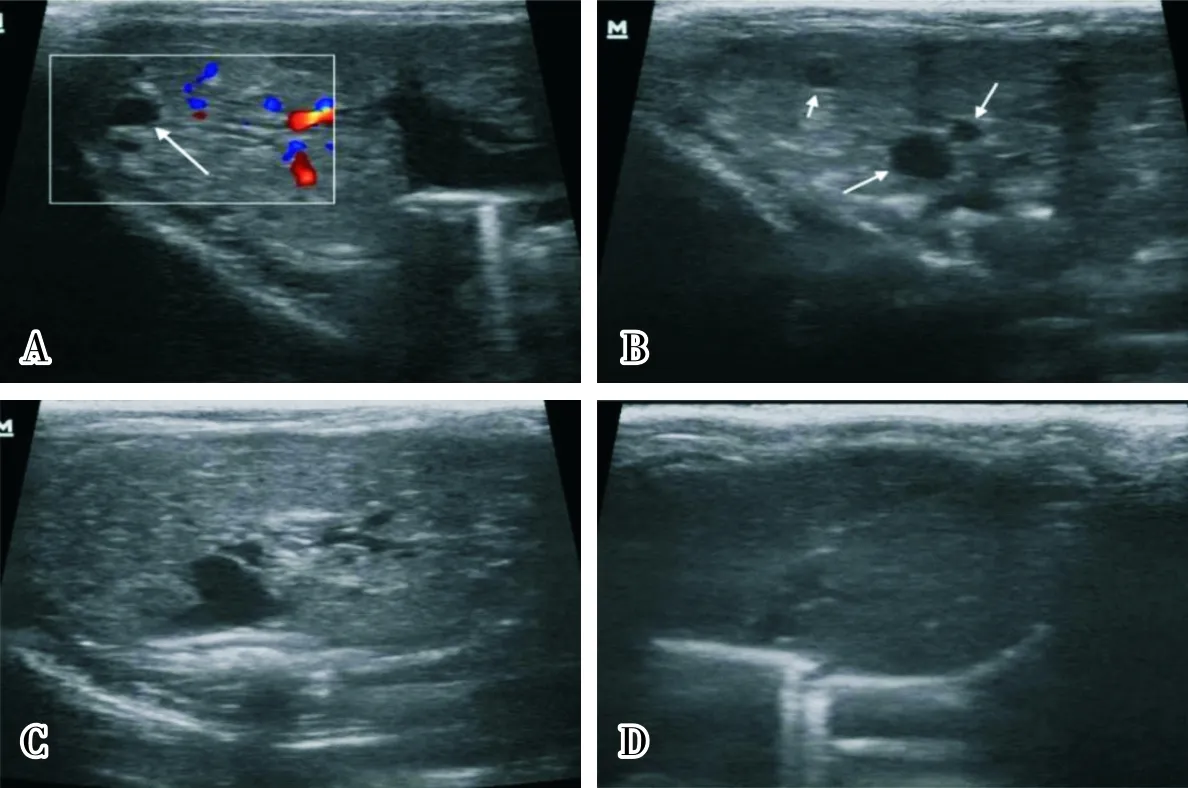
A:肝脏低回声结节CDFI未见血流信号;B:肝脏多发低回声结节;C:肝脏光点变粗,包膜凹凸不平;D:正常肝脏体积较小,光点细腻。
2.3 3组大鼠血清AFP水平比较空白对照组、对照组、模型组大鼠血清AFP水平分别为(0.905±0.143)、(1.633±0.525)、(1.675±0.583)μg·L-1。对照组与模型组大鼠血清AFP水平显著高于空白对照组,差异有统计学意义(t=0.728、0.771,P<0.05);对照组与模型组大鼠血清AFP水平比较差异无统计学意义(t=0.043,P>0.05)。
2.4 超声、血清AFP单独与联合检测对肝脏癌结节诊断敏感度比较对照组和模型组共124只存活大鼠行肝脏超声检查,其中78只大鼠检出肝脏癌结节,超声对肝脏癌结节诊断的敏感度为62.9%(78/124)。弃除血清溶血大鼠,对照组、模型组共86只大鼠进行血清AFP水平检测,将AFP水平转化为二分类资料后,其中AFP阳性50只,阴性36只,血清AFP对肝脏癌结节诊断的敏感度为58.1%(50/86)。86只具有血清AFP值大鼠中,超声阳性且AFP阳性37只,超声阳性且AFP阴性23只,超声阴性且AFP阳性13只,超声阴性且AFP阴性13只;血清AFP联合超声检查对肝脏癌结节诊断的敏感度为87.2% (73/86)。超声与血清AFP对肝脏癌结节诊断的敏感度比较差异无统计学意义(χ2=1.014,P>0.05);血清AFP联合超声检查对肝脏癌结节诊断的敏感度显著高于超声和血清AFP单独检测,差异有统计学意义(χ2=35.342、21.271,P<0.05)。
2.5 3组大鼠肝脏大体观及肝脏指数比较结果见图2和表1。空白对照组大鼠肝脏均表面光滑,颜色红润细腻,未见癌结节;对照组与模型组大鼠肝脏增大、质地变硬,癌结节呈大小不等弥漫性分布,部分癌结节伴出血坏死。对照组与模型组大鼠体质量显著低于空白对照组,肝质量、肝脏指数显著高于空白对照组,差异有统计学意义(P<0.05);对照组与模型组大鼠体质量、肝质量、肝脏指数比较差异无统计学意义(P>0.05)。

A:正常大鼠肝脏;B:HCC大鼠肝脏。

表1 3组大鼠体质量、肝质量及肝脏指数比较
2.6 3组大鼠肝脏病理学改变结果见图3。空白对照组大鼠肝小叶结构清晰,肝细胞索排列整齐,细胞核明显,未见水肿及炎症细胞浸润;对照组和模型组大鼠肝小叶结构不完整,出现假小叶,癌细胞排列成巢状,可见纤维组织增生,部分区域可见局灶性的细胞坏死,癌细胞核大、深染,偶见双核或多核,具有明显的细胞异形性,部分肿瘤细胞侵犯血管。随机抽取的对照组和模型组各14只大鼠均形成HCC癌结节,2组大鼠的成瘤率均为100.0%。

A:正常肝组织(×200);B:正常肝组织(×400);C:HCC肝组织(×200);D:HCC肝组织(×400)。
3 讨论
HCC是一种发病率与病死率较高的恶性肿瘤,且预计HCC的发病率会逐年增加[15-16]。HCC的病因多与肝炎病毒感染、酒精性肝病以及化学致癌物暴露相关[17]。在我国,HCC患者的5 a生存率仅为12.5%[18],因此,寻求针对HCC新的诊疗手段迫在眉睫。DEN是HCC动物造模中经典的化学诱导剂,其通过刺激细胞外基质,导致纤维组织增生,并诱导细胞内自由基的形成而引起氧化应激,导致肝细胞损伤甚至坏死,从而诱发HCC。这种诱导方式的优点与临床发病过程较为相似,都经历肝炎-肝硬化-肝癌3个过程[6-7,19]。目前,国内外文献中DEN诱导HCC造模多使用单一剂量给药法,其成瘤率高、方法简便易行,但死亡率较高[9-13,20-21]。因此,本研究根据大鼠的体质量变化,评估大鼠对DEN毒性和肝脏病变的耐受情况,动态调整给药剂量,尽可能在大鼠的耐受范围内建立HCC模型。本研究结果显示,对照组大鼠死亡率为34.8%,模型组大鼠死亡率为19.4%,模型组大鼠死亡率显著低于对照组;且随机抽取对照组和模型组各14只大鼠行肝脏大体形态学检查,结果显示,对照组与模型组大鼠肝脏增大、质地变硬,结节大小不等弥漫性分布,部分结节伴出血坏死。肝脏病理学检查结果显示,对照组和模型组大鼠肝小叶结构不完整,出现假小叶,癌细胞排列成巢状,可见纤维组织增生,部分区域可见局灶性的细胞坏死,癌细胞核大、深染,偶见双核或多核,具有明显的细胞异形性,部分肿瘤细胞侵犯血管。对照组与模型组大鼠体质量、肝质量、肝脏指数比较差异无统计学意义,2组大鼠的HCC成瘤率均为100.0%。以上结果说明,根据体质量动态调整DEN给药剂量,可在保证HCC成瘤率的基础上降低造模大鼠的死亡率,保证了后续实验的样本数量。
2022版原发肝癌的诊疗指南指出,超声显像具有便捷、实时、无创和无放射辐射等优势,是临床上最常用的肝脏影像学检查方法[22]。血清AFP是当前诊断肝癌和肝癌疗效监测常用且重要的指标。临床常将AFP联合超声作为HCC高危人群筛查与检测的指标,但在动物实验中,将其作为HCC模型评估标准较少。目前,评估动物造模多采用随机抽样进行病理切片作为金标准[14],这损失了实验动物的数量,减少了后续实验的样本量,且无法全面了解所有样本的个体情况。因此,本研究比较了超声、血清AFP单独与联合检测评估HCC造模成功的敏感性,结果显示,超声、血清AFP、超声联合血清AFP对肝脏癌结节诊断的敏感度分别为62.9%(78/124)、58.1%(50/86)、87.2%(73/86),超声与血清AFP对肝脏癌结节诊断的敏感度比较差异无统计学意义,超声联合血清AFP检测对肝脏癌结节诊断的敏感度显著高于超声和血清AFP单独检测,说明超声和血清AFP评估大鼠HCC造模情况均具有一定价值,且超声联合血清AFP检测对大鼠HCC模型评估价值更高。同时,本研究结果显示,HCC大鼠超声成像情况与临床小肝癌成像情况大致相符,病灶以圆形、类圆形低回声病灶为主,边界清晰。临床研究表明,单独应用AFP具有高特异性和低灵敏性的特征,但AFP联合肝脏超声检查可以明显提高检出率,降低假阳性率[3]。一篇纳入373项临床研究的最新文献表明,单独采用AFP作为检测指标(以20 μg·L-1为临界值)的敏感度为 60.0%,单独采用肝脏超声作为检测指标的敏感度为72.0%,AFP联合超声作为检测指标的敏感度为96.0%[24]。本研究中单独使用AFP的敏感度接近临床数值,符合AFP灵敏度低的特点;单独使用超声的敏感度和血清AFP联合超声的敏感度均比临床数据略低;究其原因,可能是由于相较人HCC病灶,大鼠HCC病灶体积较小,更易出现假阴性。但总体而言,血清AFP联合超声检测具有微创、成本低、检查时间短、可重复操作和动态观察等优点,适用于期望减少样本量损失、需了解全部样本造模情况或后续实验中需对造模动物进行连续、动态观察的实验研究,是比较理想的动物HCC造模评估方式。
综上所述,在HCC大鼠建模中,采取根据大鼠体质量变化动态调整DEN给药剂量的方式,能够在保证成瘤率的前提下有效提高大鼠存活率;采用肝脏超声联合AFP检测评估造模结果,具有敏感度高,无需处死动物,可了解全部样本的个体情况并在后续实验中持续、动态观察的优点,从而有效减少造模的成本。

