基于网络药理学探讨加减保和丸防治动脉粥样硬化的作用机制
牛雨晴,秦合伟,*,李彦杰,郭宁,宋雪梅
·信息技术与中医药·
基于网络药理学探讨加减保和丸防治动脉粥样硬化的作用机制
牛雨晴1,秦合伟1,2*,李彦杰2,郭宁1,宋雪梅1
1.河南中医药大学,河南 郑州 450046;2.河南中医药大学第二附属医院,河南 郑州 450002
基于网络药理学探讨加减保和丸防治动脉粥样硬化(AS)的作用机制。通过中药系统药理学数据库与分析平台(TCMSP)及SwissTargetPrediction数据库等获取加减保和丸活性成分及靶点,利用UniProt数据库规范靶点基因名称;借助GeneCards、OMIM、TTD、DrugBank、PharmGKB数据库筛选AS疾病靶点,通过STRING数据库及Cytoscape3.8.2软件构建蛋白相互作用网络,并对交集靶点进行GO功能与KEGG通路富集分析。共筛选出加减保和丸防治AS的活性成分189个及其对应的靶点768个,核心靶点45个。其中CCL2、IL-6、TNF、SERPINE1等与AS的关键靶点相关联,参与炎症反应、细胞增殖、类固醇代谢等生物过程,作用于癌症中的蛋白多糖、类风湿关节炎、乙型肝炎、疟疾及HIF-1、Rap1、IL-17等信号通路。加减保和丸主要成分槲皮素、β-谷甾醇和山柰酚,可能参与调控关键靶点CCL2、IL-6、TNF、SERPINE1,抑制脂多糖和类固醇代谢,调节免疫和炎症反应,保护血管内皮细胞,以防治AS。
动脉粥样硬化;加减保和丸;网络药理学;活性成分
动脉粥样硬化(atherosclerosis,AS)是由多种原因引起的动脉内壁粥样斑块导致的慢性炎症性疾病,涉及血管内皮细胞损伤、慢性炎症、脂质代谢、免疫功能障碍及表观遗传学[1-2]。动脉粥样硬化性心血管疾病仍然是全球血管疾病的主要原因[1],虽然他汀类药物和前蛋白转化酶枯草溶菌素抑制剂能有效降低心血管事件,但是血管炎症的残余风险和药物的不良反应为治疗AS带来了重大挑战[3]。因此,挖掘更有效的治疗方法防治AS并减少不良反应具有重大意义。近年来,中医药治疗AS的研究日益增多,并且取得了一定的疗效。
中医对于AS的认识最早可追溯到《黄帝内经》,其病理机制与高脂血症密切相关,高脂血症可归属于中医学“血浊”范畴,血浊可产生痰、瘀等病理产物,使脉壁变窄、气血不通、脉道阻塞,而形成AS[4]。本课题组既往研究发现,《丹溪心法》经典方保和丸加减可抗炎、调脂和保护血管内皮、抑制AS斑块发展[5],加减保和丸内在成分众多,分子机制复杂,探讨其微观作用关系并对其进行系统阐述具有重要意义[4,6]。本研究采用网络药理学方法探讨加减保和丸防治AS的潜在作用机制,既为前期的实验结果做进一步验证,也为后续研究提供一定的理论基础。
1 资料与方法
1.1 加减保和丸活性成分收集与筛选
加减保和丸由莱菔子、陈皮、清半夏、茯苓、连翘、郁金、枸杞子、三七、山楂、建曲、珍珠、赭石12味药组成。通过中药系统药理学数据库与分析平台(TCMSP,http://www.tcmsp.com/tcmsp.php)[7]检索前8味药的活性成分,获取分子信息,包括活性成分的分子名称、口服生物利用度(OB)、类药性(DL)等。以OB≥30%和DL≥0.18为条件筛选主要活性成分。
1.2 加减保和丸活性成分相关靶蛋白获取
在TCMSP上将获得的活性成分对应相关靶点信息,利用UniProt数据库(https://www.uniprot. org/)和R语言对获得的靶点进行注释规范并获得其对应的基因简称。
对于TCMSP未收录的山楂、建曲、珍珠、赭石,分别从BATMAN-TCM、TCMID、化学数据库及中国知识资源总库查询相关文献获取对应的化合物,然后利用PubChem数据库获得化合物的2D结构,保存为.sdf文件,将其导入SwissADME获得化合物的SMILES号,之后通过SwissTargetPrediction进行靶点预测,获得其对应靶蛋白。最后建立加减保和丸12味药的活性成分和靶蛋白数据库。
1.3 动脉粥样硬化相关靶点预测与筛选
通过GeneCards数据库(http://www.genecards.org/)、OMIM数据库(http://www.omin.org/)、TTD数据库(http://db.idrblab.net/ttd/)、DrugBank数据库(https://go.drugbank.com/)、PharmGKB数据库(https://www.pharmgkb.org/),以“atherosclerosis”为关键词检索AS相关基因及靶点信息,并对5个数据库的基因取交集。
1.4 中药-活性成分-靶点网络构建
使用Cytoscape3.8.2软件构建加减保和丸治疗AS的“中药-活性成分-靶点”网络,根据Degree值对活性成分和靶点进行计算,筛选其中较为重要的活性成分。
1.5 交集基因蛋白相互作用网络构建
用R语言将加减保和丸的活性成分靶蛋白与AS靶蛋白取交集并绘制Venn图。通过STRING数据库(https://string-db.org/),点击“Multiple Proteins”,限定物种为“Homo sapiens”,最小相互作用阈值设定为最高置信度“highest confidence”(>0.4),其余均为默认值,获取交集基因的蛋白相互作用(PPI)网络。通过Cytoscape3.8.2软件对PPI网络进行网络拓扑结构分析,以介度(Betweenness)、紧密度(Closeness)、度(Degree)、特征向量(Eigenvector)、局部平均连通度中心性(Local average connectivity-based,LAC)、网络(Network)进行筛选,选取同时符合6个筛选条件且大于中位数的节点作为加减保和丸防治AS的核心靶点。
1.6 GO功能与KEGG通路富集分析
在Metasacpe平台上,利用R语言及org.Hs.eg.db程序包将交集靶点转换为基因ID;再利用colorspace、stringi、ggplot2、DOSE、clusterProfiler、enrichplot、pathview程序包对核心靶点进行GO功能及KEGG通路富集分析。设置过滤条件为“pvalueFilter=0.05,qvalueFilter=0.05”,GO功能富集分析的生物过程(BP)、细胞成分(CC)、分子功能(MF)按照显著性进行排序,分别选择GO功能富集的前10位和KEGG通路富集的前30条结果绘制柱状图。
2 结果
2.1 加减保和丸活性成分及其对应靶点分析
通过TCMSP和SwissTargetPrediction及相关文献补充检索,以OB≥30%、DL≥0.18为条件筛选,加减保和丸前8味中药共获得127种活性成分,共预测1 506个药物靶点。山楂、珍珠、建曲和赭石共找到153个化学成分,筛选得到62个活性成分,预测出2 198个药物靶点,整理去重后共获得632个对应靶点。将12味药物合并去重,最终共获得189个活性成分,768个交集靶点。加减保和丸所含活性成分的基本信息见表1,共有成分见 表2,前三位分别是槲皮素、山柰酚和β-谷甾醇,可能是加减保和丸防治AS的主要作用成分。枸杞子、三七、山楂、连翘共有成分较多,协作关系最为紧密,可能是治疗AS的重要药对。
2.2 动脉粥样硬化靶点的获取
在GeneCards数据库中,“Relevance score”得分越高,代表该靶点与疾病联系越密切,选取score≥10的目标靶点为AS的潜在靶点。将GeneCards、DrugBank、PharmGKB、OMIM和TTD数据库中的靶点取交集,共获得AS的129个靶点。通过R语言获取加减保和丸中12种药物靶点与AS疾病靶点的交集,共获得45个靶点,分别是ESR1、LDLR、PPARG、APOB、HMGCR、UGT1A1、PPARA、NOS2、MMP9、ADRB1、VEGFA、PON1、MAPK14、TNF、IL-6、CCL2、CYP3A4、ICAM1、CYP1A1、SELE、VCAM1、ALOX5、MYC、NOS3、SERPINE1、ABCG2、UGT2B7、SLC16A1、TLR4、HCAR2、SLC16A3、ACE、CYP2C9、CYP2C19、FGF1、HTR2B、ITGAL、ADORA2A、FGFR1、ALPL、HTR1A、SLC10A1、ITGA2B、F10、SLC15A1,推测加减保和丸可能是通过调节以上靶点防治AS的发生发展。

表1 加减保和丸活性成分及其预测靶点数目(OB≥30%,DL≥0.18)
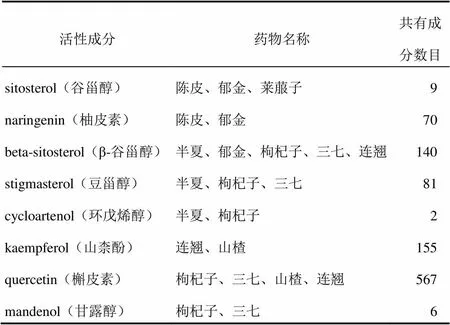
表2 加减保和丸中药共有活性成分及共有成分数目
2.3 加减保和丸成分-AS靶点可视化网络
运用Cytoscape3.8.2软件构建活性成分与AS靶点的可视化网络,节点的大小代表度值,节点越大说明该节点越重要,见图1。结果表明,活性成分中槲皮素(MOL000422)连接度最高,预测槲皮素为加减保和丸治疗AS的主要活性成分,其次为山柰酚(MOL000098)。雌激素受体1(ESR1)为网络中的连接度最高的基因靶点,预测ESR1为加减保和丸调治AS的最主要靶点,过氧化物酶体增殖物激活受体γ(PPARG)、基质金属蛋白酶9(MMP9)、诱导型一氧化氮合酶(NOS2)、羟基羧酸受体2(HCAR2)也是重要的靶点。
2.4 蛋白相互作用网络
将交集基因上传到STRING数据库进行作用关系分析,保存.CSV文件,并构建PPI网络图,如图2。PPI网络中包含49个节点、462条边,平均Degree值为12.6。运用Cytoscape3.8.2软件分析加减保和丸活性成分与AS靶点之间相互作用,根据参数度进行计算并按照中位数进行筛选,得到靶点信息,根据Degree值显示前10个如表3。经过3次筛选,最终得到4个核心基因TNF、CCL2、SERPINE1、IL-6,见图3。
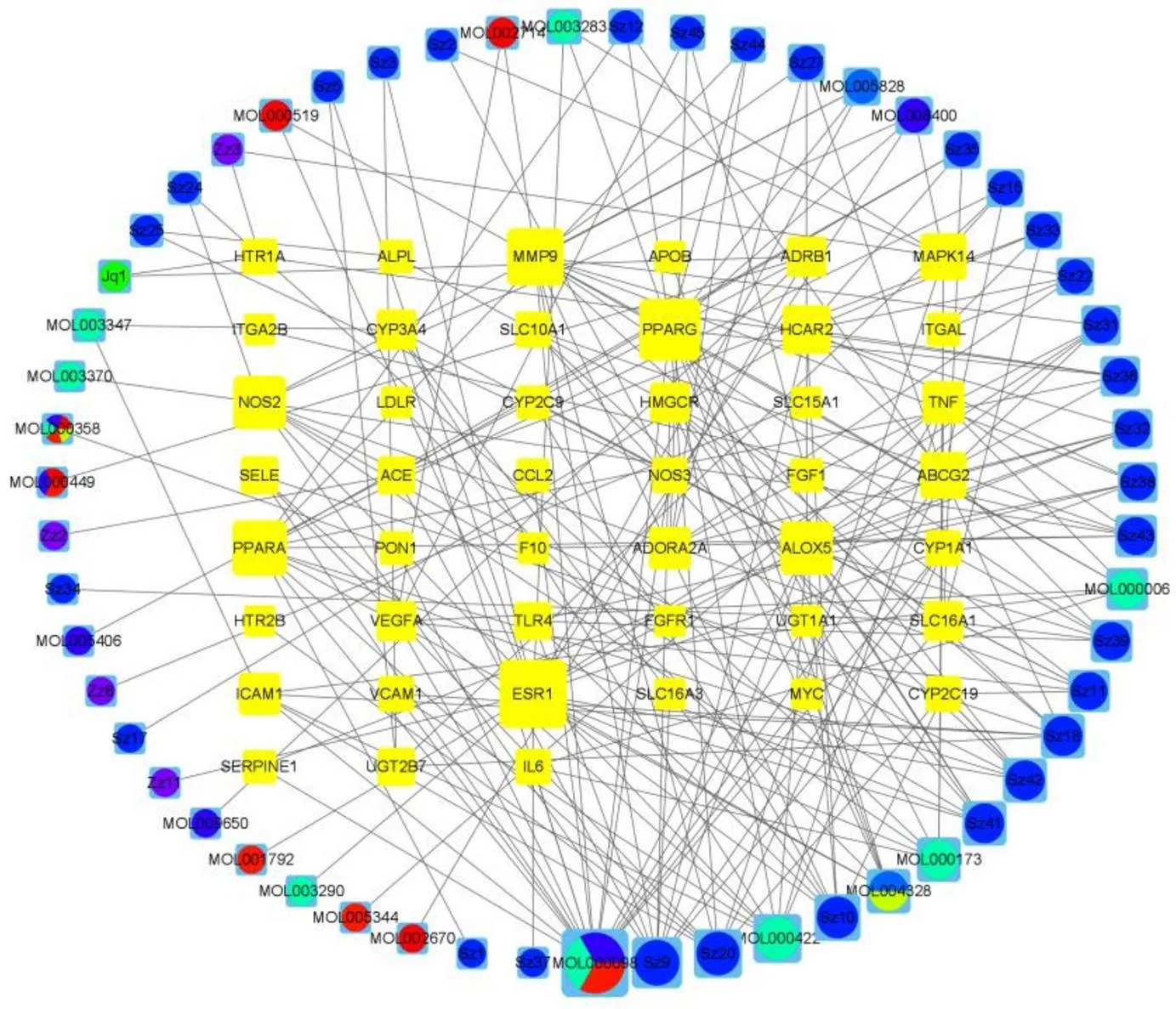
注:不同颜色的圆形节点为不同药物的活性成分;黄色矩形方框为靶点
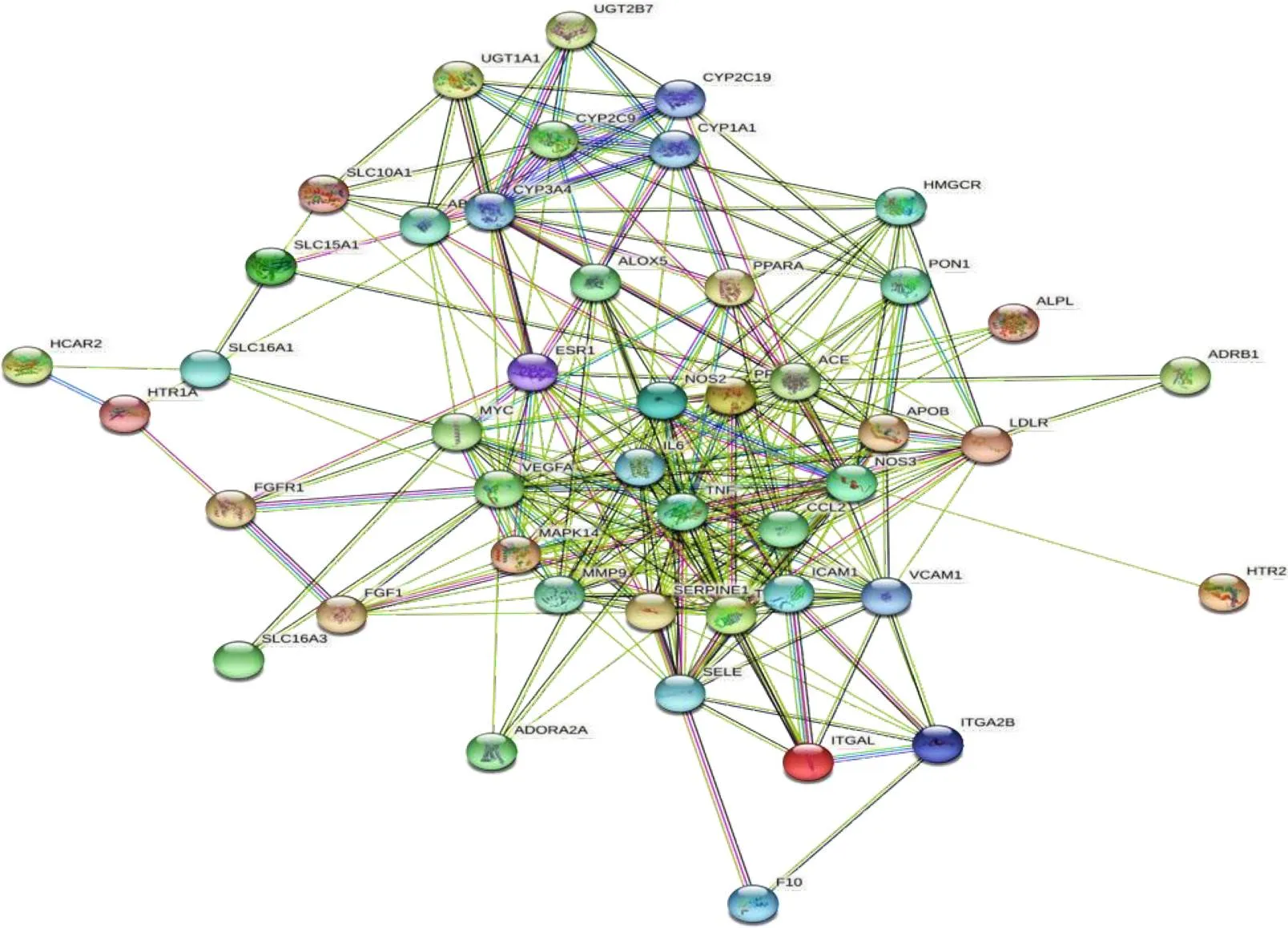
图2 加减保和丸-AS靶点PPI网络
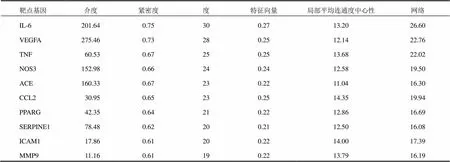
表3 加减保和丸治疗AS靶点PPI网络核心靶点(Degree值前10位)
2.5 GO功能富集分析
将45个交集靶点在Metasacpe平台上进行BP、CC、MF富集分析。结果显示,共得到1 456个富集结果,其中BP、CC、MF分别有1 307、30、119个富集结果。按照“pvalueFilter=0.05,qvalueFilter=0.05”的条件进行过滤,对排名前10的结果进行柱状图展示,纵坐标代表GO条目,横坐标代表基因数目,颜色代表GO富集的显著性,颜色越红代表基因富集越显著,见图4。BP主要涉及类固醇代谢、细胞增殖、炎症反应、营养水平、脂多糖的反应等;CC主要涉及低密度脂蛋白颗粒、血浆脂蛋白颗粒细胞、蛋白质-脂质复合物、血小板α颗粒、质膜外侧等;MF有氧化还原酶活性、单加氧酶活性、类固醇羟化酶活性、花生四烯酸单加氧酶活性、一元羧酸跨膜转运蛋白活性、血红素结合、芳香酶活性等。
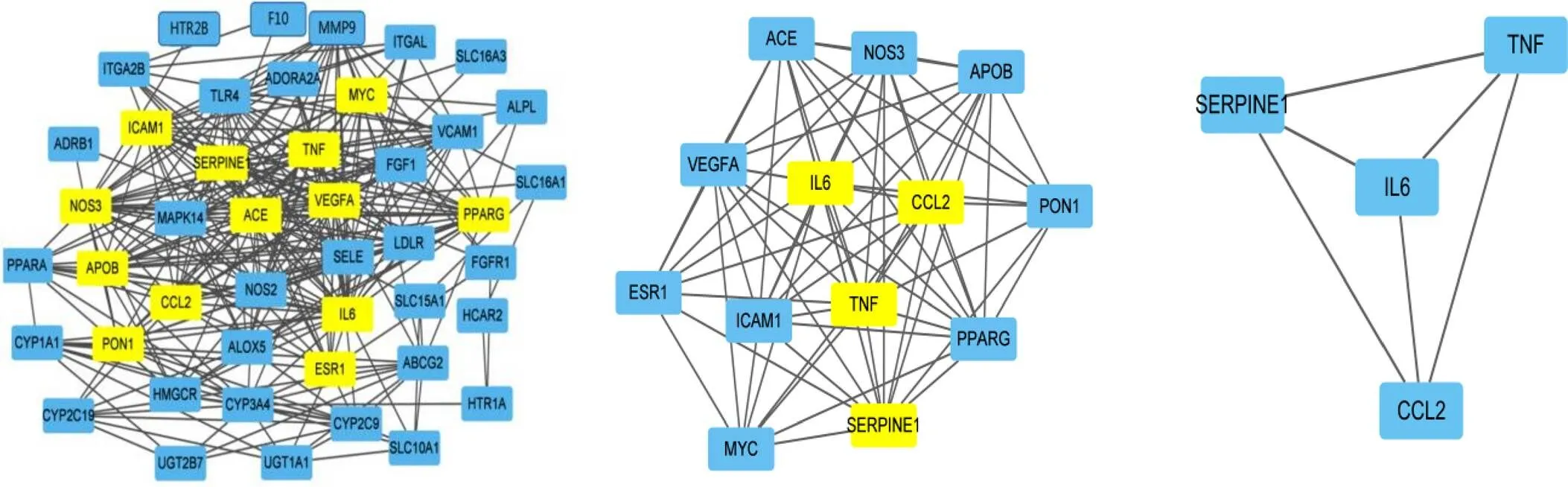
图3 加减保和丸治疗AS靶点PPI网络拓扑分析核心基因
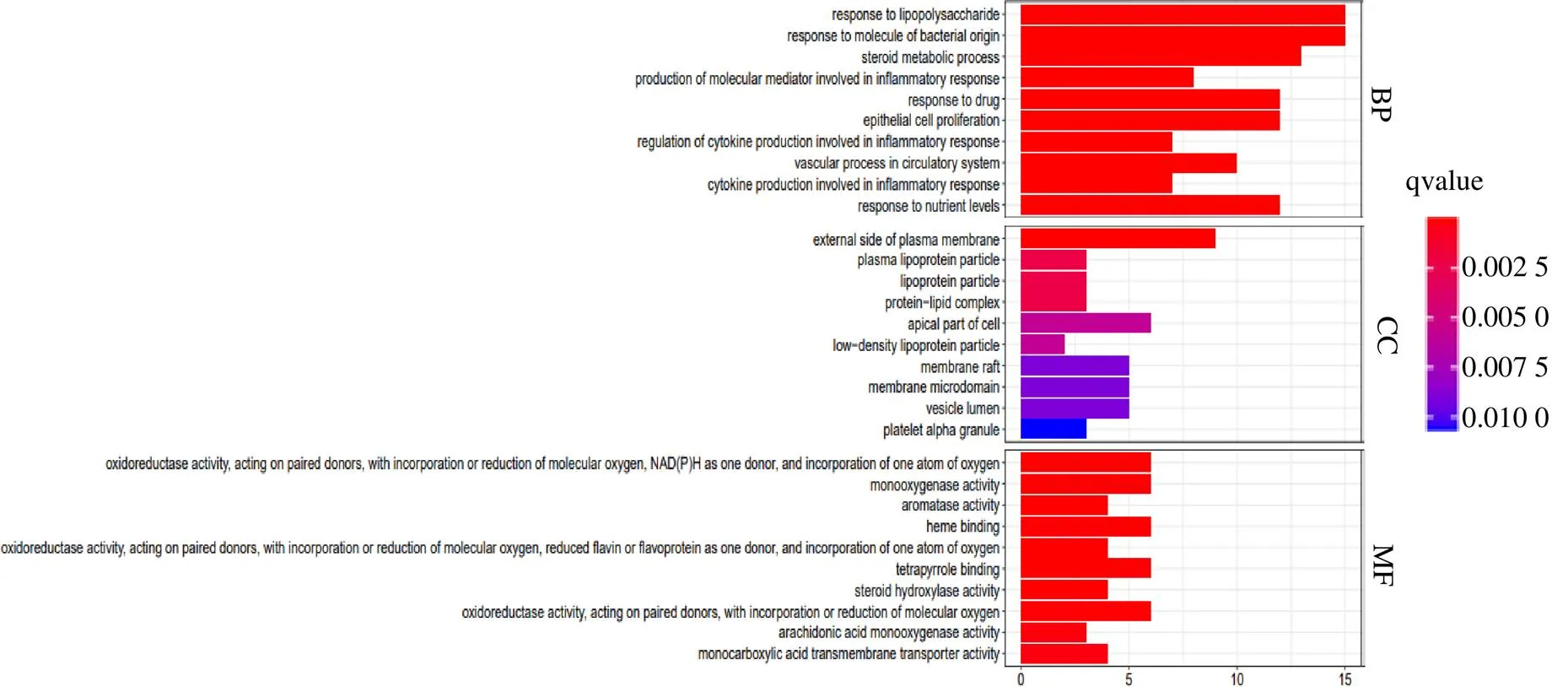
图4 加减保和丸治疗AS靶点GO富集分析
2.6 KEGG通路富集分析
将45个交集靶点在Metasacpe平台上进行KEGG富集分析,获得87条信号通路,按照“pvalueFilter=1,qvalueFilter=1”的条件进行过滤,对其中前30条富集分析结果进行柱状图展示,纵坐标代表通路或疾病的名称,横坐标代表基因数目,颜色代表KEGG富集的显著性,颜色越红代表基因在通路或者疾病上富集越显著,见图5。KEGG富集分析结果显示,核心靶点主要与脂质和动脉粥样硬化、疟疾、流体剪切应力和动脉粥样硬化、类风湿关节炎、癌症中的蛋白多糖、乙型肝炎、胆汁分泌、药物代谢-细胞色素P450、百日咳等疾病有关,以及与糖尿病并发症中的AGE-RAGE信号通路、TNF信号通路、HIF-1信号通路、钙信号通路、Rap1信号通路、IL-17信号通路等密切相关。
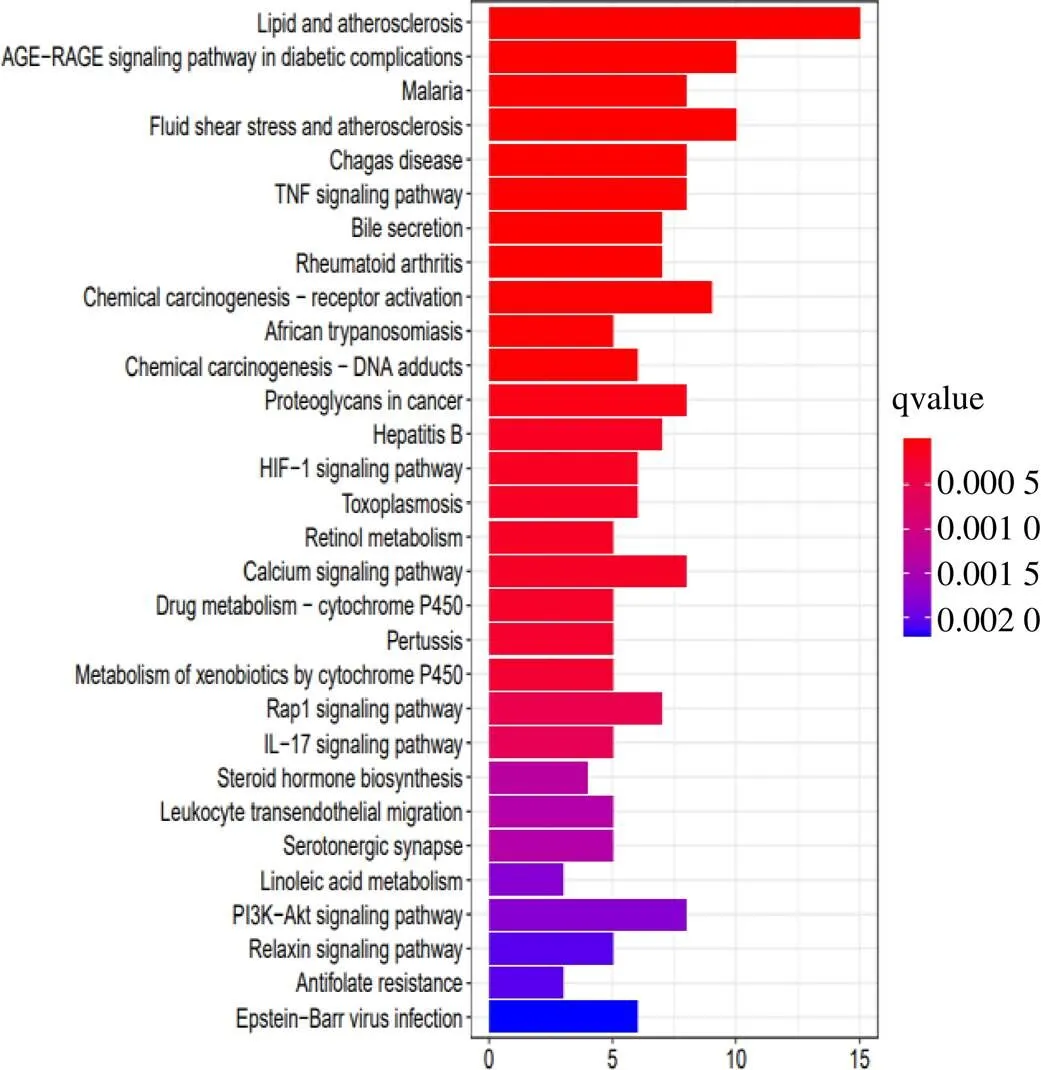
图5 治疗AS靶点KEGG通路富集分析
3 讨论
3.1 加减保和丸药物成分分析
加减保和丸药物成分多,可产生复杂的协同效应,具有作用靶点多、途径广等优势。三七、山楂、半夏、连翘均为临床治疗AS使用频率较高的中药。现代药理研究表明,三七具有抗炎、抗氧化和免疫调节等功效[8],三七总皂苷能降低载脂蛋白E基因敲除小鼠血清氧化低密度脂蛋白(ox-LDL)水平和ox-LDL诱导的黏附因子的表达,从而减轻炎症反应[9]。山楂具有调节血脂代谢、抗氧化、保护心脑血管等功效[10]。AS与胆固醇水平密切相关,张玉颖等[11]发现山楂对低密度脂蛋白受体基因敲除小鼠有显著的降血脂作用。半夏与陈皮等药物合用具有良好的化痰功效,孙亚男等[12]研究发现,半夏的主要成分β-谷甾醇可通过激活PI3K/Akt通路影响下游效应分子活化,发挥调控内皮细胞凋亡的作用。连翘中的连翘苷具有降血脂和抗氧化的作用,周楠茜等[13]发现连翘苷可降低AS模型大鼠IL-1、IL-6水平,增高一氧化氮(NO)、超氧化物歧化酶(SOD)含量,明显降低丙二醛(MDA)含量,以发挥抗炎和抗氧化的作用。槲皮素是一种天然黄酮化合物,具有抗炎、抗过敏和调节脂质代谢等多方面作用,作为加减保和丸多种药物的共有成分,在防治AS的过程中发挥着重要作用。槲皮素可降低ox-LDL引起的泡沫细胞的形成,促进LC3-Ⅱ/LC3-Ⅰ,减少P21和P16的表达,从而起到减少细胞脂质堆积和延迟细胞衰老的作用[14]。山柰酚是一种天然多酚类化合物,具有抗氧化、抗炎、防治AS等多方面的作用。研究表明,山柰酚可通过调节circNOL12/miR-6873-3p/FRS2轴,减轻ox-LDL诱导的人脐静脉内皮细胞炎症、氧化应激和细胞凋亡[15]。综上,可以推断三七、山楂、半夏、连翘的主要有效成分槲皮素、山柰酚等联合应用,可以抗氧化、抗炎和调节脂质代谢,对防治AS具有一定的协同作用且疗效显著。
3.2 靶点功能与通路的富集分析
GO分析结果显示,在AS的发病过程中类固醇代谢、炎症反应和细胞增殖与多种生物过程、细胞组成和分子功能相关。氧化还原酶活性和单加氧酶活性与氧化应激密切相关,氧化应激使活性氧与身体抗氧化防御机制不平衡,大量活性氧(ROS)的存在使内皮细胞膜降解和斑块破裂,斑块中的微血管破裂导致血栓形成[16-17]。炎症反应、脂质代谢、细胞增殖失调、细菌微环境失调是促成AS发生发展的重要因素[18-21],加减保和丸可能通过调节炎症反应、脂质代谢和改善细菌微环境等防治AS。KEGG通路富集分析结果表明,AS、类风湿关节炎、癌症、乙型肝炎、疟疾及众多与免疫、细菌、病毒、炎症相关的疾病可能与AGE-RAGE信号通路、TNF信号通路、HIF-1信号通路、Rap1信号通路、IL-17信号通路等密切相关。AGE-RAGE可激活NADPH氧化酶,生成ROS,造成内皮功能障碍,还能刺激巨噬细胞和其他炎症细胞产生,导致动脉硬化发展和心血管疾病的发生[22]。研究发现,通过定期静脉注射miR-21-3p,可减少AS病变区域并提高AS糖尿病小鼠血清sRAGE水平[23],表明miR-21-3p可能通过促进sRAGE的裂解和抑制RAGE/NADPH氧化酶激活发挥防治AS的作用。缺氧可导致AS等心血管疾病的发生。HIF-1在缺氧条件下被激活,HIF-1在低剪切应力下诱导糖解酶增强内皮细胞的增殖和炎症活化,ApoE-/-小鼠的HIF-1诱导EC特异性基因缺失,可减少动脉的炎症和内皮增殖,表明HIF-1在低剪切应力区域促进炎症和血管功能障碍[24-26]。Rap1的表达水平与心血管事件危险因素呈正相关。有学者研究表明,Rap1可降低由细胞外囊泡(lEV)引起的MP-1和IL-6等炎症细胞因子的表达,lEV的释放可引起内皮功能障碍,而Rap1-lEV存在于人类AS斑块样本中,可通过减少平滑肌细胞(SMC)增殖,限制AS的发展[27]。加减保和丸防治AS可能与调节AGE-RAGE、HIF-1、Rap1信号通路密切相关。
3.3 PPI网络分析
对4个防治AS的核心靶点CCL2、IL-6、TNF、SERPINE1进行分析。CCL2可被lncRNA-CCL2调节,编码单核细胞趋化蛋白1(MCP1),MCP1与AS相关。lncRNA-CCL2可与RNA结合蛋白HNRNPU和IGF2BP2结合,并在IL-1β刺激期间调节CCL2表达水平[28]。CCL2可作用于炎症反应和脂质形成,CCL2的上调可减轻内皮细胞的损伤,改善AS[28-29]。TNF可激活内皮细胞,促使血管黏附因子的黏附,促进AS形成。研究表明,树突状细胞通过肿瘤坏死因子(TNF-α)介导的NF-кB信号通路促进人脐静脉内皮细胞中血管细胞黏附分子-1(VCAM-1)和细胞间黏附分子-1(ICAM-1)等黏附因子的表达,引起内皮细胞活化和血管炎症的产生[30]。IL-6的水平随着免疫系统的老化而升高,这可能是由增加的β2-肾上腺素能受体信号传导和增加的脂肪细胞数量介导有关;IL-6经典信号传导主要涉及JAK/STAT3的激活,参与细胞生长、再生和宿主防御等过程,抑制IL-6的表达、改善线粒体功能,可减少AS发展和衰老过程[31]。这与课题组既往研究化痰祛瘀法中的加减保和丸抗AS可能是靶向调控miR-181影响NF-кB信号通路,降低IL-6等炎症介质,减轻血管内皮损伤的实验结果一致[4]。SERPINE1在内皮细胞中非常丰富,其表达水平升高与血栓和AS形成呈正相关,推测与内皮功能障碍有关[32]。研究表明,他汀类药物可显著降低血浆SERPINE1水平来减缓AS症状[33]。综上所述,加减保和丸的活性成分可能通过调控TNF、CCL2、IL-6、SERPINE1关键靶点发挥抗炎、保护血管内皮作用,防治AS的发生。抑制TNF和降低CCL2、IL-6、SERPINE1表达水平可能是防治AS有效可行的方法。
本研究借助网络药理学分析加减保和丸防治AS的活性成分、关键靶点、信号通路、物质基础和作用机制。结果表明,加减保和丸防治AS可能与调控核心靶点CCL2、IL-6、TNF、SERPINE1AS和AGE-RAGE、HIF-1、Rap1信号通路有关,这与课题组既往动物实验研究结果相一致。TNF抑制剂和降低CCL2、IL-6、SERPINE1表达水平可能为防治AS提供了新的药物研发方向和潜在目标。由于网络药理学方法论的局限性和中药复方组分化学反应的复杂性,本研究仅是以计算机数据分析计算的结果为基础,后续将在此基础上进一步进行动物实验,明确加减保和丸防治AS的分子机制。
[1] Libby P, Ridker P M, Hansson G K. Progress and challenges in translating the biology of atherosclerosis[J]. Nature, 2011,473(7347):317-325.
[2] Kobiyama K, Ley K. Atherosclerosis[J]. Circulation Research, 2018,123(10):1118-1120.
[3] XU S, Kamato D, Little P J, et al. Targeting epigenetics and non-coding RNAs in atherosclerosis: from mechanisms to therapeutics[J]. Pharmacology & Therapeutics, 2019,196:15-43.
[4] 秦合伟,李彦杰,张志鑫,等.化痰祛瘀法通过调控miR-181影响输入蛋白α3/NF-κB通路的抗动脉粥样硬化的研究[J].北京中医药大学学报,2020,43(8):653-660.
[5] 秦合伟,李彦杰,李斯锦.血管软化丸调控CD40-CD40L系统及抗动脉粥样硬化的作用机制研究[J].中华中医药学刊,2019,37(6):1306-1309,1543-1544.
[6] 朱旭,陈丽斌,纪立金.《丹溪心法》之保和丸刍议[J].中华中医药杂志,2019,34(1):265-267.
[7] RU J L, LI P, WANG J A, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014,6(1):13.
[8] 刘耀晨,张铁军,郭海彪,等.三七的研究进展及其质量标志物预测分析[J].中草药,2021,52(9):2733-2745.
[9] 任超,王萍,闫东明,等.三七总皂苷对动脉粥样硬化小鼠的治疗作用[J].中国药理学通报,2018,34(9):1289-1295.
[10] 董嘉琪,陈金鹏,龚苏晓,等.山楂的化学成分、药理作用及质量标志物(Q-Marker)预测[J].中草药,2021,52(9):2801-2818.
[11] 张玉颖,张晾.山楂对低密度脂蛋白受体基因敲除小鼠脂代谢的影响[J].西安交通大学学报(医学版),2014,35(1):120-123.
[12] 孙亚男,黄小波,粱伟,等.陈皮、半夏对动脉粥样硬化小鼠PI3K-Akt通路、SOD、MDA、SA-β-gal水平的影响[J].首都医科大学学报,2018,39(6):805-809.
[13] 周楠茜,李鹏,石卫东,等.连翘苷对动脉粥样硬化模型大鼠的治疗作用及机制研究[J].中药药理与临床,2016,32(3):28-33.
[14] CAO H, JIA Q L, YAN L, et al. Quercetin suppresses the progression of atherosclerosis by regulating MST1-mediated autophagy in ox-LDL-induced RAW264.7 macrophage foam cells[J]. Int J Mol Sci, 2019,20(23):6093.
[15] LI S Z, HAO M H, WU T S, et al. Kaempferol alleviates human endothelial cell injury through circNOL12/miR-6873-3p/FRS2 axis[J]. Biomedicine & Pharmacotherapy, 2021,137:111419.
[16] Kattoor A J, Pothineni N V K, Palagiri D, et al. Oxidative stress in atherosclerosis[J]. Curr Atheroscler Rep, 2017,19(11):42.
[17] Marchio P, Guerra-Ojeda S, Vila J M, et al. Targeting early atherosclerosis: a focus on oxidative stress and inflammation[J]. Oxidative Medicine and Cellular Longevity, 2019(8):1-32.
[18] Bäck M, Yurdagul A J, Tabas I, et al. Inflammation and its resolution in atherosclerosis: mediators and therapeutic opportunities[J]. Nature Reviews Cardiology, 2019,16(7):389-406.
[19] FENG X J, ZHANG L, XU S W, et al. ATP-citrate lyase (ACLY) in lipid metabolism and atherosclerosis: an updated review[J]. Progress in Lipid Research, 2020,77:101006.
[20] Basatemur G L, Jørgensen H F, Clarke M C H, et al. Vascular smooth muscle cells in atherosclerosis[J]. Nature Reviews Cardiology, 2019,16(12):727-744.
[21] Jonsson A L, Bäckhed F. Role of gut microbiota in atherosclerosis[J]. Nature Reviews Cardiology, 2017,14(2):79-87.
[22] Senatus L M, Schmidt A M. The AGE-RAGE axis: implications for age-associated arterial diseases[J]. Frontiers in Genetics, 2017,8:187.
[23] SHAO M Z, YU M Y, ZHAO J, et al. MiR-21-3p regulates AGE/RAGE signalling and improves diabetic atherosclerosis: role of miR-21-3p[J]. Cell Biochemistry and Function, 2020,38(7):965-975.
[24] LIU M X, Galli G, WANG Y L, et al. Novel therapeutic targets for hypoxia-related cardiovascular diseases: the role of HIF-1[J]. Frontiers in Physiology, 2020,11:774.
[25] Jain T, Nikolopoulou E A, XU Q B, et al. Hypoxia inducible factor as a therapeutic target for atherosclerosis[J]. Pharmacology & Therapeutics, 2018,183:22-33.
[26] FENG S, Bowden N, Fragiadaki M, et al. Mechanical activation of hypoxia-inducible factor 1α drives endothelial dysfunction at atheroprone sites[J]. Arterioscler Thromb Vasc Biol, 2017,37(11):2087-2101.
[27] Perdomo L, Vidal-Gómez X, Soleti R, et al. Large extracellular vesicle-associated Rap1 accumulates in atherosclerotic plaques, correlates with vascular risks and is involved in atherosclerosis[J]. Circulation Research, 2020,127(6):747-760.
[28] Khyzha N, Khor M, DiStefano P V, et al. Regulation of CCL2 expression in human vascular endothelial cells by a neighboring divergently transcribed long noncoding RNA[J]. Proceedings of the National Academy of Sciences, 2019,116(33):16410-16419.
[29] Winter C, Silvestre-Roig C, Ortega-Gomez A, et al. Chrono-pharmacological targeting of the CCL2-CCR2 axis ameliorates atherosclerosis[J]. Cell Metabolism, 2018,28(1):175-182.
[30] GAO W, LIU H B, YUAN J, et al. Exosomes derived from mature dendritic cells increase endothelial inflammation and atherosclerosis via membrane TNF-α mediated NF-кB pathway[J]. Journal of Cellular and Molecular Medicine, 2016,20(12):2318-2327.
[31] Tyrrell D J, Goldstein D R. Ageing and atherosclerosis: vascular intrinsic and extrinsic factors and potential role of IL-6[J]. Nature Reviews Cardiology, 2021,18(1):58-68.
[32] McCann J V, XIAO L, Kim D J, et al. Endothelial miR-30c suppresses tumor growth via inhibition of TGF-β-induced Serpine 1[J]. The Journal of Clinical Investigation, 2019,129(4):1654-1670.
[33] Sahebkar A, Catena C, Ray K K, et al. Impact of statin therapy on plasma levels of plasminogen activator inhibitor-1. A systematic review and meta-analysis of randomised controlled trials[J]. Thrombosis and Haemostasis, 2016,116(1):162-171.
Discussion on the Mechanism of Preventing and Treating Atherosclerosis with the ModifiedPills Based on Network Pharmacology
NIU Yu-qing1, QIN He-wei1,2*, LI Yan-jie2, GUO Ning1, SONG Xue-mei1
(1. Henan University of Chinese Medicine, Zhengzhou 450046, China; 2. The Second Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450002, China)
To discover the mechanism of modifiedPills in preventing and treating atherosclerosis (AS) based on network pharmacology.TCMSP and SwissTargetPrediction database were used to obtain the active components and targets in modifiedPills; AS disease targets were screened with the help of GeneCards, OMIM, TTD, DrugBank, PharmGKB databases. Protein -protein interaction network was constructed by STRING database and Cytoscape3.8.2 software. GO function and KEGG pathway enrichment analysis were conducted for the intersection targets.Totally 189 active components contained in the modifiedPills and their corresponding 768 targets and 45 core targets were screened out.Among them, CCL2, IL-6, TNF, SERPINE1, etc. were associated with key targets of AS, involved in biological processes such as inflammation response, cell proliferation, and steroid metabolism, and were involved in proteoglycans in cancer, rheumatoid arthritis, hepatitis B, malaria diseases, and signaling pathways such as HIF-1, Rap1 and IL-17.Quercetin, β-sitosterol and kaempferol are the main components of modifiedPills, which may be involved in regulating the key targets of CCL2, IL-6, TNF, SERPINE1, inhibiting lipopolysaccharide and steroid metabolism, regulating immune and inflammatory responses, and protecting vascular endothelial cells, in order to prevent AS.
atherosclerosis; modifiedPills; network pharmacology; active components
牛雨晴,秦合伟,李彦杰,等.基于网络药理学探讨加减保和丸防治动脉粥样硬化的作用机制[J].中国中医药图书情报杂志,2022,46(4):1-8.
R285.5;R259
A
2095-5707(2022)04-0001-08
10.3969/j.issn.2095-5707.2022.04.001
国家自然科学基金(81704030);河南省科技攻关计划项目(212102310359);河南省中医药科学研究专项重点课题(20-21ZY1023);河南省中医药拔尖人才培养项目(豫卫中医函[2021]15号);中原英才计划-中原青年拔尖人才资助(豫组通[2021]44号)
牛雨晴,E-mail: niuyuqing2020@126.com
通讯作者:秦合伟,E-mail: qinhewei2012@126.com
(2021-11-02)
(2021-12-06;编辑:魏民)

