急性心肌梗死病人经急诊PCI治疗后发生心肌内出血的危险因素
李浩然,陈雪瑾,祁春梅
急性心肌梗死(acute myocardial infarction,AMI)是一种威胁人类生命的疾病[1]。AMI病人目前推荐的治疗方法是通过经皮冠状动脉介入(percutaneous coronary intervention,PCI)联合抗血栓形成治疗来进行冠状动脉血运重建[2-3]。但是,PCI和抗血栓治疗可导致其他损伤,例如微血管损伤/再灌注性心律失常、心肌顿抑等。微血管损伤也被称为“无复流”现象,包括心脏磁共振(cardiovascular magnetic resonance,CMR)显示的微血管阻塞(microvascular obstruction,MVO)和心肌内出血(intramyocardial hemorrhage,IMH),成功进行PCI后的病人IMH发生率高达40%[4-6]。恢复梗死或缺血性心肌的血流导致了微血管水平的超微结构和功能改变,包括血小板聚集、炎症反应、MVO和缺血再灌注损伤[7]。研究表明,这些微血管损伤区域主要包括微血管破坏区域,但也有广泛的红细胞外渗,即再灌注诱导的IMH[8]。
虽然微血管损伤与IMH密切相关,但目前尚不清楚是哪些因素导致了微血管损伤病人发生IMH[9]。目前的研究已将IMH的存在与仅存在MVO相比具有更大梗死面积且左心室功能恢复较差的问题联系起来[10-11]。本研究以CMR为参考标准,评估AMI病人PCI后IMH的发生率,分析实验室指标与IMH发生的相关性。
1 资料与方法
1.1 一般资料 连续选取2019年9月—2020年9月于徐州医科大学附属医院成功行急诊PCI治疗的AMI病人147例,所有病人均在症状发作后12 h内完成急诊PCI,其中男122例,女25例,均符合美国心脏协会(AHA)关于AMI的诊断标准[12]。排除标准:发病12 h内未行PCI治疗的AMI病人;肾小球滤过率<30 mL/(min·1.73 m2);CMR禁忌证(如心脏起搏器、幽闭恐惧症等);血流动力学不稳定不能获得CMR等。本研究经徐州医科大学附属医院医学伦理委员会审核批准,且病人及其家属对本研究知情并签署知情同意书。
1.2 方法 所有入选病人均在徐州医科大学附属医院行急诊PCI治疗。入院时采集一般资料,住院期间完善生化检查,待病情稳定后行CMR检查(CMR平扫+增强)。
1.3 数据收集
1.3.1 实验室检查指标 病人入院后第1次抽取静脉血测得心肌酶水平[包括乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、超敏肌钙蛋白T(hs-TnT)]为起始值,每24 h测定1次心肌酶水平,取各指标最高值为峰值。病人入院每24 h检测1次N末端B型利钠肽原(NT-proBNP)水平,取最高值为NT-proBNP峰值。
1.3.2 磁共振检查 所有病人均于PCI术后7 d内接受3.0T磁共振检查,平均时间为5.52 d。具体方法:所有病人取仰卧位,采用3.0T全身扫描仪,18元体相控阵螺旋线圈。使用制造商的标准心电图触发装置和屏气技术分别监测个体的心电值和呼吸。使用切片厚度为8 mm的TrueFISP序列获得标准的2室、3室和4室电影图像。钆对比剂(钆喷酸葡胺注射液,以0.1 mL/kg体重注射),10~15 min,重复时间(TR)/回波时间(TE) 512/1.24 ms;视场(FOV)380 mm×320 mm;翻转角度40°。两位经验丰富的放射科医生对临床信息不知情,通过CMR T2加权电影序列显影检查判断病人是否存在IMH,详见图1。

图1 CMR T2加权电影序列显影
1.4 分组 根据CMR检查结果,将病人分为2组:IMH组和无IMH组。
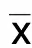
2 结 果
2.1 有IMH组与无IMH组临床资料比较 共入选147例病人,30例(20%)出现IMH。两组性别、年龄、体质指数(BMI)、心率、收缩压、舒张压、血糖、高血压、糖尿病、高脂血症、吸烟、缺血持续时间、心肌梗死溶栓试验(TIMI)血流分级、Killip分级、病变血管类型、病变血管数量、梗死类型、中性粒细胞/淋巴细胞比值(NLR)比较,差异均无统计学意义(P>0.05)。IMH组LDH、CK、CK-MB、hs-TnT、NT-proBNP水平均明显高于无IMH组,差异均有统计学意义(P<0.05)。详见表1。
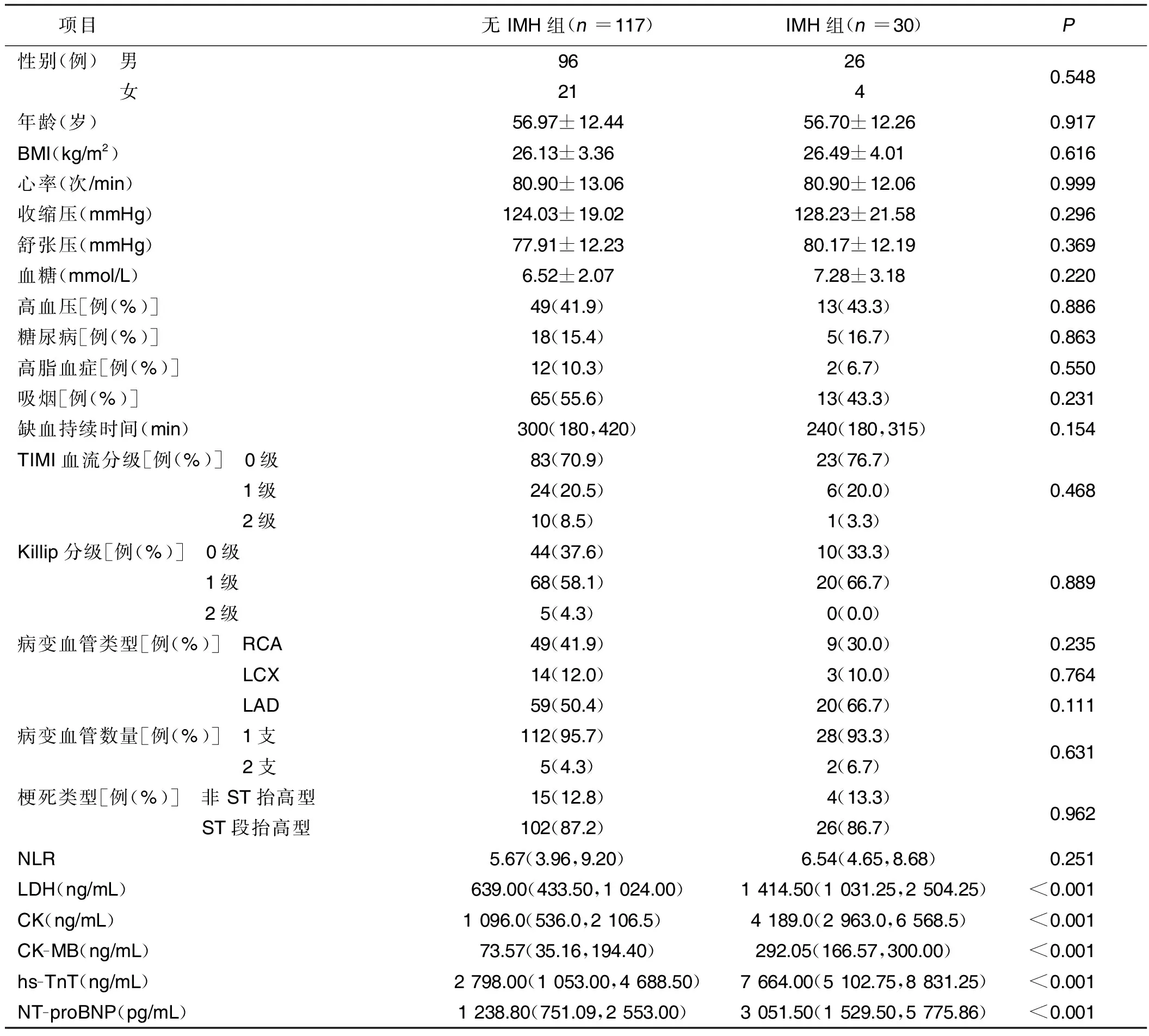
表1 IMH组与无IMH组临床资料比较
2.2 影响病人发生IMH的Logistic回归分析 以病人是否发生IMH为因变量(是=1,否=0),以取自然对数之后的LDH、CK、CK-MB、hs-TnT、NT-proBNP为自变量,采用条件向前法建立二元Logistic回归模型。结果显示,CK、NT-proBNP均为影响病人发生IMH的危险因素。即CK每增加1个自然对数单位,病人发生IMH的风险增加4.681倍;NT-proBNP每增加1个自然对数单位,病人发生IMH的风险增加0.853倍。详见表2。

表2 影响病人发生IMH的Logistic回归分析
2.3 CK、NT-proBNP预测IMH的ROC曲线分析 由ROC曲线可知,CK、NT-proBNP预测IMH的曲线下面积分别为0.864,0.742(P均<0.05),说明二者对IMH均有一定预测价值。CK预测心肌出血的截断值为2 262 ng/mL,对应灵敏度和特异度分别为90.0%、77.8%。NT-proBNP预测心肌出血的截断值为2 442 pg/mL,对应灵敏度和特异度分别为66.7%、74.4%。 详见图2。

图2 CK、NT-proBNP预测IMH的ROC曲线
3 讨 论
尽管CMR尚未被确立为指导AMI病人治疗的常规方法,但能提供重要的病理生理学见解和预后信息。CMR成像可以很好地显示和量化梗死特征,包括梗死大小、MVO和IMH。在晚期增强CMR成像中,造影后可通过高强化评估梗死心肌,MVO可被视为高强化区域内的低信号核心。在T2加权CMR成像上,高强度水肿性心肌梗死内的低信号核心被认为反映了由血红蛋白分解产物顺磁效应引起的IMH[13]。本研究发现,AMI病人经急诊PCI治疗后,20%的病人发生IMH。既往研究表明,50%的ST段抬高型心肌梗死(STEMI)病人有晚期钆增强心脏磁共振成像(MRI)显示高强化核心内的低强化区域[14],24%~29%存在IMH病变[15]。IMH常发生在AMI成功再灌注后,并与更广泛的心肌坏死有关,是在经过一段时间的严重缺血后再灌注治疗导致微血管损伤引起的,其特征是内皮细胞肿胀和内皮内膜间隙。损伤的微血管再灌注引起红细胞外渗,损害心肌细胞,导致不利的心脏重构。有研究纳入了114例病人,观察到IMH病人在STEMI后的第1年出现较高的不良事件发生率[16]。Carrick等[17]对245例AMI病人进行了前瞻性研究,干预后6个月随访,以判断MVO和IMH的预后评估价值,得出IMH的发生在预后评估方面比MVO更重要。因此,IMH的发现有可能识别出不良结局风险大的人群,并作为评估AMI新治疗策略的治疗靶点。
本研究发现,IMH组LDH、CK、CK-MB、hs-TnT、NT-proBNP水平均明显高于无IMH组。高CK、NT-proBNP峰值对IMH发生有一定预测价值。但目前仍没有特定的基线参数能准确预测IMH的发生。国外有研究表明,LAD梗死、心肌梗死后病变血管血流差、发病时血糖水平高、ST段抬高后回落时间长、心肌标志物[如CK、CK-MB和脑钠肽(BNP)峰值等]水平升高和IMH风险增加之间存在相关性[18-19]。有研究表明,心肌梗死后水肿面积与CK水平存在正相关[20]。
本研究的局限性:首先,为单中心研究,样本量相对较小,临床数据采集可能存在缺陷,可能会影响统计分析的准确性和有效性。第二,本研究纳入的病例为AMI病人,包括STEMI及非ST段抬高型心肌梗死(NSTEMI)病人,未进一步分组探讨不同类型心肌梗死IMH的危险因素。最后,由于CMR方法的扫描特征限制,无法确定准确的对应切片来比较不同序列上的病灶。因此,应开展大样本、多中心的前瞻性研究,也应开展更多的基础研究,进一步探讨IMH的病理生理机制。
综上所述,CK、NT-proBNP是IMH发生的影响因素,急诊PCI治疗后高CK、NT-proBNP峰值对发生IMH有预测价值,对临床工作有一定启示。但由于本研究样本量较小,临床资料收集可能存在缺陷,仍需进一步完善。

