富马酸替诺福韦酯与恩替卡韦治疗慢性乙型肝炎的疗效及其对炎症因子的影响
李君,邓旭平,王晨
(马鞍山市人民医院感染性疾病科,安徽 马鞍山 243000)
据统计,全球慢性乙型肝炎病毒(HBV)感染者约2.57亿,每年因HBV感染相关疾病死亡人数高达几十万[1]。我国慢性HBV感染者约7 000万,其中慢性乙型肝炎(CHB)人数为2 000~3 000万,防治形势严峻[2]。目前,抗病毒治疗是临床干预CHB的关键策略,富马酸替诺福韦酯(TDF)与恩替卡韦(ETV)是临床推荐的一线CHB治疗药物,二者均属于核苷酸类药物,可在HBV逆转录酶结合位点与天然核苷发生竞争性结合,从而抑制HBV-DNA复制[3]。既往研究[4]显示,TDF、ETV耐药性均较低,可有效改善肝脏组织学,降低肝癌发生风险。但由于CHB患者基数大、治疗周期长,选择更有效、安全、经济的CHB治疗药物可使广大患者受益,目前已成为临床关注的重点。基于此,本研究拟探讨TDF与ETV治疗CHB的疗效及其对炎症因子的影响。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年1月马鞍山市人民医院收治的CHB患者120例,按治疗方案不同分为TDF组与ETV组,每组各60例。纳入标准:(1)年龄≥18岁;(2)符合CHB临床诊断标准[5];(3)首次采用TDF、ETV治疗;(4)可按医嘱坚持服药及定期复查。排除标准:(1)合并其他肝炎病毒及人体免疫缺陷病毒(HIV)感染者;(2)患有严重器质性病变或自身免疫系统疾病者;(3)合并肝硬化、肝癌、药物性肝损害、酒精性肝病者;(4)既往有抗HBV治疗史者。本研究已通过医学伦理委员会批准,且所有患者均签署知情同意书。两组性别、年龄、病程、CHB家族史、肝功能分级等一般资料比较差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较
1.2 方法
(1)TDF组口服富马酸替诺福韦二吡呋酯片 [葛兰素史克(天津)有限公司] 治疗,用法用量:空腹或随餐服用,300 mg/次,1次/d,连续服用48周。(2)ETV组口服恩替卡韦片(中美上海施贵宝制药有限公司)治疗,用法用量:空腹服用,0.5 mg/次,1次/d,连续服用48周。治疗期间,禁止使用其他抗HBV药物与免疫调节药物,治疗后12、24及48周入院复查1次。
1.3 观察指标
(1)抗病毒疗效:包括HBV-DNA转阴率、乙型肝炎e抗原(HBeAg)血清学转换率、丙氨酸氨基转移酶(ALT)复常率。(2)HBV-DNA水平:于治疗前及治疗后12、24、48周,采用实时定量聚合酶链反应法定量检测HBV-DNA水平。(3)肝功能:于治疗前及治疗后12、24、48周,采用全自动生化分析仪检测血清中ALT、天门冬氨酸氨基转氨酶(AST)、总胆红素(TbiL)、白蛋白(ALB)水平,同时采用肝脏弹性超声检测肝脏硬度。(4)炎症因子:于治疗前、治疗后48周,采用酶联免疫吸附法检测血清肿瘤坏死因子-α(TNF-α)、白细胞介素-17(IL-17)、IL-22表达水平。(5)不良反应发生情况。
1.4 统计学分析
2 结果
2.1 抗病毒疗效比较
治疗后12、24、48周,两组HBeAg血清学转换率、ALT复常率比较,差异无统计学意义(P>0.05);治疗后48周,TDF组HBV-DNA转阴率高于ETV组(P<0.05)。见表2。
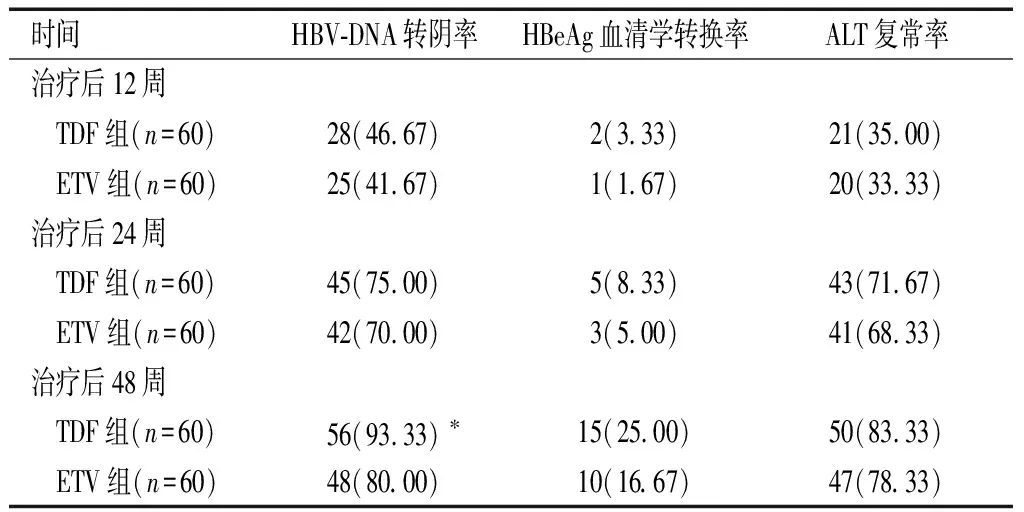
表2 两组抗病毒疗效比较[n(%)]
2.2 HBV-DNA水平比较
治疗前,两组HBV-DNA水平比较,差异无统计学意义(P>0.05)。治疗后12、24、48周,两组HBV-DNA水平降低(P<0.05);且治疗后48周,TDF组低于ETV组(P<0.05)。见表3。
表3 两组HBV-DNA水平比较
2.3 肝功能比较
治疗前,两组血清ALT、AST、TBiL、ALB水平及肝脏硬度比较,差异均无统计学意义(P>0.05)。治疗后12、24、48周,两组血清ALT、AST、TBiL、肝脏硬度降低(P<0.05),ALB水平升高(P<0.05);治疗后48周,TDF组血清ALT、AST及肝脏硬度低于ETV组(P<0.05)。见表4。
表4 两组治疗前后肝脏相关指标比较
2.4 炎症因子水平比较
治疗前,两组血清TNF-α、IL-17、IL-22水平比较,差异无统计学意义(P>0.05);治疗后48周,两组血清TNF-α、IL-17、IL-22水平降低(P<0.05),且TDF组低于ETV组(P<0.05)。见表5。
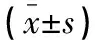
表5 两组治疗前后炎症因子水平比较
2.5 不良反应比较
两组均未发生严重不良反应,且总不良反应发生率比较,差异无统计学意义(χ2=0.686,P=0.408)。见表6。
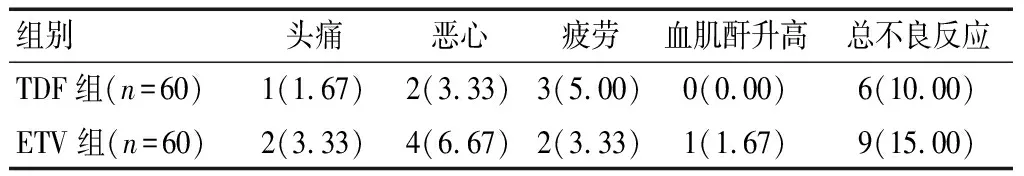
表6 两组不良反应发生率比较[n(%)]
3 讨论
CHB是由HBV持续感染引起的,HBV属于双链环状DNA病毒,由编码病毒聚合酶、HBsAg、HBcAg、HBeAg及HBx蛋白的基因组构成,全长约3.2 kb。HBV有较强的抵抗力,可侵入肝细胞,并以负链DNA为模板整合到宿主基因中,从而导致HBV持续感染[6-7]。既往研究[8]显示,在未进行抗病毒干预的情况下,CHB发展为肝硬化的年发生率为2%~10%,由肝硬化代偿期进展为失代偿期的年发生率为3%~5%,而失代偿期肝硬化患者5年生存率仅有14%~35%;此外,HBV感染者患肝细胞癌的风险较高,严重威胁人类生命健康。
CHB的治疗目标为:最大限度长期抑制HBV复制,减轻肝细胞炎症反应及肝纤维化,延缓或减少肝硬化、肝衰竭、肝细胞癌等的发生,同时提高患者生命质量[9]。因此,CHB的核心环节为抗病毒治疗。目前,国内已批准上市的抗HBV药物分为两大类,一类是核苷酸类似物(NAs),主要包括TDF、ETV、拉米夫定、替比夫定、阿德福韦酯等;另一类是干扰素-α(INF-α),包括普通INF-α、Peg-INF-α[10]。其中NAs抗HBV机制为与天然核苷酸竞争性结合HBV聚合酶位点,从而降低HBV聚合酶活性,抑制HBV-DNA链的延伸及合成[11]。2019版中国CHB防治指南[5]将TDF、ETV作为首选抗HBV治疗药物,但何种药物更有优势,尚未有定论。HBV-DNA转阴率、HBeAg血清学转换率、ALT复常率是临床评估抗HBV疗效的主要指标。本研究显示,治疗后48周,TDF组HBV-DNA转阴率高于ETV组,HBV-DNA水平显著低于ETV组,表明TDF、ETV的短期抗HBV效果相近,可能TDF的长期疗效更好。既往多项研究[12-13]发现,TDF的病毒学应答率随着治疗时间的延长而逐渐升高,也说明TDF具有更好的长期疗效。
本研究显示,与治疗前相比,治疗后12、24、48周两组血清ALT、AST、TBiL、ALB水平及肝脏硬度显著降低,且治疗后48周TDF组血清ALT、AST、肝脏硬度值低于ETV组,表明二者均能有效改善CHB患者肝功能,其中TDF的长期效果更好。目前,临床对TDF、ETV治疗CHB的研究存在两种观点,一种是二者临床疗效、安全性无差异[14];第二种是TDF的长期疗效及用药成本优于ETV[15]。肝细胞炎症坏死是CHB的主要病理性特征,近年研究[16]显示,Th1/Th2、Treg/Th17细胞失衡与CHB的发病机制密切相关。TNF-α是Th1型细胞分泌的一类细胞因子,具有促炎作用,其水平升高可促使肝血管病变。Treg/Th17型细胞失衡发生于CHB的不同阶段,平衡向Treg一侧移动,主要表现为免疫耐受,炎症反应加重[17]。IL-17、IL-22是Th17细胞分泌一类促炎因子,不仅能直接损伤肝细胞,还能诱发细胞因子网络反应,加重肝损伤进程。本研究结果显示,治疗后48周,TDF组血清TNF-α、IL-17、IL-22水平显著低于ETV组,表明TDF的炎症改善作用更显著。陈冲等[18]研究显示,ETV可显著降CHB患者血清促炎因子水平,并认为这可能是ETV的抗病毒机制之一。据此推测,TDF的炎症调节作用优于ETV。本研究中,两组均未发生严重不良反应,且头痛、恶性、疲劳、血肌酐升高等轻度不良反应发生率比较差异无统计学意义,表明TDF、ETV治疗CHB具有较高的安全性。
综上所述,从远期效果分析,TDF治疗CHB的效果更佳;同时,降低血清炎症因子表达可能是TDF、ETV发挥抗病毒、改善肝损伤的重要机制。

