超声造影中肝脏占位性病变中的图像特征及诊断价值
周长航,陈涛,李忍
(亳州市中医院超声科,安徽 亳州 236800)
肝脏占位性病变分为良性和恶性,其中前者包括良性肿瘤、肿瘤样病变和肝血管瘤,后者主要为肝癌[1]。据统计,我国肝癌病死率占全球约45%[2]。故及早明确肝脏占位性病变患者的性质,对治疗方案的制定以及患者生存时间具有重要意义。目前,临床仍以病理学检查作为肝脏占位性病变的金标准,但因该方式具有侵袭性、潜在的感染及出血等风险,导致其推广仍较为艰难。超声是肝脏病变首选的影像学检查方法[3],但因肝脏病变形态复杂多变,且气体、肥胖、角度及肋骨均会对超声图像造成影响,导致常规超声在肝脏占位性病变的良恶性鉴别诊断方面仍具有的局限性。超声造影(contrast-enhanced ultrasonography,CEUS)通过对比脉冲序列成像及反向谐波技术明确病灶内血流动力学情况,进而鉴别肝脏占位性病变[4]。目前国内虽已有较多文献针对超声造影在肝脏占位性病变中的诊断价值进行研究,但多集中于特异度、敏感度的分析[5-6],对于CEUS定量参数的诊断价值及与常规超声图像特征之间的细微差异的研究仍有待完善。本研究旨在探讨CEUS中肝脏占位性病变中的图像特征及诊断价值。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年10月亳州市中医院收治的90例肝脏占位性病变患者为研究对象。其中,男性62例,女性28例;年龄(49.61±10.38)岁。纳入标准:(1)均在本院接受常规超声以及CEUS检查;(2)良恶性病变均经病理学检查确诊;(3)患者临床资料完整。排除标准:(1)既往存在疾病相关治疗;(2)合并其他肺部疾病;(3)病变深度>80 mm者;(4)孕妇或哺乳期患者;(5)对造影剂过敏者;(6)年龄<18岁。
1.2 方法
仪器选用彩色超声诊断仪,Affiniti 70(飞利浦)和西门子Acuson,进行CEUS检查时采用凸阵探头,频率为2.5~5.0 MHz,造影剂为声学造影剂Bracco,造影微泡为磷脂包裹的六氟化硫。患者取仰卧位,先进行常规超声检查,扫查全肝,包括目标病灶的形态、回声等指标,取病灶最大扫查切面,切换造影模式,调节参数,促使超声仪器处于低机械指数状态。将造影剂溶于5 mL生理盐水,经肘静脉团注,注射时间为2~3 s内,期间启动计时器,对病灶及其周围组织的造影成像进行实时观察,直至造影剂几乎完全清除,储存造影过程中的动态图像。判断标准[7]:恶性病变一般表现为动脉期高增强,门脉期或延迟期消退为低增强,呈现出快进快出的模式;良性占位性病变表现为动脉期高或等增强,门脉期或延迟期不变或等增强,或者三期均无增强。
1.3 统计学分析
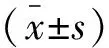
2 结果
2.1 病理学诊断结果
90例患者中,恶性病例10例,其中原发性肝癌6例,转移性肝癌4例;良性病例80例,其中肝血管瘤42例,局灶性增生结节27例,孤立性结节11例。
2.2 常规超声及CEUS图像特征
常规超声图像特征:良性病灶形态规则58例,边界清晰55例,无占位效应59例,病灶内部呈低回声57例;恶性病灶形态不规则16例,边界呈微小分叶或毛刺状15例,内部回声呈低回声12例,无占位效应8例。诊出良性病例67例,恶性病例23例。CEUS图像特征:良性病灶中39例动脉期呈蜂窝样增强,多为高增强,内部可见边界清晰的片状无增强区;23例动脉期呈现不规则高增强;13例动脉期呈环状增强,均为同步高增强,门脉期以及延迟期消退呈等增强。恶性病灶中,8例病变在动脉期呈均匀团状快速增强,与周围暗回声实质形成鲜明对比;4例动脉期增强早于邻近正常组织,可见杂乱的血管增强;3例表现为动脉期整体增强。诊出良性病例75例,恶性病例15例。CEUS诊断准确率高于常规超声(P<0.05)。
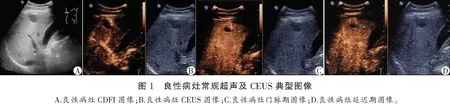
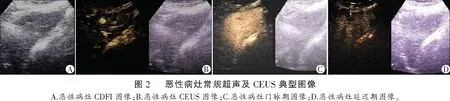
2.3 典型病例图片
良性病灶:常规超声扫查肝右前叶下段见一大小约30×20 mm结节,内部呈低回声,边界清晰,形态规则,周边无声晕,CDFI内部血流信号不明显。CEUS显示动脉期呈中央结节状向心性高增强。门脉期病灶呈高增强,边界清晰,形态规则。延迟期病灶呈稍高增强。恶性病灶:常规超声扫查肝左外叶上段见一大小约13 mm×12 mm团块,内部呈低回声,边界欠清晰,形态欠规则,周边无声晕,CDFI内部可见少许点状血流信号。CEUS显示动脉期病灶呈快速均匀高增强。门脉期病灶呈等增强,边界欠清晰,形态欠规则。延迟期病灶呈低增强。见图1及图2。
2.4 不同性质病变患者增强时的动态时相变化
不同性质病变患者的动态时相变化指标比较,差异均有统计学意义(P<0.05),其中原发性肝癌、转移性肝癌患者的始增时间、始消时间、持续时间均低于肝血管瘤、孤立性结节、局灶性增生结节患者,峰值时间低于肝血管瘤患者(P<0.05)。见表1。
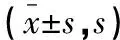
表1 不同性质病变患者增强时的动态时相变化
2.5 不同性质病变患者CEUS定量参数比较
恶性病例的造影剂到达时间、峰值强度显著高于良性病例,达峰时间、拟合曲线尖度低于良性病例,差异有统计学意义(P<0.05)。见表2。
2.6 CEUS定量参数对肝脏占位性病变性质的鉴别诊断价值
CEUS定量参数联合鉴别诊断肝脏占位性病变性质的曲线下面积(AUC)为0.945,敏感度为90.00%,均高于单一参数诊断(P<0.05)。见表3。
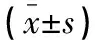
表2 不同性质病变患者CEUS定量参数比较
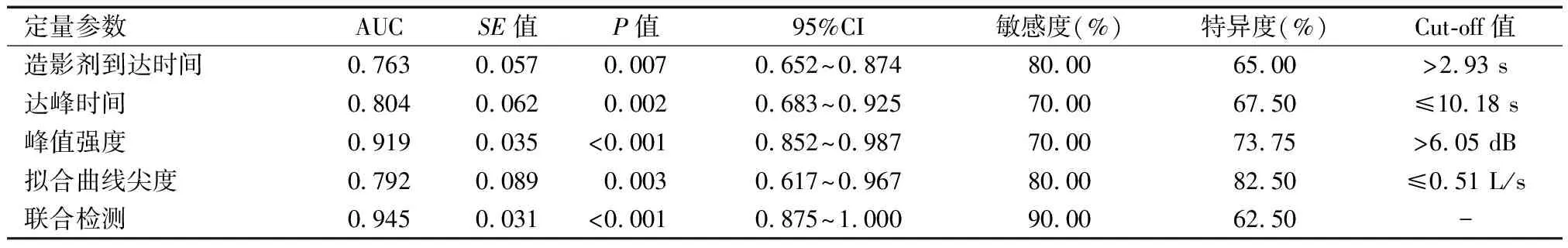
表3 CEUS定量参数对肝脏占位性病变性质的鉴别诊断价值
3 讨论
肝脏占位性病变的良恶性鉴别有助于临床治疗方案的选择。常规超声为当前诊断肝脏占位性病变的常用辅助影像学手段之一,虽具有一定的诊断准确率,但对于大量的微小血管和低速血流敏感性较差,受影响因素较多[8]。近些年随着医学技术的快速发展,CEUS在临床疾病诊治中逐渐应用,可较好的改善常规超声不足之处,其造影剂中含有的微气泡有利于分析增强血流信息。目前,国内已有多项研究显示CEUS对于肝脏占位性病变具有较好的定性诊断价值,但如何定量分析仍有待研究。
本研究中,超声显示肝脏良性病灶表现为形态规则、边界清晰、无占位效应、低回声;恶性病灶表现为形态不规则、边界呈微小分叶或毛刺状、低回声、无占位效应,提示肝脏良恶性常规超声图像特征存在形态等差异,与杨艳萍等[9]研究一致,可能是因为肿瘤内部病理组织成分不同导致的。肝脏具有双重血供,可作为很好的造影增强靶器官,特殊的血管灌注特点促使造影剂在进入肝脏后呈现一定的时相变化,故根据病灶在不同时期的变化特点可鉴别特征[10]。本研究中,CEUS显示肝脏良性病灶部分微小病灶,整个病变可能在动脉期完全增强,并在门脉期以及延迟期持续性强化;良性病灶动脉期表现为环状强化,而恶性病灶动脉期表现为高增强,进一步表明肝脏良恶性CEUS图像特征存在回声、血流信号等差异。相比于常规超声,CEUS可实时成像,对整个增强期间进行连续动态评估,尤其是增强出现较早的病灶;恶性病灶新生细小血管结构复杂、流速较慢,往往存在动静脉瘘,CEUS作为一种纯血池显像,可清楚的显示肿瘤的整体灌注信息[11];当恶性肿瘤浸润周围组织时,CEUS可更为真实的反映病灶的形态学特点和病灶范围[12]。此外,本研究除分析图像特征外,还创新性从病灶增强时的动态时相变化及参数变化等方面定量对CEUS的诊断价值进行了分析。研究结果显示,原发性肝癌、转移性肝癌患者的始增时间、始消时间、持续时间均低于肝血管瘤、孤立性结节、局灶性增生结节患者(P<0.05),峰值时间低于肝血管瘤患者(P<0.05),恶性病例的造影剂到达时间、峰值强度高于良性病例,达峰时间、拟合曲线尖度低于良性病例(P<0.05)。ROC曲线分析显示,CEUS定量参数联合鉴别诊断肝脏占位性病变性质的AUC为0.945,敏感度为90.00%,均高于单一参数诊断(P<0.05),提示通过动态时相变化及参数变化可为肝脏占位性病变的良恶性鉴别提供一定的参考依据。
本研究发现误诊为良性的恶性病灶有2例,分别为孤立性坏死结节与局灶性增生结节,原因可能与肝脏炎性病灶CEUS表现复杂,不具备典型的造影模式相关。研究[13]表明,脂肪肝背景下,局灶性结节增强持续时间相比正常肝背景下明显延长,当病灶位于远场时,延迟相的增强表现会更明显,故局灶性结节在脂肪肝背景下可能呈现恶性病灶的造影模式。既往也有研究[14]表明,病变病灶的血供情况与其病理分化程度相关。另外,李艳等[15]研究发现,不同分化程度的小肝癌动脉期增强程度无明显差异,但在消退时间上有差异。本研究中有7例良性病灶被误诊为恶性,原因是早期肝癌的血供包括滋养动脉及门脉供血,而高分化型肝癌血供有门静脉和肝动脉,这种特点可能是导致部分小肝癌病灶出现快进慢出现象的病理基础。因此,CEUS在肝脏占位性病变的诊断中也具有一定的局限性,在临床实际应用中,还应结合患者临床表现、常规超声等综合判断,对于存疑的病例需通过CT、MRI等影像学检查进一步分析。
综上所述,CEUS在肝脏占位性病变中的诊断价值价较高,可通过图像特征、动态时相变化及造影剂的时间-强度曲线参数为其良恶性鉴别提供参考。本研究的不足之处在于,选择的部分病例良恶性征象比较明显、病例数较少、病例类型较为单一等,不能完全客观的体现CEUS的诊断价值,故今后应通过大样本多中心数据进一步规范CEUS的相关研究。

