息肉套取冷切除术治疗中青年微小型结直肠息肉的回顾性队列研究
涂丽,吴学勇,吴伟
(皖北煤电集团总医院消化内科,安徽 宿州 234000)
结直肠息肉是肠壁黏膜局部异常突出生长的赘生物组织,分布结直肠各个部位,可单发或多发。结直肠息肉早期无明显症状,部分患者出现便血、腹泻、腹痛和腹胀等非特异性症状,不易引起重视,延误早期诊治,严重者可进展为结直肠癌。据报道[1-2],60%~80%结直肠癌由肠道息肉进展而来,因此结直肠息肉的定期筛查和优化诊疗尤为重要。圈套器息肉切除术(snare polypectomy,SP)是目前治疗结直肠息肉的有效手段,包括传统热圈套器切除术(hot snare polypectomy,HSP)和近年兴起的冷圈套器切除术(cold snare polypectomy,CSP),二者的区别在于后者息肉切除无需使用高频电装置。尽管欧洲消化内镜协会指南对≤5 mm的微型息肉推荐采取CSP[3],而不推荐冷活检钳或热活检钳钳除术,但CSP在国内应用相对较晚。传统HSP相比,CSP在中青年结直肠息肉患者的应用报道较少见,在息肉切除效果方面是否具有显著优势,仍需大量研究探讨。此外,结直肠息肉易复发,CSP对结直肠息肉复发的影响尚不明确。本研究拟探讨CSP治疗中青年微小型结直肠息肉的疗效。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月至2021年6月在皖北煤电集团总医院接受息肉切除住院治疗的98例中青年微小型结直肠息肉患者的相关资料。依据息肉切除方式不同,将98例结直肠息肉患者分成CSP组(n=51)和HSP组(n=47)。纳入标准:(1)年龄20~59岁,结肠镜检查明确结直肠息肉,形态为隆起型息肉,可单发或多发,且最大息肉直径<10 mm;(2)具备息肉切除指征,均自愿接受息肉切除术住院治疗,且手术相关资料保留完整。排除标准:(1)哺乳妊娠期妇女;(2)最大息肉直径≥10 mm;(3)合并其他肠道疾病、结直肠癌手术史;(4)手术及住院等资料不全者。本研究经皖北煤电集团总医院伦理委员会批准。两组性别、年龄、息肉大小、息肉数目、内镜下NICE分型和病理分型比较,差异无统计学意义(P>0.05)。见表1。
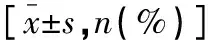
表1 两组结肠息肉患者一般资料比较
1.2 方法
1.2.1 术前准备和仪器 术前1 d少渣饮食,术前5~6 h常规肠道清洁,3 L聚乙二醇电解质散等渗溶液在3 h内口服完毕,必要时基于辅助清洁灌肠,直至肛门排出清亮液体。丙泊酚静脉麻醉,丙泊酚用量根据患者反应酌情增减,给予常规经鼻吸氧,3~5 L/min。相关治疗仪器:采用日本Olympus CV-290/CLV-290SL内窥镜系统和CF240、260电子结肠镜,圈套器型号:南微医学科技股份有限公司MTN-PFS-E-24/23,高频电切装置采用德国爱尔博ICC-200型高频电外科系统。
1.2.2 息肉切除术 所有患者均由结肠镜诊治经验丰富的内镜医师操作,结肠镜检查明确息肉的部位、大小和形状等。(1)CSP组:旋转结肠镜,将息肉固定在内镜视野的6点钟方向。选择合适大小的圈套器套取息肉,且息肉位于圈套器的中心位置,扩大圈套器至息肉边缘外1~2 mm,然后缓慢、力度适中收紧圈套器,持续收紧约15 s,将息肉及息肉边缘1~2 mm的黏膜组织切除。将切除的息肉及周围黏膜组织利用圈套器或负压吸出,标本送至病理科检查。(2)HSP组:圈套器套取息肉时可套取少量息肉边缘正常黏膜组织,然后收紧圈套器并提拉鞘管将病变上提,尽量远离结直肠壁,可适当注入气体,以减少黏膜下层被套取的可能性。采用常规高频电外科系统将套取的息肉切除,电切功率20 W。所有患者息肉切除后,创面观察1 min,持续出血者进行止血处理。
1.2.3 术后随访 两组术后均成功接受6个月的门诊结肠镜检查随访;另外截至2021年5月,CSP组、HSP组分别有35、32例完成1年随访。
1.3 观察指标
由专人进行资料归类与整理,指标包括:一般资料 [性别、年龄、息肉大小(微型、小型)、息肉数目(单发、多发)、内镜下NICE分型(I~III型)、病理分型]、息肉切除时间、术中出血量、息肉完全切除率、并发症(术后出血、穿孔)、治疗费用和术后6个月、1年复发率。息肉切除时间:术中镜下发现息肉至息肉套取后切除的时间。息肉完全切除的评价标准:切除的组织标本外缘或内镜下无息肉残留。术后出血:术后30 d随访期内发生出血,其中术后24 h内出血为早发出血,1~30 d出血为迟发性出血。
1.4 统计学分析
2 结果
2.1 两组息肉切除术相关指标比较
两组术中出血率和术后出血率比较,差异无统计学意义(P>0.05),两组均无穿孔发生。CSP组息肉切除时间短于HSP组,息肉完全切除率高于HSP组,治疗费用低于HSP组,差异均有统计学意义(P<0.05)。两组微型、小型息肉完全切除率比较,差异无统计学意义(P>0.05)。见表2。
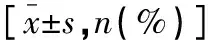
表2 两组息肉切除术相关指标比较
2.2 两组术后6个月、1个月复发率比较
CSP组和HSP组术后6个月、1年复发率比较,差异无统计学意义(P>0.05)。见表3。
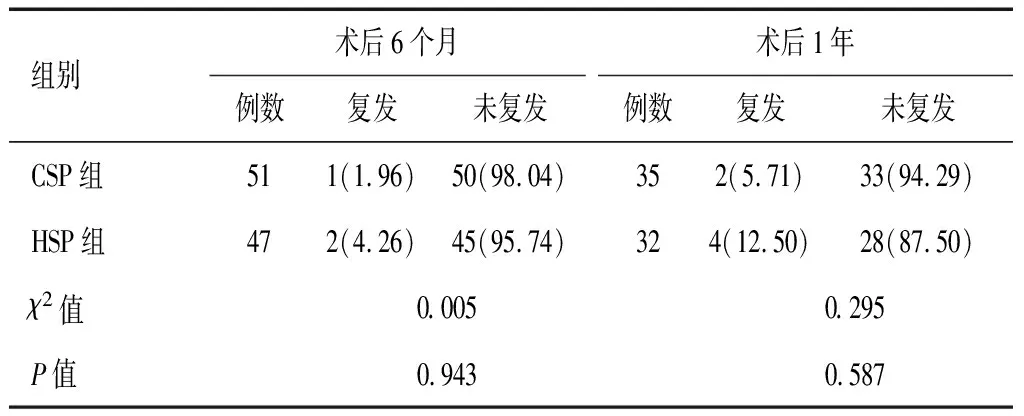
表3 两组术后近期息肉复发率比较[n(%)]
3 讨论
流行病学[4-5]显示,结直肠息肉发病率随年龄增长而上升,老年人是高发人群。但近些年随着高脂饮食、缺乏运动和肥胖现象日益突出,临床就诊的中青年结直肠息肉患者有明显增多趋势。同时,中青年罹患结直肠癌的现象并不少见,结直肠良恶性病变的患病人群有年轻化趋势,需引起重视,加强对中青年人群尤其是存在危险因素人群进行肠镜筛查[6-7]。与老年结直肠息肉患者比较,中青年结直肠息肉患者的息肉多分布在左半结肠,易被检出,有蒂息肉和炎性息肉较多,尽管恶变率相对较低,但严重影响患者的生活质量,仍需引起重视。本研究选择中青年结直肠息肉患者进行回顾分析,是创新之处。
结直肠息肉的内镜下切除方法较多,除SP外,还包括括氩离子凝固术(APC)、活检钳夹术、内镜下黏膜切除术(EMR)等传统手段,具体术式的选择与不同地区医疗水平、内镜医师的经验和偏好以及患者经济因素等有关[8-9]。HSP和CSP作为临床治疗结直肠息肉的微创方法,其中HSP仍是目前国内采用普遍的主流切除方式,HSP与CSP治疗微小型结直肠息肉的优劣性比较仍需大量高质量等级的循证学依据。HSP的关键技术是电切,圈套器套取息肉后利用高频电装置的热能量效应,对息肉组织进行切割并封闭血管,此方法操作简单,效果确切,但也存在不足:(1)尽管套取息肉后将圈套器上提,与息肉基底部保持一定距离,但高频电装置产生的热能量仍易对周围组织产生热损伤,可引起患者术后疼痛、肠壁黏膜组织坏死、电切综合征甚至穿孔等不良后果[10];(2)电切除对套取息肉组织标本和周围正常黏膜产生破坏,组织标本的边缘清晰度和创面整洁度欠缺满意,不利于术后视觉评估有无息肉组织残留,也一定程度影响术后病理判读结果[11-12]。对于微型息肉而言,HSP对术后视觉评估和病理判断的负面影响可能更大。
依据CSP的息肉切除原理,无需使用电凝,直接收紧圈套器切除即可,可较好避免HSP的局限性,且CSP治疗<10 mm的微小型息肉的安全性也得到临床证实,迟发性出血和穿孔现象均较少。本研究显示,两组术中和术后出血率比较差异无统计学意义,但与HSP组比较,CSP组息肉切除时间明显缩短,息肉完全切除率更高和治疗费用更低,与Ito等[13-14]报道相符,这提示CSP治疗中青年微小型结直肠息肉可能更具优势,无需电凝电切操作即可缩短息肉切除时间,又能节省医疗资源和降低治疗费用,性价比较高。与HSP应尽量避免套取过多周围组织比较,CSP切除中可套取息肉周围1~2 mm的正常黏膜组织,提高息肉完全切除率[15]。但也有报道[16]指出,HSP的热效应可有效封闭血管和创面止血,相较而言,CSP术中出血率可能更高。但临床表明,CSP治疗微小型结直肠息肉时术中出血往往较轻,出血量少且出血时间短暂,一般无需特殊处理即可缓解,而且冷切除息肉时可清晰观察出血情况,便于及时止血干预和预防迟发性出血发生。此外,息肉复发也是困扰临床治疗的难题,老年结直肠息肉切除术患者两年累计复发率可达50%~80%[17],因此定期随访复查尤为重要。本研究显示,两组术后6个月、1年的息肉复发率差异无统计学意义,提示CSP、HSP在预防息肉复发方面效果相当。
本研究为单中心、回顾性研究,且符合研究标准的病例较少,样本量不足,可能对研究结论造成一定干扰和偏倚;此外,两组术后随访时间均较短,未能比较术后2、3年的息肉复发情况。后续需开展多中心、大量本和延长随访期限的循证医学研究。
综上,CSP和HSP治疗中青年微小型结直肠息肉均有较好效果,但CSP具有息肉切除时间短、息肉完全切除率高和治疗费用低等优点,而且对术后创面视觉评估和病理判断的干扰较小,可作为理想治疗手段。

