初发噬血细胞综合征患儿外周血单核细胞TLR2、3、4表达水平及预后分析
于程,李长钢 , 刘超
(1.青岛市妇女儿童医院,山东 青岛 266000;2.深圳市儿童医院,广东 深圳 518000)
噬血细胞综合症是一种固有免疫网络系统异常引发的、以“炎性因子风暴”为特征的临床综合征[1-2]。其病因多样、发病机制复杂、病情进展迅速,而又无特异性症状和体征,易引起发热、肝脾肿大、血细胞减少、血清铁蛋白升高、纤维蛋白原降低等,特别是与重症感染所致的多脏器功能衰竭、弥散性血管内凝血等有相似的临床表现,往往被延误诊断,病死率极高。Toll样受体(Toll-like receptors,TLR)是人体内固有免疫系统通过模式识别受体及病原微生物的病原相关分子,诱导天然免疫反应的重要成份生成,在机体免疫机制中起着非常重要作用。在已发现的TLRs中,TLR1 能够识别来自细菌的三乙酰脂肽;TLR2、4能分别识别来自细菌、病毒、自体等来源的脂蛋白及脂多糖,且只在髓源性细胞(单核巨噬细胞)中表达;TLR3、7、8、9 可以识别病毒、细菌感染细胞中的核酸成分。相关研究发现,TLR2、3、4 在其发病机制中作用显著,尤其在多种感染相关疾病,但是目前尚缺乏TLR在噬血细胞综合症患儿发病过程起何种作用研究。尤其是TLR2、4对各种感染相关疾病发病中起重要作用,而作为唯一依赖包含TLR结构域的β干扰素诱导性衔接蛋白(TRIF)信号通路的TLR3,不仅能作为研究病毒感染相关疾病重要分子,而且有助于进一步发现其与TLR4在TRIF信号通路中协同/抑制作用。目前,噬血细胞综合症的诊断及预后预测主要依靠非特异性临床和实验室监测指标,而随着近年来对噬血细胞综合症的研究逐渐加深,临床研究发现并不能完全依靠噬血细胞综合症诊断标准HLH-2004。本研究旨在探讨初发噬血细胞综合征患儿外周血单核细胞TLR2、3、4表达水平及其对预后的预测价值。
1 资料与方法
1.1 一般资料
选择2017年8月至2019年7月深圳市儿童医院收治的18例初发噬血细胞综合征患儿为研究组,18名同期体检健康儿童为对照组。对照组中,男性10名,女性8名;年龄(3.58±1.59)岁。研究组中,男性14例,女性4例;年龄(2.62±1.32)岁。研究经本院伦理委员会审核批准,受试者家属知情同意。两组对象性别、年龄等比较,差异无统计学意义(P>0.05)。研究组再根据预后分为存活组(n=4)与死亡组(n=14)。纳入标准:(1)符合诊断标准[3]并确诊的患儿;(2)年龄<12岁。排除标准:(1)既往有恶性血液、免疫性及其他相关病史;(2)入院前有给予激素、丙种球蛋白大量冲击治疗史、创伤或手术史。
1.2 方法
采集所有对象的外周血,检测以下指标:(1)TLR2、TLR4表达:选择细胞表面染色法对外周血CD14单核细胞进行检测,取流式管2支,并标记为1、2号,分别置入肝素抗凝外周血100 μL,然后加入不同含量的单克隆抗体(管1∶5 μL IgG1 k-PE、CD14-FITC、IgG1 k-APC;管2∶5 μL TLR2 PE、CD14-FITC、TLR4-APC),混匀后于4 ℃环境中避光存放30 min,每管分别加入1×RBC Lysis Buffer 2 mL,混匀后于室温环境中避光存放10 min,红细胞完全裂解后,300 g离心5 min,弃上清液,将预冷过的Flow Cytometry Staining Buffer加入各管中(每管2 mL),旋转混匀,300 g离心5 min,弃上清液,重复上一步后,保留管底的100 μL液体,然后分别于每管中置入Flow Cytometry Staining Buffer 150~200 μL,上机,分别收集细胞1×104个,结束后选择DivaVer 6.1.3软件对TLR2、TLR4的相对比例进行分析。(2)TLR3表达:选择细胞内染色法对外周血CD14单核细胞进行检测,取流式管两支,并标记为1、2号,分别置入肝素抗凝外周血100 μL及CD14-eFlour450 5 μL,旋转混匀后于避光环境中存放10 min,红细胞完全裂解后,300 g离心5 min,轻弃废液,分别于每管中置入Flow Cytometry Staining Buffer 2 mL,同上离心、弃液,重复上一步,保留管底的100 μL液体,放于旋匀器上,将100 μL IC Fixation边旋边加入,需要注意的是枪头禁止碰到管壁,防止溅出,完成后放于室温遮光条件下孵育20 min,分别置入1×Permeabilization Buffer 2 mL,500 g离心5 min,弃废液,重复上一步,保留管底的100 μL液体,于每管中置入Normal Rat Serum、Normal Mouse Serum各3 mL,吹打混匀,于室温条件下孵育15 min,于1号管中置入IgG2a-FITCE 5 μL,2号管中置入TLR3-FITC单克隆抗体5 μL,均混匀,之后于室温遮光条件下孵育30 min,完成染色后,分别置入1×Permeabilization Buffer 2 mL,500 g离心5 min,弃上清,重复上一步后,保留管底的100 μL液体,然后上机检测。(3)白介素1β(IL-1β),干扰素α(IFN-α),干扰素β(INF-β),肿瘤坏死因子α(TFN-α)表达:收集所有研究对象清晨空腹状态下静脉血3 mL,于室温环境中等待30 min后,选择酶联免疫吸附法进行检测。
1.3 统计学分析
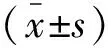
2 结果
2.1 研究组与对照组外周血单核细胞TLR2、3、4表达水平比较
研究组外周血单核细胞TLR2、3、4表达水平高于对照组,差异有统计学意义(P<0.05)。见表1。
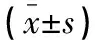
表1 研究组与对照组外周血单核细胞TLR2、3、4表达水平比较
2.2 研究组与对照组血浆IL-1β、IFN-α、INF-β、TFN-α表达水平比较
研究组IL-1β,INF-β,TFN-α表达水平高于对照组,差异有统计学意义(P<0.05);两组对象IFN-α表达水平比较,差异无统计学意义(P>0.05)。见表2。
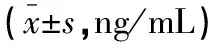
表2 研究组与对照组IL-1β,IFN-α,INF-β,TFN-α表达水平比较
2.3 存活组与死亡组外周血单核细胞TLR2、3、4表达水平比较
死亡组患儿外周血单核细胞TLR2、3、4表达水平高于存活组,差异有统计学意义(P<0.05)。见表3。
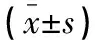
表3 存活组与死亡组外周血单核细胞TLR2、3、4表达水平比较
3 讨论
正常情况下,病毒/细菌感染后巨噬细胞分泌IL-12等,刺激自然杀伤细胞(natural killer cell,NK)和细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)活化,诱导细胞毒效应,进而清除病毒/细菌,防止过度刺激活化免疫细胞,而噬血细胞综合症情况下,NK细胞和CTL细胞毒功能缺陷,抗原刺激下持续活化和增殖,CTL产生大量细胞因子,尤其是IFN-α,后者进一步刺激巨噬细胞持续活化,分泌大量IL-12和其他细胞因子(IL-1、IL-6、IL-10、IL-18和TNF )。IL-12又刺激CTL扩增,产生INF-α,大量炎性细胞因子堆积而发生“炎性因子风暴”[4]。对组织细胞造成损伤,引起一系列临床表现,但是炎性因子风暴产生的具体机制尚未明确。近年来对噬血细胞综合症的研究越来越多,但起病过程并无特异性,因此往往容易与其他疾病混淆,延误诊断时机,急需通过研究明确其发病机制,为早期诊断及治疗提供新思路。
TLRs作为近些年研究热点,在国内外多项研究[5-7]发现,TLR在免疫调节中发挥重要作用并得到广泛认可。TLR是一类由胞外区、跨膜区及胞质区组成的I型跨膜蛋白。其胞外区为N端,由19-25个含有多个亮氨酸的重复序列构成,它能够识别病原微生物表面的脂多糖、胞壁酸等。TLR跨膜区为含半胱氨酸的结构域[8]。TLR在人体细胞中广泛分布,但其表达数量在不同细胞中存在较大差异。研究[9-12]发现,TLR2、3、4结肠癌细胞中过度表达,TLR2、3等受体在传染性单核细胞增多症等 EB 感染患儿中显著表达,而在脓毒症等感染中检测到TLR2、4也过度活化。并且TLR3也发现与哮喘、感染性休克、类风湿性关节炎等多种炎症及自身免疫性疾病有关[13-15]。本研究收集的18例噬血患儿中,14为EB病毒性噬血细胞综合症,3 例明确为细菌感染,1例病因不明。TLR2能够识别包括来源于细菌、病毒、真菌以及自体损伤等产生的脂蛋白等;TLR4 除能够识别革兰氏阴性菌内毒素,还可分别通过识别病毒感染后的损伤相关分子模式以及与病毒衣壳蛋白结合而活化。本实验观察结果发现,噬血细胞综合症患儿外周血单细胞 TLR2、3、4 表达水平较健康儿童明显较高(P<0.05),说明TLR2、3、4 的活化在噬血细胞综合症发病中起重要作用。
目前已证实TRAF及核因子κB等信号分子激活,可诱导 IL-1、TNF-α、IFN-α等细胞因子大量表达[16-18]。在正常情况下,当病毒/细菌等感染机体后,单核巨噬细胞系统会分秘IL-12等,刺激NK细胞及CTLs发挥细胞毒效应,而噬血细胞综合症中患儿体内NK细胞及CTLs 的细胞毒效应减弱,导致大量细胞因子聚集无法发挥正常免疫作用,最终产生炎性因子风暴。为进一步证明此现象以及研究细胞因子的产生与噬血细胞综合症中TLR2、3、4活化及下游信号传导情况的关系,本研究通过对噬血细胞综合症患儿及健康儿童血清检测发现,噬血细胞综合症患儿IL-1β、TNF-α、IFN-α浓度均高于健康对照组(P<0.05)。可能正是TLR2、3、4的活化,导致前炎性细胞因子基因表达水平升高,尤其是IFN-α,其对巨噬细胞刺激作用明显,刺激巨噬细胞进一步活化,这种恶性循环,使更多IL-1,IL-6,IL-12等细胞因子在体内大量堆积[19]。由此可见,TLR2、3、4的大量活化,可能是导致噬血细胞综合症患儿体内炎性细胞因子风暴的发生的重要原因。另外,噬血细胞综合症患儿的IFN-α表达水平较健康儿童,升高不明显(P>0.05),可能与TLR-TRIF通路活化受到抑制,最终导致I型干扰素基因表达受限有关。可能正是TRIF依赖通路激活受限,干扰素分泌不足,导致机体不能及时有效清除病毒等感染,而持续的刺激不断诱使TLR2、4激活,产生IL,TNF等大量细胞因子,导致机体免疫失衡。其中IL-1大量产生后易引起发热和恶病质,而TNF-α和IFN-α等会抑制骨髓造血功能是导致血细胞减少,这种免疫紊乱最终导致噬血细胞综合症一系列临床表现[20]。本研究对患者的预后分析结果显示,死亡初发噬血细胞综合征患儿的TLR2、3、4表达水平较存活患儿来说均较高(P<0.05),说明TLR2、3、4同噬血细胞综合征的发展息息相关,同时能够在一定程度上预测预后状态。由此推测,初发噬血细胞综合征患儿在感染细菌或病毒后,活化了大量的TLR2、3、4,且它们分别特异性识别侵入的革兰阳性菌、革兰阴及阳性菌、葡萄球菌,从而导致炎症因子风暴,进而参与噬血细胞综合征的发展。
综上,初发噬血细胞综合征患儿外周血单核细胞TLR2、3、4及血浆IL-1β,INF-β,TFN-α表达水平明显较高,且外周血单核细胞TLR2、3、4表达水平能够判断初发噬血细胞综合征患儿的预后状况。

