lncRNA-LOC100505851对肝细胞癌的诊断及预后判断价值
韩晓婷,王子安,毕国斌
(蚌埠医学院第二附属医院肿瘤内科,安徽 蚌埠 233000)
肝癌是世界范围内最常见消化系统恶性肿瘤之一,死亡率较高,对于肝细胞癌(HCC)而言,属多发肝癌类型[1-2]。研究[3-4]显示,在多种类型的恶性肿瘤中,对于HCC引发的死亡而言,在全球居第四位,在我国境内,经对HCC的发病率展开调查,位居第五,经对死亡率展开调查,位居第二。现阶段,临床在对罹患HCC的患者进行治疗时,以采取化疗方法、放疗方法、免疫靶向治疗及手术切除等为主,但是由于HCC细胞早期临床表现隐匿,远处转移早,复发率高,上述临床治疗手段均不能达到理想效果[5-6]。因此,寻找特异性高的生物标志物对HCC的临床早发现、早治疗、改善生存预后尤为重要。对于长链非编码RNA(lncRNA)来讲,属一类转录本长度在200nt以上的RNA分子,在编码蛋白中并不参与,但一般以RNA的形式自转录调控、表观遗传调控、及转录后调控等通过,发挥对基因表达水平的调控作用。近年来关于lncRNA的相关研究发展迅猛,Yu等[7]发现,lncRNA-MALAT1可通过拮抗miR-142-3p促进肝癌细胞增殖、迁移和侵袭;Zeng等[8]表明,lncRNA-CASC9高表达可改善肝癌预后,是HCC的潜在诊断和预后指标之一;同时有报道指出,对于lncRNA-LOC100505851,其在罹患乳腺癌患者癌组织中的表达,相较癌旁组织呈更低显示[9],但就lncRNA-LOC100505851表达来讲,对临床罹患HCC患者的进行诊断、预后评估及预测则未有报道,因此本研究选取接受肝脏切除手术的HCC患者80例作为研究对象。并对其在癌组织及癌旁组织分布的lncRNA-LOC100505851 物质水平进行检测,就两组在病理特征与预后方面的差异展开分析,旨在提供给肝癌患者诊治工作的参考。
1 资料与方法
1.1 一般资料
选取2017年1月至2018年12月蚌埠医学院第一附属医院及蚌埠医学院第二附属医院收治的接受肝脏切除手术的80例HCC患者作为研究对象。其中,男性42例,女性38例;年龄(45.36±3.74)岁。纳入标准:(1)依据原发性肝癌规范化病理诊断指南(2015年版)[10]确诊患者为HCC;(2)临床及随访资料完整。排除标准:(1)术前接受放疗或化疗;(2)术后由于除肿瘤复发或转移以外的原因死亡。本研究通过医院医学伦理委员会批准。
1.2 检测方法
1.2.1 主要仪器及试剂 离心机(Multifuge X1/X1R Pro,赛默飞)、实时荧光定量聚合酶链式反应(PCR)仪(LightCycler 480,罗氏诊断)、紫外分光光度计(U-3900/3900H,日立)。Trizol、逆转录试剂盒Prime Script TM RT Master MiX及荧光定量试剂盒SYBR Premix Ex Taq TM购自TaKaRa公司, lncRNA-LOC100505851与内参β-actin引物均由南京金斯瑞公司合成。
1.2.2 实时荧光定量聚合酶链式反应(qRT-PCR)检测lncRNA-LOC100505851在癌组织和癌旁组织的表达量 参考“7点”基线取材法[10],术中取患者癌组织及距肿瘤边缘>2 cm的癌旁肝组织,等渗盐水漂洗,液氮速冻并做好标记后存于-80 ℃冰箱备用。采用Trizol法提取患者癌组织及癌旁组织中的总RNA:取300 mg速冻的癌组织及癌旁组织分别研磨至粉末状,加入1 mL Trizol试剂,待相分离后取水相上清液离心沉淀,洗涤干燥后再次溶解,分光光度计测定RNA的浓度。按逆转录试剂盒说明合成互补脱氧核糖核酸(cDNA),在冰上配制反应液(5×Prime Script RT Master MiX 2 μL;总RNA 5 μL;RNase-free dd H2O 3 μL),轻柔混匀后进行加入DNA扩增仪中,反应条件为:37 ℃ 15 min反转录,85 ℃ 5 s反转录酶失活后,4 ℃保存。lncRNA-LOC100505851与内参β-actin引物,β-actin:F:5′-CCC ATC TAT GAG GG TTAC GC-3′,R:5′-TTT AAT GTC ACG CAC GAT TTC-3′,扩增片段长度为379 bp;lncRNA-LOC100505851:F:5′-TAC ACG CTT CCC TAT GTC ATC C-3′,R:5′-GCC TAT CCT ACT GTG TCC CTT-3′,扩增片段长度为462 bp。利用待测cDNA配置20 μL反应体系 [SYBR Premix Ex TaqⅡ(2×):10 μL;PCR正向引物(10 μM)0.8 μL;PCR反向引物(10 μM)0.8 μL;ROX Reference Dye(50×)0.4 μL;cDNA溶液:2 μL;灭菌蒸馏水:6 μL],进行PCR扩增,扩增条件为:94 ℃预变性30 s,94 ℃变性5 s,60 ℃延伸退火30 s,循环40次,每份样品扩增3个孔,实验重复3次。以β-actin为内参,得出ΔCt ,目标基因相对表达量以经过处理的样本相对于未经处理的样本的倍数表示,即检测基因相对表达量=2-ΔΔC(ΔΔCt=ΔCt处理样品-ΔCt未处理样品)。
1.3 临床资料收集及随访
收集所选取的80例HCC患者的性别、年龄等一般临床资料及病例资料,采用TNM(tumor-node-metastasis)分期(第8版)[11]对术后所得的病理组织切片进行评估以确定各HCC患者肝癌TNM分期。在患者术后出院,根据自身病情接受放化疗及护肝治疗,采取门诊或电话随访方式对患者病情持续跟踪,频次为3个月或半年1次,随访时间持续3年。
1.4 统计学分析
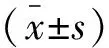
2 结果
2.1 HCC组织及癌旁组织lncRNA-LOC100505851的表达水平比较及诊断效能
80例HCC癌组织中,lncRNA-LOC100505851水平(0.57±0.23)低于对应的癌旁组织(P<0.05);采用患者的HCC组织及癌旁组织中lncRNA-LOC100505851水平对HCC进行ROC曲线诊断,ROC曲线下面积(AUC)为0.863(P<0.05),最佳截断值为0.695,此时约登指数最大为0.563,灵敏度及特异度为0.825、0.738。见图1。
2.2 HCC组织中分布的lncRNA-LOC100505851 表达同病理特征之间的相关性
依据ROC曲线,获取最为理想的截断值,作为临界值,将HCC组织中lncRNA-LOC100505851 物质所呈现出的表达按高表达组(≥0.695)予以定义,并与低表达组(<0.695)进行比较,对lncRNA-LOC100505851 表达水平同临床病理特征之间的关系进行分析,结果表明,HCC组织中lncRNA-LOC100505851 物质的表达同肿瘤位置、性别、年龄关联性较小(均P>0.05),同肿瘤体积大小、有无淋巴结转移及TNM分期之间具密切相关性(P<0.05),见表1。
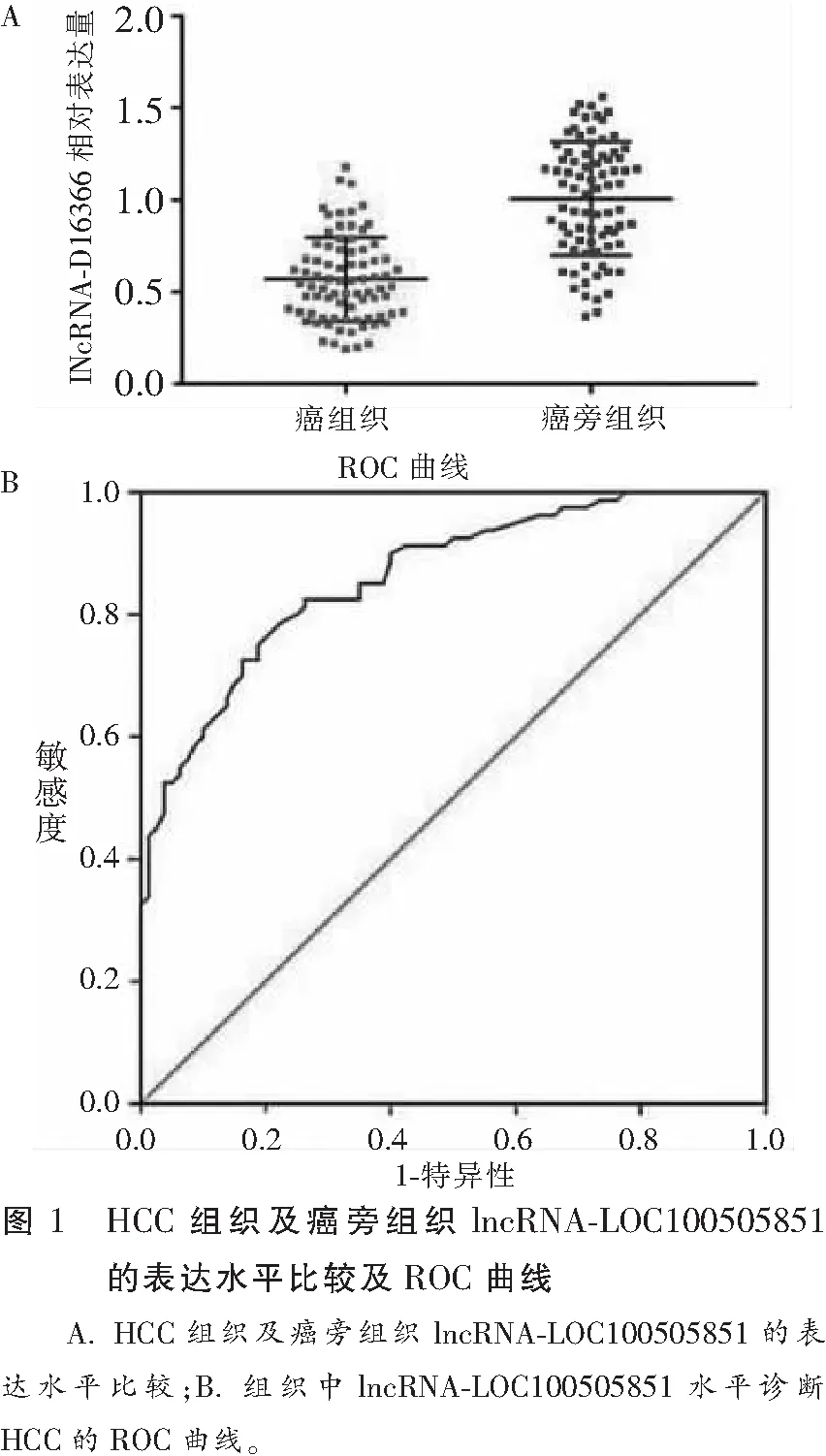
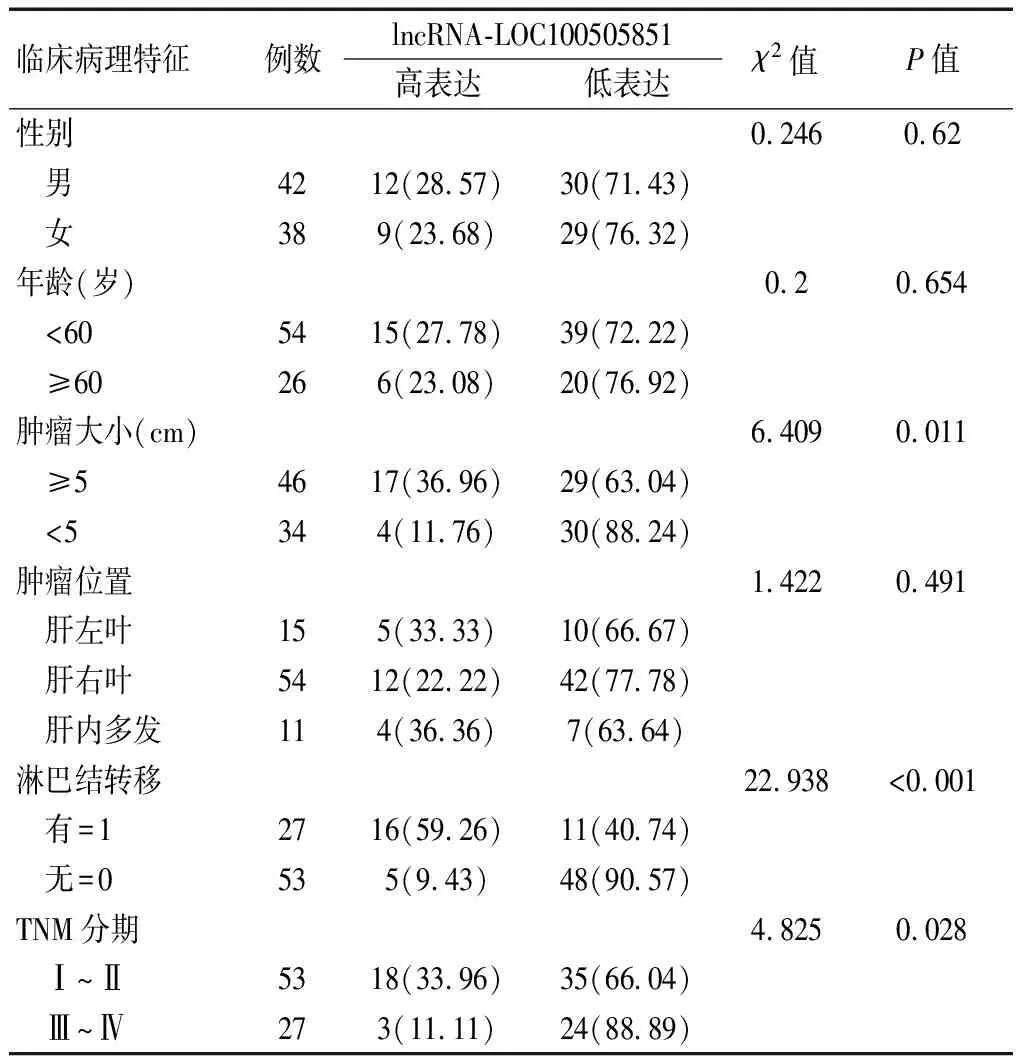
表1 HCC组织中lncRNA-LOC100505851表达与临床病理特征的关系[n(%)]
2.3 HCC组织中lncRNA-LOC100505851表达与HCC预后的关系
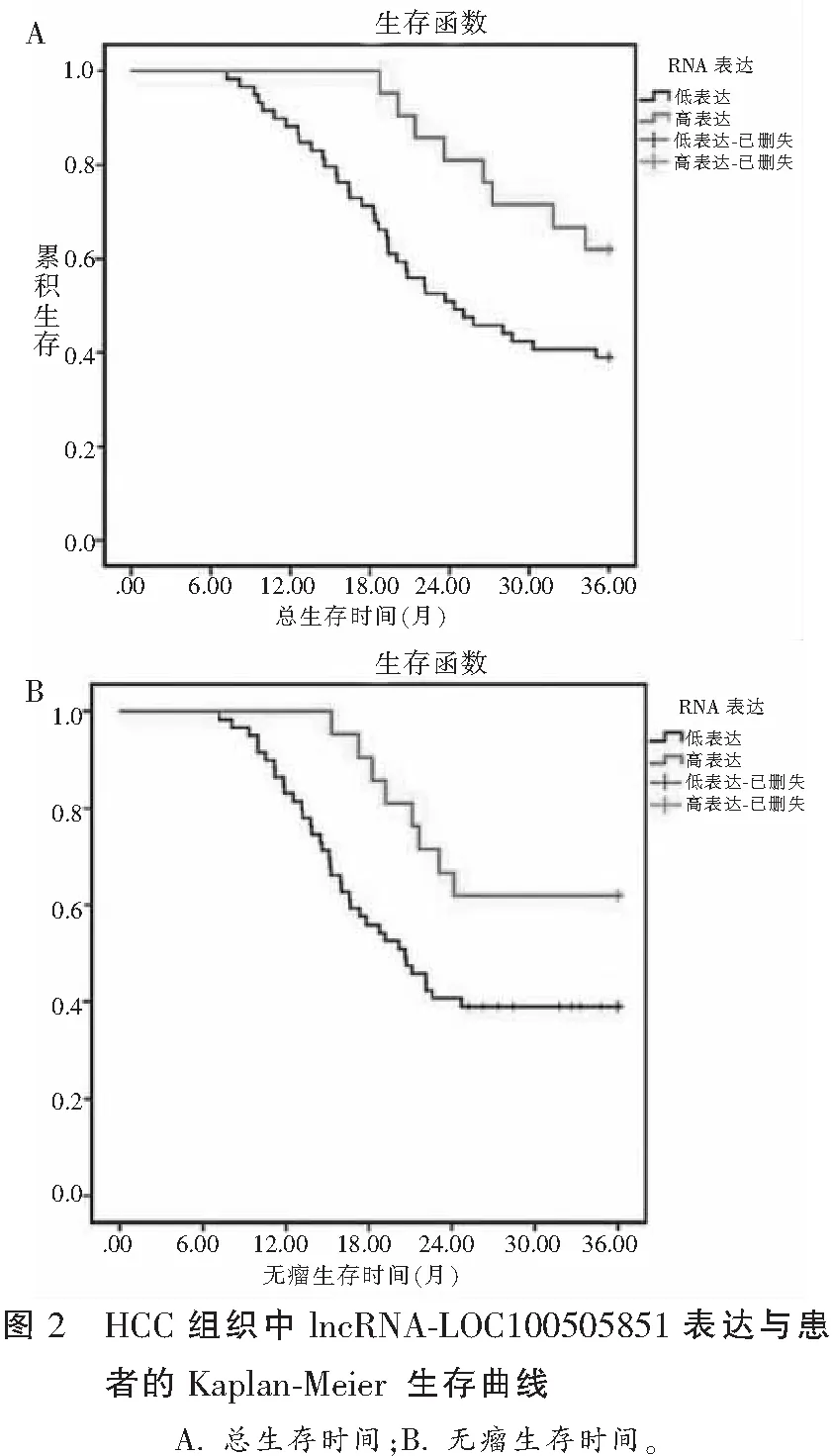
对生存分析结果展开评估,lncRNA-LOC100505851物质高表达组在第1、2、3年所总生存率依次为100.00%、81.00%、61.90%,lncRNA-LOC100505851低表达组第1、2、3年的总生存率分别为88.10%、50.80%和39.00%;lncRNA-LOC100505851高表达组第1、2、3年的无瘤生存率分别为100.00%、66.70%和61.90%,lncRNA-LOC100505851低表达组第1、2、3年的无瘤生存率分别为83.10%、40.70%和39.00%,均低于 lncRNA-LOC100505851高表达组。见图2。
2.4 HCC患者总生存时间的危险因素分析
单因素分析结果显示,肿瘤大小≥5cm、TNM分期为Ⅲ~Ⅳ期、淋巴结转移和lncRNA-LOC100505851 低表达为罹患HCC的患者在总生存时间方面的危险因素(P<0.01或P<0.05);依据多因素结果,肿瘤大小≥5cm、TNM分期为Ⅲ~Ⅳ期和lncRNA-LOC100505851 低表达为HCC患者总生存时间的独立预测因子(P<0.05)。见表2。
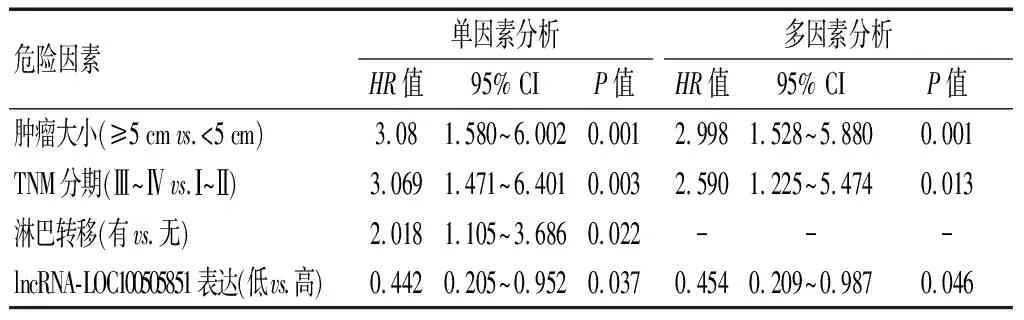
表2 单因素和多因素Cox 回归综合生存分析
3 讨论
HCC作为最常见的一种肝癌病理类型,在病程早期,症状多呈隐匿显示,患者在被临床确诊时,多已至病程晚期,且远处转移问题发生较早,同时,有较高的复发率,尚无可发挥根治性治疗作用的方法。化疗、放疗、免疫靶向治疗及手术切除等临床治疗手段均无法达到较理想效果,导致患者预后差[12]。随着临床综合诊断、治疗手段的改进及免疫靶向治疗的发展,HCC患者的诊断与生存预后获得了一定的提高,但寻找特异性较高的生物标志物对临床HCC的早发现、早治疗、生存预后仍然至关重要。
lncRNA为长度超过200nt的非编码RNA,可在X染色体沉默中参与,同时参与基因组印记以及在染色质修饰环节,转录激活环节、干扰环节,核内运输环节等其它多种重要且核心的调控过程[13-14]。lncRNA为包括肝癌在内的各种恶性肿瘤的重要调节因子,可作为预后评估指标及潜在的治疗靶点[15-17]。在本研究所选取的80例HCC患者癌组织中lncRNA-LOC100505851水平为0.57±0.23,低于对应的癌旁组织的1.01±0.31。且绘制ROC曲线分析组织中lncRNA-LOC100505851表达水平对HCC结果的显示,经对曲线下面积进行评估,为0.863,经对灵敏度参数及特异度参数进行评定,分别为0.825,0.738,对HCC的诊断价值较高。同时本研究根据ROC曲线所得最佳截断值(0.695)将于HCC患者组织中分布的lncRNA-LOC100505851物质表达按高表达组与低表达组进行划分,分析所表现出的表达水平同罹患HCC患者在临床特征方面的相关性,结果表明,于HCC组织中分布的lncRNA-LOC100505851物质表达,同肿瘤体积大小、有无淋巴结转移情况,及TNM分期之间关联密切;且结合生存分析结果示,对于lncRNA-LOC100505851物质低表达组的患者,第1、2、3年的总生存率及无瘤生存率均低于lncRNA-LOC100505851 高表达组,该结果表明lncRNA-LOC100505851可作为HCC患者临床治疗预后的有效生物标志物。
本研究收集HCC患者的病例资料,进一步针对可对患者预后产生影响的因素展开Cox回归方面的综合生存层面的分析,单因素分析结果显示,肿瘤大小≥5 cm,TNM分期为Ⅲ~Ⅳ期,淋巴结转移与lncRNA-LOC100505851低表达为HCC患者总生存时间的独立危险因素;多因素分析结果显示,肿瘤大小≥5 cm,TNM分期为Ⅲ~Ⅳ期与lncRNA-LOC100505851低表达为HCC患者总生存时间的独立预测因子,该结果再次证明lncRNA-LOC100505851可作为HCC患者临床治疗预后预测的有效指标。lncRNA作为基因表达过程中重要的调节因子,是目前肿瘤标志物研究的热点之一。Zhang等[15]研究发现,lncRNA-ZNF385D-AS2与miR-96和miR-182间可能存在调节信号轴,其低表达预示着HCC患者预后不良;Xin等[16]研究表明,lncRNA HULC在人HCC中高度上调,与PTEN或miR15a的表达呈负相关,在HCC的发生过程中发挥重要作用;Yan等[17]指出,lncRNA-HAND2-AS1可介导SOCS5通过JAK-STAT通路延缓HCC的增殖和迁移。本研究表明lncRNA-LOC100505851在HCC患者临床预后中至关重要。但本研究仍存在一定的局限性,譬如,未明确相关分子机制;仅分析了HCC患者的癌组织与癌旁组织,未对血清中lncRNA-LOC100505851水平进行检测,同时未以肝炎患者血清中lncRNA-LOC100505851的表达作为比对。因此lncRNA-LOC100505851是否能够区分HCC与肝炎仍需后续进一步研究。
综上所述,lncRNA-LOC100505851在癌组织中的高表达与HCC患者的临床病理特征密切相关,可延长患者生存时间,作为HCC患者预后评估和治疗的潜在靶点。

