术前血清r-GT、ALP水平与晚期肝癌患者经导管肝动脉化疗栓塞术疗效的相关性
李艳秋,刘培明,范德胜
(淮北矿工总医院医学检验科,安徽 淮北 235000)
2020年全球肝癌病死率高达91.6%[1],我国肝癌每年新发病例为37万,死亡病例32.6万[2]。肝癌恶性程度极高,发病较隐匿,早期症状不明显,导致难以诊断,且病情进展较快,一旦确诊多为中晚期,预后较差[3]。晚期肝癌患者已基本失去手术机会,主要通过局部联合系统化疗的方式延长生存时间、改善预后,其中经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)经过肿瘤主要供血靶动脉注入化疗药物,治疗效果良好,不良反应轻微,被广泛应用于中晚期肝癌患者的非手术治疗中[4]。目前,临床上主要依据影像学检查监测TACE疗效,但不仅监测成本较高,还可能对人体造成损害,因此寻找新的简单有效的生化指标评估或预测肝癌患者TACE疗效意义重大。r-谷氨酰转肽酶(r-glutamyl transferase,r-GT)和碱性磷酸酶(alkaline phosphatase,ALP)与肝癌的发生发展关系密切,是研究肝胆病变的关键指标[5-6]。目前,有关血清r-GT和ALP水平与晚期肝癌患者TACE疗效的相关性的研究较少,且多为单一指标报道。鉴于此,本研究拟通过检测晚期肝癌患者TACE术前血清r-GT和ALP水平,探讨两者与TACE疗效的相关性。
1 资料与方法
1.1 一般资料
选取2017年1月至2022年1月淮北矿工总医院肝胆科收治的80例晚期肝癌患者(观察组)为研究对象。其中男性57例,女性23例;年龄(55.48±10.26)岁;Child-Pugh分级[7]:A级32例,B级38例,C级10例。以同期80名健康体检者为对照组。其中男性49例,女性31例;年龄(57.52±9.88)岁。两组年龄、性别一般资料比较,差异无统计学意义(P>0.05)。纳入标准:(1)符合《原发性肝癌诊疗规范(2017年版)》[8]中关于晚期肝癌的诊断标准;(2)经术后病理检查确诊;(3)年龄>18岁,具有TACE手术指征;(4)生命体征平稳,Karnofsky评分≥60分,预计生存期≥3个月;(5)无淋巴结、远处转移,无癌栓。排除标准:(1)鉴别诊断为继发性肝癌者;(2)合并心、肺、肾等器官功能严重障碍者;(3)伴有严重代谢性疾病或严重免疫系统疾病者;(4)存在消化道出血或有出血倾向者;(5)近期有感染史或既往有肝移植史者。
1.2 方法
1.2.1 血清r-GT和ALP水平检测 采集晚期肝癌患者治疗前2周和对照组体检当日的空腹静脉血,3~4 mL,4 000 rpm 20 ℃、离心10 min,收集上清液,使用Au5800全自动生化分析仪(贝克曼公司)检测两组血清r-GT(速率法)(正常值:男性11~50 U/L、女性7~32 U/L)和ALP(速率法)水平(正常值:40~150 U/L),检测试剂盒购于贝克曼库尔特实验系统(苏州)有限公司,并严格按照说明书进行操作。
1.2.2 TACE治疗 所有操作均由副主任医师及以上职称医师完成。术前常规检查患者肝、肾、心、肺功能、血常规、尿常规、凝血功能。常规消毒铺巾,按照Seldinger技术行股动脉插管,成功后将导管插入腹腔干,行肿瘤病灶血管造影,明确肿瘤位置、大小、数量和血供情况后行选择性肝动脉插管,以适当速度混合注入栓塞剂(超液态碘化油2~3 mL)和化疗药物(奥沙利铂50 mg,吡柔比星20 mg),确保完全栓塞肿瘤供血动脉后拔管,加压包扎穿刺动脉。
1.2.3 疗效评价 TACE术后28 d复查增强CT,参照实体瘤疗效评价标准[9]评估TACE临床疗效,包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),其中CR+PR定义为有效,SD+PD定义为无效。
1.3 统计学分析
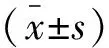
2 结果
2.1 两组术前血清r-GT和ALP水平比较
观察组术前血清r-GT和ALP水平均高于对照组,差异有统计学意义(P<0.05)。见表1。
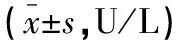
表1 两组术前血清r-GT和ALP水平比较
2.2 观察组中有效和无效患者术前血清r-GT和ALP水平比较
TACE术后28 d复查增强CT,根据TACE疗效将80例患者分为有效组(n=46)和无效组(n=34),比较两组术前血清r-GT和ALP水平。有效组术前血清r-GT和ALP水平均低于无效组,差异有统计学意义(P<0.05)。见表2。
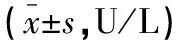
表2 有效组和无效组术前血清r-GT和ALP水平比较
2.3 术前血清r-GT和ALP水平与TACE疗效的相关性
Spearman相关性分析显示,晚期肝癌患者术前血清r-GT和ALP水平与TACE疗效呈负相关性(P<0.05)。见图1。
2.4 晚期肝癌患者术前血清r-GT、ALP水平Logistic逐步回归分析
将晚期肝癌患者术前血清r-GT(X1)、ALP水平(X2)作为自变量(X),晚期肝癌患者TACE疗效作为因变量(Y∶1=有效,2=无效),建立Logistic逐步回归方程,结果显示,术前血清r-GT、ALP水平均是晚期肝癌患者TACE疗效的影响因素(P<0.05)。见表3。
2.5 晚期肝癌患者术前血清r-GT、ALP水平对TACE疗效的预测价值分析
联合预测的AUC值大于两项单独预测(Z=-3.469、-3.448,P<0.05)。当血清r-GT、ALP取最佳截断值时,其预测晚期肝癌患者TACE疗效的敏感度分别为85.3%、82.4%;特异度分别为43.5%、56.5%;当r-GT和ALP联合检测时,敏感度为79.4%,特异度为82.6%。见图2及表4。
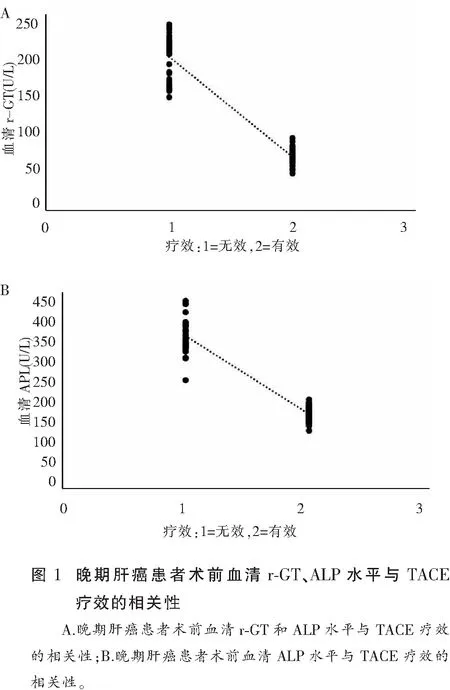
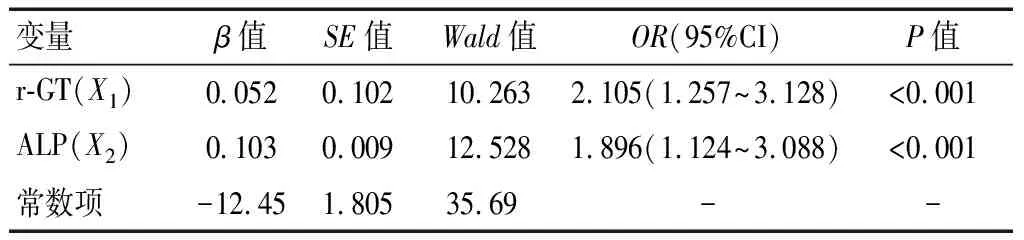
表3 晚期肝癌患者术前血清r-GT、ALP水平Logistic逐步回归分析
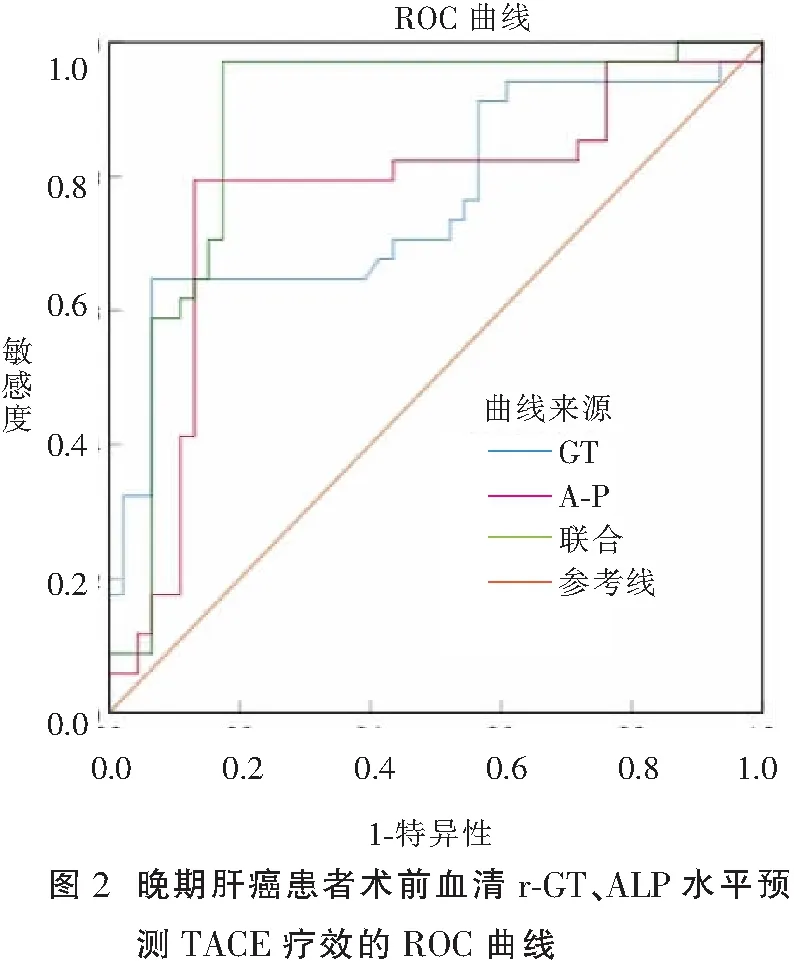
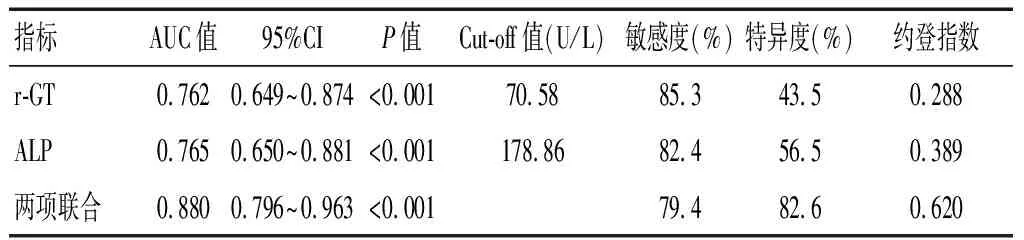
表4 晚期肝癌患者术前血清r-GT、ALP水平对TACE疗效的预测价值
3 讨论
肝癌发病率日益提高,逐渐成为全球性健康问题[10]。与此同时,研究者对肝癌的发病机制也逐渐形成深刻认识,PI3K/AKT/MTOR通路、P53细胞周期信号通路、WNT/β-catenin、RAS/RAF/MAPK通路、表观遗传修饰和氧化应激信号通路是目前发现的肝癌发生过程中主要涉及的分子调控机制[11]。由于肝癌异质性极大,每位患者的发病机制及用药方案不尽相同,如何针对不同个体进行早期诊断、精准化治疗和疗效评估日益成为医学界关注的焦点问题。
肝胆系统恶性肿瘤患病风险随血清r-GT、ALP水平升高而增高[12]。临床研究和动物实验[13]表明,血清r-GT、ALP水平均与肝胆疾病相关,可在一定程度上作为肝脏系统疾病的诊断或预后预测指标。本研究中,观察组术前血清r-GT和ALP水平均高于对照组,提示晚期肝癌患者血清r-GT和ALP水平异常升高。r-GT属肝脏特异性酶类,是一种广泛分布于肝脏的质膜结合糖蛋白,主要存在于肝细胞膜和微粒体中,肝癌患者受癌细胞逆向分化影响导致肝细胞合成过多的r-GT,同时癌细胞自身可合成r-GT,导致血清中r-GT含量升高[14]。ALP是一种广泛分布于人体肝脏、骨骼等组织内的磷酸单酯水解酶,经肝脏向胆外排出,当肝脏病变时,癌细胞大量增殖,刺激肝细胞过度合成ALP并反流入血液,使血清ALP水平升高[15]。既往报道[16]显示,25%~35%的肝癌患者单独应用TACE作为局部治疗可使肿瘤得到有效控制,使巴塞罗那临床肝癌分期为中期的患者生存期得到有效延长。TACE包括肝动脉灌注栓塞术和区域化疗,通过栓塞肿瘤供血动脉、局部灌注化疗药物,使得肿瘤组织缺血坏死,抑制肿瘤生长,同时减少化疗药物用量,降低药物不良反应,对肝脏损伤较小,成为目前临床上中晚期肝癌的首选治疗方法。临床常用于监测TACE疗效的方法主要是以B超、CT和MRI等影像学检查手段为主,但在小病灶评估中不敏感,改善疗效评估性能的合理策略可能是寻找简单方便的血清学指标。
本研究结果显示,有效组术前血清r-GT和ALP水平低于无效组,且Spearman相关性分析显示,晚期肝癌患者术前血清r-GT和ALP水平与TACE疗效呈负相关性,提示晚期肝癌患者术前血清r-GT和ALP水平可有效预测TACE疗效,两者水平越高,可能晚期肝癌患者TACE疗效越差,降低晚期肝癌患者术前血清r-GT和ALP水平可在一定程度上改善TACE治疗效果。本研究通过Logistic逐步回归分析发现,术前血清r-GT和ALP水平是影响晚期肝癌患者TACE疗效的独立危险因素。同时,ROC曲线分析显示,术前血清r-GT、ALP水平预测晚期肝癌患者TACE疗效的AUC值分别为0.762、0.765,取最佳Cut-off值时,敏感度分别为85.3%、82.4%,特异度分别为43.5%、56.5%,而两项联合检测预测晚期肝癌患者TACE疗效的AUC值为0.880,敏感度为79.4%,特异度为82.6%,表明术前血清r-GT、ALP水平与晚期肝癌患者TACE疗效有关,并能在某种程度上作为晚期肝癌患者TACE疗效的有效预测指标,且联合检测时可使预测效能有效提升。这可能是因为联合检测可以取长补短,将多种指标整合成一组敏感性和特异性都较高的标志物体系,从而提高评估效能。尽管本研究可在一定程度上指导晚期肝癌患者TACE疗效及预后评估,但仍存在局限性,譬如,本研究为单中心研究,纳入样本量有限,研究结论仍需多中心、大样本研究予以支撑。
综上,血清r-GT、ALP在晚期肝癌患者中呈现高表达,与晚期肝癌患者TACE疗效存在一定相关性,二者联合检测可有效提高对晚期肝癌患者TACE疗效的预测效能。

