黄芪甲苷对糖尿病心肌病小鼠的治疗作用及其机制
杨嫒萍,张磊,李炜,樊贝贝,孙梦娜,张晓东,张艳涛
西安国际医学中心医院心脏内科,西安 710100
糖尿病是一种以血糖升高为特征的代谢疾病,其并发症涉及身体各器官。研究指出,心血管疾病是糖尿病患者死亡的主要原因[1]。糖尿病心肌病(DCM)是糖尿病患者无其他心脏危险因素(如冠心病、高血压和严重瓣膜病)时出现心肌结构和功能异常的一种糖尿病性心脏病,其特征是细胞和分子水平的损伤和异常,以及最初的心脏舒张功能不全,进而发展为收缩功能不全,最终导致心力衰竭[2]。此外,DCM 的发病机制尚未完全阐明,其中胰岛素抵抗、胰岛素信号转导异常、过度氧化应激、炎症、内皮功能障碍、心肌细胞焦亡、自噬、凋亡、心肌肥厚、心肌纤维化等可能参与了DCM 的发生发展[3]。黄芪甲苷是传统中草药黄芪中的主要活性成分,具有抗肿瘤、抗炎、抗氧化、抗糖尿病及免疫调节等多种药理活性[4]。近年来越来越多的研究证实,黄芪甲苷对心血管系统具有广泛的保护作用,其在改善心肌能量代谢、增强心肌收缩力方面表现出了巨大的治疗潜力[5-7]。然而,黄芪甲苷在缓解DCM心肌损伤中的具体作用机制尚未完全阐明[8-9]。2021 年8 月—2022 年2 月,本研究观察了黄芪甲苷对DCM 小鼠心脏损伤的治疗作用,并进一步探究其潜在的分子机制。现报告如下。
1 材料与方法
1.1 材料 实验动物:8 周龄SPF 级雄性C57BL/6小鼠60 只,饲养于清洁级环境中,购自空军军医大学实验动物中心,使用许可证号:SYXK(军)2012-0022。药物:黄芪甲苷(批号:JZ15030401)购自南京景竹生物科技有限公司。主要试剂:PI3K 特异性抑制剂LY294002 购自美国Med Chem Express 公司,TUNEL 凋亡检测试剂盒购自瑞士Roche 公司,超氧化物阴离子荧光探针(DHE)检测试剂盒购自美国Invitrogen 公司,乳酸盐脱氢酶(LDH)、肌酸激酶(CK-MB)、肌钙蛋白T(cTnT)、丙二醛(MDA)、谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒均购自南京建成生物工程研究所,抗磷酸化磷脂酰肌醇3 激酶(p-PI3K)、PI3K、磷酸化蛋白激酶B(p-Akt)、Akt 和β-actin 抗体均购自于美国Abcam 公司;PCR 引物由沈阳鼎国昌盛生物技术有限责任公司设计合成。
1.2 动物分组及处理方法 将60 只C57BL/6 小鼠随机均分为Sham 组、DCM 组、AS-Ⅳ组和AS-Ⅳ+LY组,每组15只。Sham组正常喂养,除Sham组外均采用腹腔注射链脲佐菌素(STZ)的方法诱导建立DCM模型,方法如下:小鼠以高脂饮食喂养4 周后,连续2 d 腹腔注射STZ 50 mg/(kg·d);使用血糖仪检测空腹血糖水平,以空腹血糖>11.1 mmol/L 定义为DCM建模成功。建模后DCM 组小鼠继续给予高脂饮食喂养,AS-Ⅳ组小鼠高脂饮食喂养的同时给予AS-Ⅳ50 mg/(kg·d)灌胃,AS-Ⅳ+LY 组小鼠高脂饮食喂养的 同 时 给 予AS-Ⅳ50 mg/(kg·d)+LY294002 0.3 mg/(kg·d)灌胃,共8周。
1.3 指标观察方法
1.3.1 心脏功能 各组分组处理8 周后,采用Vevo 2100高分辨率成像系统进行超声心动图检查,记录左心室射血分数(LVEF)、左心室缩短分数(LVFS)和左心室收缩末期内径(LVIDs)。
1.3.2 血清心肌损伤标志物LDH、CK-MB、cTnT 水平 各组心脏功能检查完成后实施安乐死,获得心脏(一部分液氮冷冻保存,一部分4%多聚甲醛固定后石蜡包埋)及静脉血约1 mL。将静脉血在4 ℃条件下3 000 r/min 离心20 min,收集上清。参照试剂盒说明书,使用紫外分光光度仪测定血清LDH、CKMB、cTnT水平。
1.3.3 心肌组织纤维化情况 采用Masson 染色。取各组小鼠心脏组织石蜡包块,5µm 厚切片。使用Masson 三色染色试剂盒进行染色,存活心肌被染成红色、胶原纤维被染成蓝色。显微镜下观察各组心肌组织纤维化情况,并采用Image J 软件测量纤维化面积百分比。
1.3.4 心肌组织细胞凋亡情况 采用TUNEL 染色。将各组上述制备的心脏组织切片经脱蜡、水合后,滴加蛋白酶K 工作液进行细胞打孔。按TUNEL染色试剂盒说明书,避光依次滴加TUNEL 染液,待反应终止后加入抗荧光猝灭液封片。通过荧光显微镜观察心肌细胞凋亡情况,每组随机选取5 个不重叠视野,计算细胞总数(蓝色)和凋亡细胞数(绿色)。细胞凋亡百分比=凋亡细胞数/细胞总数×100%。
1.3.5 心肌组织活性氧(ROS)表达 采用DHE 染色。将各组上述制备的心肌组织切片经脱蜡、水合后,按照DHE检测试剂盒说明书避光滴加DHE反应液,PBS 溶液洗片后置于激光共聚焦显微镜下观察并采集图像。每组随机选取5 个不重叠视野,采用Image J 软件分析切片荧光强度,以此表示ROS 表达水平。
1.3.6 心肌组织氧化应激相关指标MDA、GSH、GSH-Px表达 取各组液氮冻存的心脏组织,用生理盐水按重量体积比为1∶9 制成组织匀浆液,离心后取上清。按照MDA、GSH、GSH-Px 试剂盒说明书滴加样品,使用紫外分光光度仪检测特定波长下的光密度值,以此表示MDA、GSH、GSH-Px表达水平。
1.3.7 心肌组织炎症因子mRNA 表达 采用实时荧光定量PCR 法。取各组液氮冷存的心脏组织,采用RNeasy Mini 试剂盒提取心脏组织总RNA,Prime⁃ScriptTMRT Reagent 试剂盒合成cDNA。采用TB Green Advantage qPCR 预混物建立实时PCR,肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、趋化因子单核细胞趋化蛋白1(MCP-1)及内参GAPDH 基因引物序列见表1,在快速实时PCR 系统中进行实时PCR 操作。采用2-ΔΔCt法计算目的基因相对表达量。

表1 心肌组织炎症因子TNF-α、IL-1β、IL-6、MCP-1及内参GAPDH的基因引物序列
1.3.8 心肌组织PI3K/Akt 信号通路相关蛋白表达 采用Western blotting 法。取各组液氮冻存的心肌组织,使用RIPA 裂解缓冲液提取心肌组织总蛋白。将各组蛋白样本按照每孔30 µg 加样,用SDS-PAGE 配置的凝胶进行电泳,然后转移到PVDF 膜上。5%脱脂牛奶封闭后,加入p-PI3K、PI3K、p-Akt、Akt 和内参β-actin 一抗(稀释比例为1∶2 000),4 ℃孵育过夜。次日,经TBST 洗涤液摇洗后,将膜与相应的酶标二抗(稀释比例为1∶5 000)在室温下孵育1 h。采用ECL 底物检测试剂盒检测免疫反应条带。利用Image J 软件分析条带灰度值,计算目的蛋白相对表达量及p-PI3K/PI3K、p-Akt/Akt。
1.4 统计学方法 采用Graph Pad Prism 统计软件。计量资料采用Shapiro-Wilk 正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠心脏功能相关指标比较 与Sham组和AS-Ⅳ组比较,DCM 组和AS-Ⅳ+LY 组小鼠LVEF、LVFS均降低,LVIDs均升高(P均<0.01)。见表2。
表2 各组小鼠LVEF、LVFS和LVIDs比较(±s)

表2 各组小鼠LVEF、LVFS和LVIDs比较(±s)
注:与Sham 组比较,*P<0.01;与DCM 组比较,#P<0.01;与AS-Ⅳ组比较,△P<0.01。
?
2.2 各组小鼠血清心肌损伤标志物水平比较 与Sham 组和AS-Ⅳ组比较,DCM 组和AS-Ⅳ+LY 组小鼠 血 清LDH、CK-MB、cTnT 水 平 均 升 高(P均<0.01)。见表3。
表3 各组小鼠血清LDH、CK-MB和cTnT水平比较(±s)

表3 各组小鼠血清LDH、CK-MB和cTnT水平比较(±s)
注:与Sham组比较,*P<0.01;与DCM组比较,#P<0.01;与AS-Ⅳ组比较,△P<0.01。
?
2.3 各组小鼠心肌组织纤维化情况及纤维化面积百分比比较 Masson 染色结果显示,与Sham 组和AS-Ⅳ组比较,DCM 组和AS-Ⅳ+LY 组小鼠心肌组织胶原纤维蓝色着色明显加重,纤维化面积百分比明显增加;Sham 组和AS-Ⅳ组小鼠心肌组织纤维化面积相近,DCM 组和AS-Ⅳ+LY 组小鼠心肌组织纤维化面积相近;见OSID 码图1。Sham 组、DCM 组、AS-Ⅳ组、AS-Ⅳ+LY 组小鼠心肌组织纤维化面积百分比分别为2.56% ± 1.42%、14.40% ±2.22%、5.38% ± 1.26%、15.30% ± 1.61%;与Sham组 和AS-Ⅳ组 比较,DCM 组 和AS-Ⅳ+LY 组小 鼠心肌组织纤维化面积百分比均升高(P均<0.01)。
2.4 各组小鼠心肌组织细胞凋亡情况比较Sham 组、DCM 组、AS-Ⅳ组、AS-Ⅳ+LY 组小鼠心肌组织细胞凋亡百分比分别为3.70% ± 1.47%、19.94% ± 3.27%、7.64% ± 1.69%、19.08% ±2.42%;与Sham 组和AS-Ⅳ组比较,DCM 组和AS-Ⅳ+LY 组小鼠心肌组织细胞凋亡百分比均升高(P均<0.01)。各组小鼠心肌组织细胞凋亡情况,见OSID 码图2。
2.5 各组小鼠心肌组织TNF-α、IL-1β、IL-6、MCP-1 mRNA 表达比较 与Sham 组和AS-Ⅳ组比较,DCM 组和AS-Ⅳ+LY 组小鼠心肌组织TNF-α、IL-1β、IL-6、MCP-1 mRNA 相对表达量均升高(P均<0.01)。见表4。
表4 各组小鼠心肌组织TNF-α、IL-1β、IL-6、MCP-1 mRNA相对表达量比较(±s)
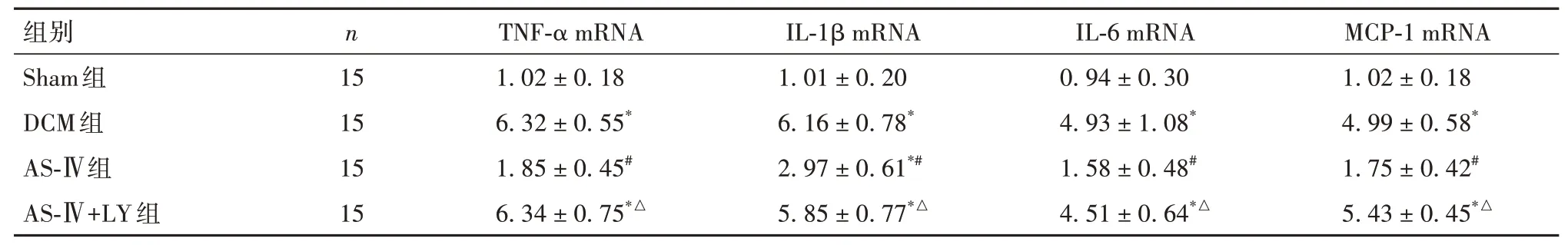
表4 各组小鼠心肌组织TNF-α、IL-1β、IL-6、MCP-1 mRNA相对表达量比较(±s)
注:与Sham组比较,*P<0.01;与DCM组比较,#P<0.01;与AS-Ⅳ组比较,△P<0.01。
?
2.6 各组小鼠心肌组织ROS、MDA、GSH、GSH-Px比较 与Sham组比较,DCM组、AS-Ⅳ组、AS-Ⅳ+LY组小鼠心肌组织ROS表达均升高,以DCM组、AS-Ⅳ+LY组升高更明显(P均<0.01);与Sham组、AS-Ⅳ组比较,DCM组、AS-Ⅳ+LY组小鼠心肌组织MDA均升高、GSH和GSH-Px均降低(P均<0.01)。见表5。
表5 各组小鼠心肌组织ROS、MDA、GSH和GSH-Px比较(±s)
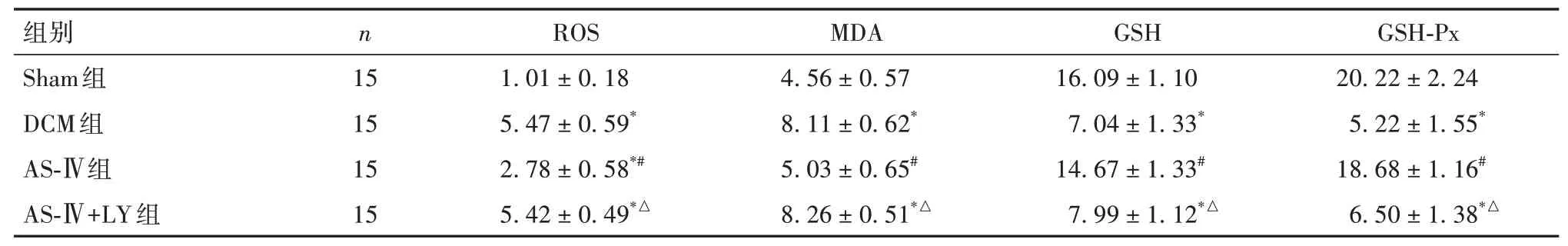
表5 各组小鼠心肌组织ROS、MDA、GSH和GSH-Px比较(±s)
注:与Sham组比较,*P<0.01;与DCM组比较,#P<0.01;与AS-Ⅳ组比较,△P<0.01。
?
2.7 各组小鼠心肌组织p-PI3K、PI3K、p-Akt、Akt蛋白及p-PI3K/PI3K、p-Akt/Akt 比较 与Sham 组、AS-Ⅳ组比较,DCM 组、AS-Ⅳ+LY 组小鼠心肌组织p-PI3K、p-Akt 蛋白及p-PI3K/PI3K 和p-Akt/Akt 均降低(P均<0.01),PI3K、Akt 蛋白无明显变化(P均>0.05)。见表6、图1。

图1 各组小鼠心肌组织p-PI3K、PI3K、p-Akt、Akt蛋白表达(Western blotting法)
表6 各组小鼠心肌组织p-PI3K、PI3K、p-Akt、Akt蛋白及p-PI3K/PI3K、p-Akt/Akt比较(±s)
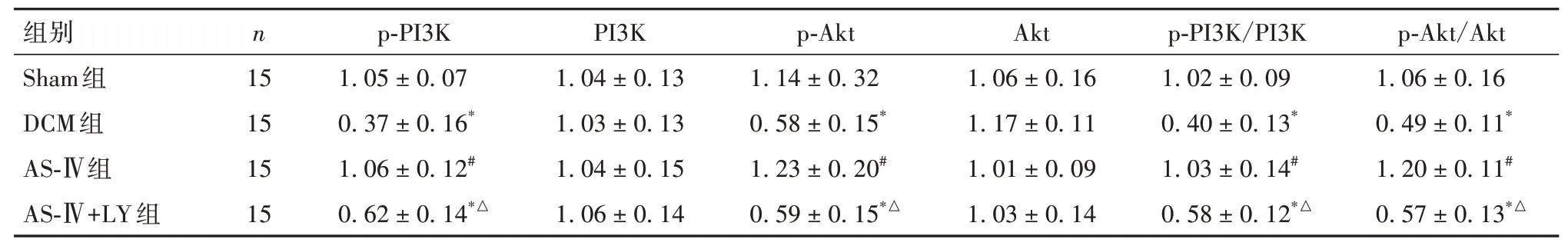
表6 各组小鼠心肌组织p-PI3K、PI3K、p-Akt、Akt蛋白及p-PI3K/PI3K、p-Akt/Akt比较(±s)
注:与Sham组比较,*P<0.01;与DCM组比较,#P<0.01;与AS-Ⅳ组比较,△P<0.01。
?
3 讨论
DCM 是发生于糖尿病患者的一种严重的不可逆性慢性心血管并发症,表现为心肌纤维化、心肌肥厚、收缩功能不全等,并最终可能进展为心力衰竭[10]。DCM 的发生主要是由于在高血糖环境中自由基产生增加,导致线粒体受损及细胞凋亡、心肌细胞纤维化增加[2]。心脏功能受损是DCM 的终末期事件之一,严重影响糖尿病患者的预后[11]。近年来有研究从黄芪中分离得到皂苷类化合物黄芪甲苷,并证实其在心血管系统相关疾病的治疗中表现出了广泛的心脏保护作用,可以明显改善多种致病因素导致的心功能障碍[12-13]。本研究结果显示,与Sham组比较,DCM 组小鼠LVEF、LVFS 均降低,LVIDs 和血清LDH、CK-MB、cTnT 水平均升高;与DCM 组比较,AS-Ⅳ组小鼠LVEF、LVFS 均升高,LVIDs 和血清LDH、CK-MB、cTnT水平均降低;这说明DCM 小鼠心脏功能明显受损,而黄芪甲苷可以显著减轻DCM 小鼠的心脏损伤,具有心脏保护作用。
DCM 患者中心肌细胞凋亡及心肌组织纤维化的进展是导致心脏重构、继而引起心脏功能障碍的重要原因之一[14]。本研究结果显示,与Sham 组比较,DCM 组小鼠心肌组织纤维化面积百分比和细胞凋亡百分比增加;与DCM 组比较,AS-Ⅳ组小鼠心肌组织纤维化面积百分比和细胞凋亡百分比降低;证实黄芪甲苷可显著减轻DCM 小鼠的心肌组织纤维化及细胞凋亡。
氧化应激损伤被认为是糖尿病患者心血管并发症发生发展的主要元凶之一[15]。氧化应激是指氧自由基产生过多,与抗氧化剂生成不足同时存在的一种不平衡的代谢状态,是炎症的主要驱动力。高血糖和代谢异常可刺激机体中ROS 产生过量,导致DNA、蛋白质和脂质等生物分子受损,进而诱导细胞功能障碍或凋亡,导致心脏慢性炎症和间质纤维化,最终引起DCM 的发生发展[16-17]。炎症反应加重是DCM 的另一个主要发病机制,在Ⅰ型和Ⅱ型糖尿病患者及动物模型中普遍存在。与此同时,糖尿病患者心脏中大量的炎症细胞和促炎症因子又会进一步放大促炎反应,继而共同加速心肌细胞凋亡和心肌纤维化过程,导致糖尿病心脏结构和功能的改变[18-19]。本研究结果显示,与Sham 组比较,DCM 组小鼠心肌组织TNF-α、IL-1β、IL-6、MCP-1 mRNA 及ROS、MDA 表达均显著增加,GSH 和GSH-Px 表达显著降低;与DCM 组相比,AS-Ⅳ组小鼠心肌组织炎症及氧化应激相关指标均明显降低;这表明黄芪甲苷是通过抑制心肌氧化应激和炎症反应发挥心肌保护作用的。
PI3K/Akt 信号通路是一条在生物生长和关键细胞过程中发挥核心作用的信号通路,被视为调节细胞存活的最关键信号通路之一,p-PI3K/PI3K、p-Akt/Akt 可用于评价PI3K/Akt 通路的磷酸化程度,比值升高提示该通路被激活[20]。研究表明,激活PI3K/Akt 信号通路可以抑制内质网应激和细胞凋亡、改善能量代谢、减少炎症反应和氧化应激,在心肌保护过程中发挥关键作用[21-23]。本研究结果显示,与Sham组相比,DCM组小鼠心肌组织p-PI3K、p-Akt 蛋白表达均降低,p-PI3K/PI3K 和p-Akt/Akt 均减小,这提示DCM 组小鼠心肌组织PI3K/Akt 信号通路被抑制;与DCM 组相比,AS-Ⅳ组小鼠心肌组织p-PI3K、p-Akt蛋白表达均显著升高,p-PI3K/PI3K 和p-Akt/Akt 均明显增加,而AS-Ⅳ+LY 组小鼠心肌组织p-PI3K、p-Akt 蛋白表达均无明显变化;这提示黄芪甲苷发挥抗DCM 所致心肌损伤的作用与其激活PI3K/Akt信号通路有关;而给予PI3K特异性抑制剂LY294002 处理不仅逆转了黄芪甲苷对PI3K/Akt 信号通路的激活作用,同时也抵消了上述黄芪甲苷对DCM小鼠的心脏保护效果。
综上所述,黄芪甲苷可通过激活PI3K/Akt 信号通路,抑制心肌氧化应激和炎症反应,从而减轻心肌细胞凋亡和心肌组织纤维化,最终抑制DCM 小鼠的心肌损伤而发挥心脏保护作用。本研究为临床上将黄芪甲苷应用于心血管相关疾病的治疗提供了新的思路。

