甘肃省严重急性呼吸系统综合征冠状病毒2 Delta变异株感染患者的临床特征分析
魏继芳,岳红梅,2,刘南玉,宋佩佩,谢莹莹,王嘉琪,魏雅倩
1 兰州大学第一临床医学院,兰州 730000;2 兰州大学第一医院呼吸与危重症医学科
新型冠状病毒肺炎(COVID-19)是一种由β 属RNA 冠状病毒所引起的急性呼吸道传染病,传染性强,人群普遍易感。在当前的大流行期间,严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)的基因组已经发生了各种突变[1]。Delta 变异株于2020 年10月在印度被确认,此后在印度和英国的一些地区占据主导地位,并蔓延到其他国家[2]。与其他变种相比,Delta 变异株传染力强、病毒载量高、潜伏期短、病程进展快[3]。为深入研究Delta 变异株感染者的临床特征,本研究对甘肃省确诊的88例野生株感染患者和141 例Delta 变异株感染患者的临床资料进行回顾性对比分析,为Delta变异株的防治提供参考依据。
1 资料与方法
1.1 临床资料 回顾性收集2021 年10 月—2022年1 月甘肃省确诊的141 例Delta 变异株感染患者(变异株组)的临床资料,同时收集2020 年1 月—3月甘肃省COVID-19 诊疗定点医院确诊的88 例野生株感染患者(野生株组)的临床资料。COVID-19 的诊断标准、严重程度分型及出院标准均严格参照国家卫生健康委员会办公厅和国家中医药管理局办公室联合印发的《新型冠状病毒肺炎诊疗方案(试行第八版修订版)》[4]。
1.2 资料收集方法 收集两组入院时的一般资料(性别、年龄、合并基础疾病、分型、疫苗接种情况)、临床症状(发热、咳嗽、咳痰等)、实验室检查[白细胞(WBC)、淋巴细胞(LYM)、血小板(PLT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸基转移氨酶(AST)、谷氨酰转肽酶(GGT)、乳酸脱氢酶(LDH)、血尿素氮(BUN)、血肌酐(Cr)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、降钙素原(PCT)、国际标准化比率(INR)、C 反应蛋白(CRP)]、影像学检查(CT 或DR检查)、治疗方案、转归[LYM 恢复时间、肺部病灶吸收时间、血氧饱和度(SaO2)恢复(≥95%)时间、核酸转阴时间、住院时间]及预后情况(出院或死亡)。
1.3 统计学方法 采用SPSS26.0 统计软件。计量资料采用偏度—峰度正态性检验,呈正态分布以-x±s表示,组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,组间比较采用秩和检验。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 变异株组男65 例(46.1%)、女76 例(53.9%),年龄39.0(25.0,58.5)岁,合并疾病:高血压23 例(16.3%)、糖尿病5 例(3.5%)、肺部疾病8 例(5.7%)、心血管疾病4 例(2.8%)、消化系统疾病0 例、肝病4 例(2.8%)、肾病2 例(1.4%)、脑 梗死3 例(2.1%)、脑 出血2 例(1.4%)、甲状腺功能亢进1 例(0.7%)、其他7 例(5.0%),临床分型:轻型+普通型115例(81.6%)、重型24 例(17.0%)、危重型2 例(1.4%),疫苗接种:0 剂次18 例(12.8%)、1 剂次6 例(4.3%)、2 剂次111例(78.7%)、3 剂次3 例(2.1%)、不详3 例(2.1%)。野生株组男39 例(44.2%)、女49 例(55.8%),年龄41.0(29.0,54.75)岁,合并高血压6 例(6.8%)、糖尿病4 例(4.5%)、肺部疾病2 例(2.3%)、心血管疾病1例(1.1%)、消化系统疾病2例(2.3%)、肝病1例(1.1%)、肾病1例(1.1%)、脑梗死1例(1.1%)、脑出血0 例、甲状腺功能亢进1 例(1.1%)、其他9 例(10.2%),临床分型:轻型+普通型67例(76.1%)、重型16 例(18.2%)、危重型5 例(5.7%),野生株组均未接种疫苗,变异株组合并高血压及接种疫苗的比例均高于野生株组(P均<0.05),两组其他一般资料比较P均>0.05。
2.2 两组临床症状比较 变异株组发热52 例(36.9%)、咳嗽74 例(52.5%)、咳痰37 例(26.2%)、咽痛29 例(20.6%)、咽干24 例(17.0%)、咽痒16 例(11.3%)、乏力8 例(5.7%)、肌肉酸痛8 例(5.7%)、头晕头痛15 例(10.6%)、胸闷气短8 例(5.7%)、腹泻6 例(4.3%)、鼻塞流涕20 例(14.2%)、嗅觉障碍3例(2.1%)、味觉障碍1 例(0.7%)、舌体麻木1 例(0.7%),野生株组分别为52 例(59.1%)、52 例(59.1%)、17 例(19.3%)、18 例(20.5%)、20 例(22.7%)、2 例(2.3%)、27 例(30.7%)、19 例(21.6%)、16 例(18.2%)、15 例(17.0%)、2 例(2.6%)、10 例(11.4%)、0 例;变异株组发热、乏力、肌肉酸痛、胸闷气短比例均低于野生株组,咽痒比例高于野生株组(P均<0.05)。
2.3 两组实验室检查相关指标比较 变异株组WBC<4.0×109/L、PLT<100×109/L、GGT>50.0 U/L、LDH>240.0 U/L、BUN>7.1 mmol/L、INR>1.13 的比例均低于野生株组,AST>40 U/L的比例均高于野生株组(P均<0.05);两组其他实验室检查相关指标比较P均>0.05。见表1。
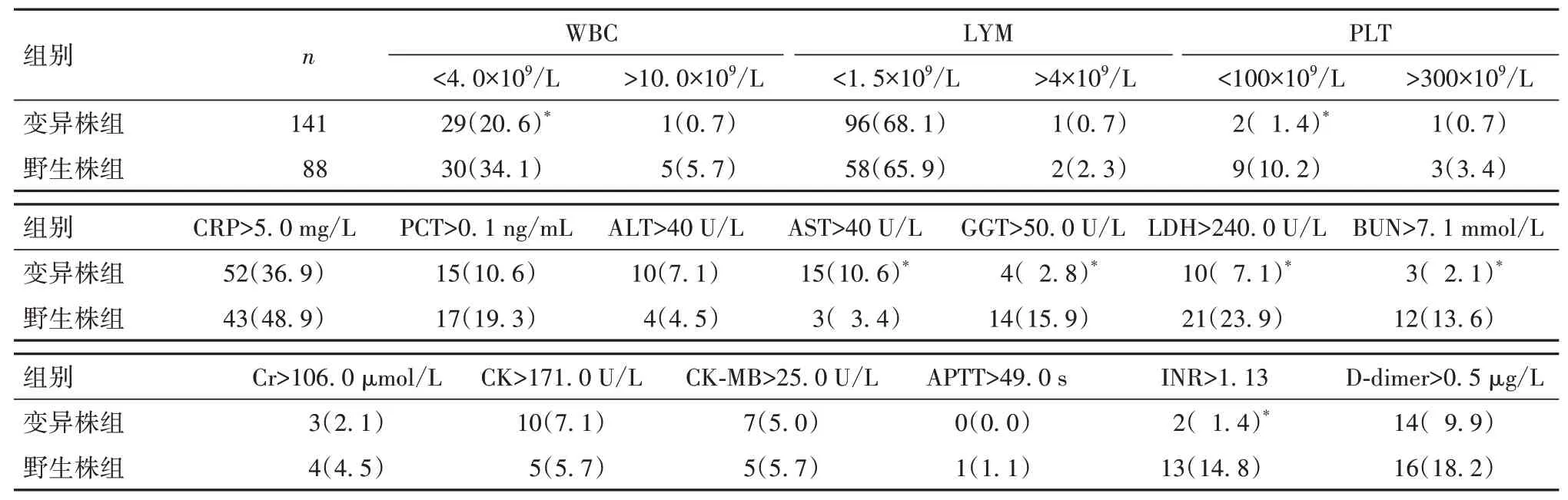
表1 两组实验室检查相关指标比较[例(%)]
2.4 两组影像学检查相关指标比较 变异株组胸部CT异常90例(63.8%),野生株组80例(90.9%),两组比较P<0.05。野生株组病变在左侧11 例(12.5%)、右侧15例(17.0%)、双侧54例(67.5%),变异株组分别为15例(10.6%)、26例(18.4%)、49例(34.8%),变异株组双侧病变的比例明显低于野生株组(P<0.05)。野生株组病变累及1个肺叶22例(25.0%)、2个肺叶15例(17.0%)、3个及以上肺叶43例(48.9%),变异株组 分 别 为35 例(24.8%)、25 例(17.7%)、30 例(21.3%),变异株组病变累及3个肺叶及以上病变的比例明显高于野生株组(P<0.05)。
2.5 两组治疗方案比较 野生株组给予干扰素82例(93.2%)、利巴韦林42 例(47.7%)、洛匹那韦/利托那韦78 例(88.6%)、抗生素53 例(60.2%)、糖皮质激素31 例(35.2%)、免疫球蛋白11 例(12.5%)、血必净24 例(27.3%)、阿比多尔片14 例(15.9%)、吸氧治疗59例(67.0%),变异株组分别为0例、0例、0 例、3 例(2.1%)、1 例(0.7%)、0 例、0 例、0 例、41 例(29.1%),变异株组均低于野生株组(P均<0.05)。野生株组给予俯卧位通气0 例、抗凝0 例、中和抗体0 例、胸腺法新0 例,变异株组分别为116 例(83.0%)、85 例(60.3%)、49 例(34.8%)、55 例(39.0%),变异株组均高于野生株组(P均<0.05)。野生株组给予中药方剂88 例(100.0%)、机械通气5 例(5.7%)、保肝10 例(11.4%),变异株组分别为139例(98.6%)、3例(2.1%)、17例(12.1%),两组比较P均>0.05。
2.6 两组转归与预后相关指标比较 野生株组出院时35 例(53.0%)LYM 未恢复到正常水平。两组LYM 恢复时间、肺部病灶吸收时间、核酸转阴时间比较差异均无统计学意义(P均>0.05)。变异株组SaO2恢复时间短于野生株组,住院时间长于野生株组(P均<0.05)。见 表2。野 生 株 组 死 亡2 例(2.3%),变异株组死亡0例,两组比较P>0.05。

表2 两组转归相关指标比较[M(P25,P75)]
3 讨论
COVID-19 具有高度异质性,患者的临床表现可以从无症状、轻型到危重型,甚至可能导致死亡。年龄、性别和合并症在内的宿主因素是COVID-19严重程度和疾病进展的关键决定因素[5]。本研究结果显示,两组主要表现均为发热和咳嗽,变异株组发热、肌肉酸痛、乏力等全身症状较野生株组少,但少数患者出现味觉减退、嗅觉减退、舌体麻木等症状。这表明Delta 变异株毒力更强,可一过性损伤患者的味觉和嗅觉功能。SARS-CoV-2 引起的急性呼吸窘迫综合征(ARDS)与其他病毒或细菌引起的严重社区获得性肺炎的病理过程相似,即早期促炎细胞因子过度产生,一部分患者的感染指标如CRP、白细胞介素6(IL-6)、淀粉样蛋白A(SAA)等明显升高[6]。本研究两组CRP、PCT 比较差异无统计学意义,提示两组炎症反应程度无明显差异。研究表明,疫苗可明显减缓病毒进化,在避免严重症状、住院和降低病死率方面具有明显的优势。本研究虽然Delta 变异株毒力更强,但并未引起更严重的炎症反应,可能与变异株组疫苗接种覆盖率高有关[7-8]。
COVID-19 在中医上属于“寒湿疫”,中药在抗感染、退热、缩短病程和提高疗效等方面取得了显著效果,本研究两组基本都接受了中药方剂治疗[9]。虽然两组D-dimer 升高比例比较无显著差异,但目前指南提出对所有COVID-19 患者给予低分 子 量 肝 素 以 预 防 血 栓[10],故 变 异 株 组85 例(60.3%)接受了抗凝治疗。另外,变异株组55 例(39.0%)接受了胸腺法新增强免疫治疗,有助于提高患者的T 淋巴细胞功能。研究表明,胸腺肽α1可逆转成人重症COVID-19 患者的LYM 和T 淋巴细胞比例降低,并有助于降低病死率[5]。疫苗可激发强大的体液和细胞免疫,并诱导大量抗体来减弱病毒感染,在患者病程早期即迅速产生IgG 抗体[11]。中和抗体是一种被动免疫疗法,可以最大限度地降低毒力[12]。因此,绝大多数Delta 毒株感染患者的IgG抗体在输注中和抗体后1 d 内可迅速增长到100 g/L 以上。变异株组吸氧治疗比例低于野生株组,但SaO2恢复时间明显缩短,可能与其接受俯卧位通气有关。
LYM 减少是COVID-19 的一个临床特征,据报道63%的COVID-19 患者存在LYM 减少,LYM 下降程度是预测COVID-19 严重程度的可靠指标[10]。本研究发现,两组LYM 恢复时间比较差异无统计学意义,但野生株组出院时35 例(53.0%)LYM 未恢复到正常水平,故野生株组LYM 恢复时间应该更长。COVID-19 患者多存在双侧受累、多灶性磨玻璃样混浊、呈周边分布等CT 影像特征,超过一半的患者有多叶受累,病变更常见于下叶,胸腔积液、心包积液、空洞、胸腔淋巴结肿大和肺气肿少见[12]。Delta 变异株对宿主血管紧张素转化酶2(ACE2)具有更强的结合亲和力,且P681R 突变可加速病毒融合,这都可导致Delta 变异株的传染性增强以及病毒载量升高;但本研究变异株组肺部炎症累及范围没有野生株组广泛,有32 例整个病程中并未出现肺部炎症病灶,可能归功于疫苗的保护作用;两组胸部病灶吸收时间比较无统计学差异,可能与Delta变异株的病毒清除较慢有关[13]。但是目前尚没有研究对比野生株和Delta 变异株在肺部的复制能力,肺部病变的严重程度和吸收时间不同与两组毒株在肺部的复制能力是否有关尚有待进一步研究。变异株组住院时间更长,可能是由病毒载量高和病毒脱落时间长导致[14]。
综上所述,Delta 变异株感染患者以轻型、普通型为主,疫苗接种覆盖率高,肺部病变累及范围较野生株感染患者小,SaO2恢复时间缩短,但住院时间较长,经吸氧治疗、中药、免疫增强等常规治疗后预后良好。本研究病例来源存在一定的地区特点,且样本量不是很大,尤其是重型和危重型病例数量较少。疫苗接种是预防与SARSCoV-2 相关的感染、疾病重症和死亡的关键策略,但本研究变异株组疫苗接种覆盖率高,无法进行疫苗接种患者和未接种患者的临床特征对比。随着未来可能出现的各种SARS-CoV-2 变种,开发针对S 蛋白突变的靶向疫苗,并尽快终止COVID-19 大流行仍是一个巨大的挑战。除推广疫苗接种外,临床上同时应对疫苗接种后的突破性感染进行持续监测。

