接种与未接种新型冠状病毒疫苗Omicron变异株感染患者临床表现、肝功能、抗体水平对比观察
王媛,王景雨,李天宁,周春雷,穆红
天津市第一中心医院检验科国家卫健委危重病急救医学重点实验室,天津 300192
新型冠状病毒肺炎(COVID-19)是由严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)引起的一种急性呼吸道传染病。2021 年11 月9 日新冠病毒Omicron 变异株首次在博茨瓦纳被发现,之后在南非发生群体感染,并传播至全球各地,成为全球优势流行株,并引起广泛关注[1]。随着SARS-CoV-2 在传播中不断发生变异和进化,Omicron 变异株成为继Delta 变异株后传染性更强且对当前疫苗中和抗体抵抗力更高的变异株,这对全球COVID-19 疫情防控提出了新的挑战[2]。我国于2021 年12 月14 日首次报告了Omicron 变异株感染的病例,为天津市境外输入COVID-19 无症状感染者[3]。之后2022 年1月8 日国内本土感染Omicron 变异株的病例在天津被确诊,这是中国内地首次出现Omicron 变异株的本土传播链,该病毒传染能力更强、免疫逃逸能力更高[4]。本文通过回顾性分析天津市感染新冠病毒Omicron 变异株的恢复期患者的临床资料,观察不同疫苗接种对Omicron 变异株感染患者临床表现及肝功能的影响。现报告如下。
1 资料与方法
1.1 临床资料 选择2022 年1 月—2 月天津市第一中心医院收治的Omicron 变异株感染恢复期COVID-19 患者430 例作为研究对象,其诊断和临床分型均参照国家卫生健康委员会办公厅印发的《新型冠状病毒肺炎诊疗方案(试行第八版)》。430 例患者中,男192 例、女238 例,年龄36(14,55)岁,临床分型:普通型216 例、轻型205 例、无症状感染者7 例、重症2 例,合并疾病:高血压87 例、糖尿病41例、冠心病25例、慢性呼吸道疾病14例、慢性肝脏疾病8 例、慢性肾脏疾病6 例、恶性肿瘤5 例,全身症状:发热88 例、乏力35 例、干咳102 例,呼吸系统症状:鼻塞34例、流涕29例、咽痛50例,其他症状:结膜炎9 例、味觉异常3 例、嗅觉异常2 例、腹泻1 例。根据接种疫苗的来源情况分为5组,其中接种科兴疫苗150例(科兴组),接种北京生物疫苗185例(北京生物组),接种康希诺疫苗41例(康希诺组),接种安徽智飞、长春生物、兰州生物、山东生物、其他腺病毒载体疫苗以及混合接种16例(其他组),未接种疫苗38例(未接种组)。本研究经天津市第一中心医院医学伦理委员会审核通过,患者均签署知情同意书。
1.2 资料采集方法 通过天津市第一中心医院HIS系统采集各组患者的性别、年龄、末次接种疫苗至入院时间、疫苗接种剂次等一般资料,以及入院时的临床症状、肝功能相关指标[天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TB)、白蛋白(ALB)、总蛋白(TP)、乳酸脱氢酶(LDH)]以及抗体(IgG、IgM)水平(化学发光法检测)。
1.3 统计学方法 采用SPSS16.0 及GraphPad Prism 8 统计软件。计量资料采用Kolmogorov-Smirnov 正态性检验,呈正态分布以±s表示,多组间比较采用方差分析,组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,多组间比较采用Kruskal-Wallis 秩和检验,两组间比较采用Mann-WhitneyU检验。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组性别、年龄及末次接种疫苗至入院时间比较 科兴组男63 例、女87 例,北京生物组分别为93、92 例,康希诺组分别为16、25 例,其他组分别为6、10例,未接种组分别为14、24例,各组性别构成比比较P均>0.05。科兴组、北京生物组、康希诺组、其他组、未接种组年龄分别为42(31,58)、23(10,45)、48(35,58)、45(32,57)、31(3,65)岁,北京生物组年龄明显低于其他组(P均<0.01)。科兴组末次接种疫苗至入院时间<3 个月73 例(48.67%)、3~6 个月32 例(21.33%)、>6 个月45 例(30.00%),北京生物组分别为137 例(74.05%)、26 例(14.05%)、22 例(11.89%),康希诺组分别为31 例(75.61%)、0 例、10 例(24.39%),其他组分别为4 例(25.00%)、5 例(31.25%)、7 例(43.75%),北京生物组、康希诺组末次接种疫苗至入院时间<3 个月的比例明显高于科兴组及其他组(P均<0.01)。
2.2 各组不同疫苗接种剂次患者的临床分型比较 科兴组接种第三针(加强针)的比例为59.33%,北京生物组为36.76%,康希诺组为75.61%。科兴组普通型与轻型比例为1∶0.64(91/58),北京生物组为1∶1.80(64/115),康希诺组为1∶0.58(26/15),其他组为1∶0.14(14/2),未接种组为1∶0.80(20/16),北京生物组轻型患者比例明显高于其他组(P均<0.01)。见表1。
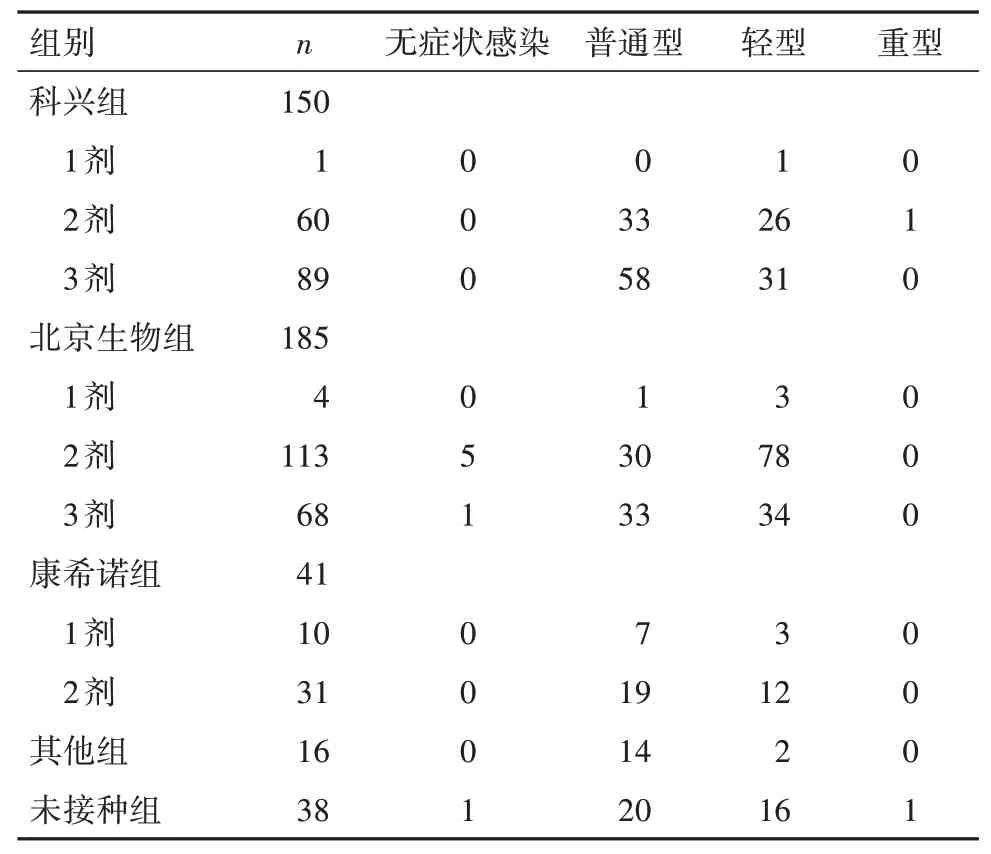
表1 各组不同疫苗接种剂次患者的临床分型(例)
2.3 各组年龄<16 岁不同疫苗接种剂次患儿的临床分型情况 年龄<16 岁的患儿共110 例,科兴组、北京生物组、康希诺组、其他组、未接种组分别为7、88、0、1、14 例,无症状感染6 例、普通型13 例、轻型91 例、重型0 例。各组年龄<16 岁不同疫苗接种剂次患儿的临床分型见表2。

表2 各组年龄<16岁不同疫苗接种剂次患儿的临床分型(例)
2.4 各组肝功能检查相关指标比较 因其他组例数过少(仅16例),不符合统计学计量资料例数要求,剔除本组。科兴组、北京生物组、康希诺组、未接种组ALT>40 U/L(ALT 异 常)的 患 者 分 别 为63 例(42.00%)、51 例(27.57%)、20 例(48.78%)、6 例(16.21%),北京生物组与未接种组ALT 异常率比较无统计学差异(P>0.05),科兴组、康希诺组ALT异常率均高于未接种组与北京生物组(P均<0.05)。科兴组、北京生物组、康希诺组、未接种组AST>35 U/L(AST 异常)的患者分别为44 例(29.33%)、42 例(22.70%)、10例(24.39%)、16例(42.11%),未接种组AST异常率均高于其他各组(P均<0.05)。各组AST、TP、TB比较差异均无统计学意义(P均>0.05)。科兴组及康希诺组ALT水平均高于北京生物组及未接种组,未接种组ALB 水平低于其他各组,北京生物组LDH高于科兴组及康希诺组(P均<0.05)。见表3。
表3 各组肝功能检查相关指标比较[±s/M(P25,P75)]
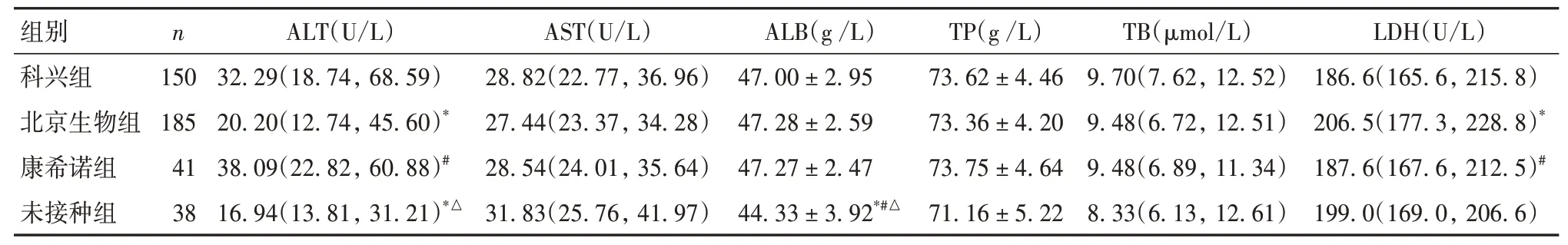
表3 各组肝功能检查相关指标比较[±s/M(P25,P75)]
注:与科兴组比较,*P<0.05;与北京生物组比较,#P<0.05;与康希诺组比较,△P<0.05。
?
2.5 各组IgG、IgM水平比较 未接种组IgG、IgM水平均明显低于科兴组、北京生物组、康希诺组(P均<0.05)。见表4。

表4 各组IgG、IgM水平比较[M(P25,P75)]
3 讨论
目前研究发现,由于Omicron 变异株刺突蛋白发生多处突变,相比武汉原始病毒株及其他关切变异株(VOC)的病毒传染能力明显提高[5]。2022 年1月8 日,天津此次Omicron 疫情以津南区为起始点,初步发现2 例本土确诊病例感染SARS-CoV-2 Omi⁃cron 变异株后传播开来,鉴于其中1 例确诊病例为托辅机构工作人员,因其工作性质导致病毒在托辅班的学生及家长中迅速传播;因此,此次疫情传播途径主要为家庭聚集发病及社区传播,并且儿童感染率较高(25.58%)。在本研究纳入的430 例Omicron变异株感染患者中,临床分型主要以轻型和普通型为主,这与欧洲疾病与预防控制中心的报告相同。Omicron 变异株的变异及传染能力均增强,但是相对Delta(B.1.617.2)变异株其毒力减弱[4]。本次感染Omicron 变异株的患者临床症状较轻,主要为发热、干咳、鼻塞、流涕、咽痛等感染症状,腹泻、嗅觉或味觉丧失的患者较少。
目前研究表明,虽然疫苗对Omicron 变异株的保护效力比其他VOC 下降,但是对于预防重症及死亡病例的效果仍较好。本研究结果显示,接种北京生物疫苗的患者平均年龄较低,临床分型为轻型的比例更高。由于此次新冠病毒感染患者中儿童患者例数较多,进一步统计分析该年龄组接种疫苗的情况,结果发现<16 岁的儿童患者中80%接种了北京生物的疫苗,临床分型为轻型及无症状感染者较多(88.18%),这与其他研究报道一致[6]。本研究接种北京生物疫苗的患者临床分型主要为轻型,因此接种北京生物疫苗后轻型患者较多的原因可能与年龄因素有关。
本研究54.05%未接种疫苗的患者在感染新冠病毒Omicron 变异株后未出现IgG 水平升高,而接种科兴疫苗、北京生物疫苗、康希诺疫苗的患者IgG 水平均明显高于未接种患者,并且接种科兴疫苗和康希诺疫苗患者的IgG 水平高于接种北京生物疫苗的患者;这提示接种不同的疫苗均会提高新冠病毒感染患者体内的IgG 水平,使患者获得更好的免疫应答。此外,接种科兴疫苗及康希诺疫苗的患者接种加强针的比例较高,但是否接种加强针对患者的IgG 水平无明显影响,这可能与患者已经感染新冠病毒,并且疫苗有效发挥其保护作用、产生大量IgG抗体有关。由于缺失正常人群接种疫苗加强针后的抗体水平相关数据,因此无法明确接种疫苗加强针对普通人群抗体水平的影响。由于本研究缺少患者血清特异性中和Omicron 变异株抗体的实验室数据,因此对于评价疫苗对Omicron 变异株的临床效果仍有一定的局限性。同时,本研究显示未接种疫苗患者的IgM 水平低于接种科兴和北京生物疫苗患者,但各组IgM 水平总体均偏低,这也提示大部分患者已经为非急性感染期,参考价值不是很大[7]。
新冠病毒不同变异株可产生增强其免疫逃逸能力的突变,血清中和实验显示辉瑞疫苗(BNT162b2)、莫德纳疫苗(mRNA-1273)对不同变异株的中和抗体效价均有不同程度降低,而接种疫苗加强针可以提高针对变异株感染后中和抗体的保护能力[8-9]。研究报道,目前疫苗针对Omicron 变异株感染的保护效力降低,但接种疫苗加强针依旧可以显著增强机体免疫[10]。迄今为止,不同机构也进行了多种新冠病毒混合疫苗的相关研究,其中有研究表明,第1 针接种腺病毒载体疫苗(ChAdOx1-S),第2 针接种辉瑞疫苗(BNT162b2),可以更好地诱导体液和细胞免疫应答,且并未引起严重的不良反应[11-12]。因此,混合接种策略也正在被许多国家积极推动[9]。本研究混合接种疫苗的患者病例很少,且接种疫苗类型均为不同公司的灭活疫苗,因此关于混合接种疫苗的效果有待进一步深入研究。
COVID-19患者肝功能会出现不同程度的损伤,其可能的原因主要与新冠病毒的感染机制及药物性肝损伤有关[13]。研究发现,胆管细胞可以特异性高表达新冠病毒受体血管紧张素转化酶2(ACE2),而ACE2是新冠病毒感染细胞的受体,因此病毒直接与胆管细胞结合后,通过直接损伤或者进一步诱发炎症细胞因子风暴综合征(CSS),导致肝功能损伤[14-15]。NARDO 等[14]研究显示,造成COVID-19 患者肝损伤的原因可能包括新冠病毒的直接感染、全身炎症反应的间接参与、药物和通气等医源性因素以及基础慢性肝病的恶化等。由于新冠疫苗的接种会增强机体对病毒感染的抑制作用,因此本研究也初步探讨了接种不同疫苗对患者肝功能是否有影响。本研究结果显示,此次新冠病毒Omicron变异株感染后部分患者肝功能出现异常,其中接种北京生物疫苗的患者AST异常率低于未接种疫苗患者,ALT水平及异常率与未接种组无统计学差异,这提示接种北京生物疫苗可能使患者产生了大量的保护性IgG抗体,导致病毒的复制及增殖受到抑制,从而在一定程度上保护患者的肝功能。与接种北京生物疫苗不同的是,接种科兴及康希诺疫苗患者的AST异常率均低于未接种疫苗患者,而ALT 水平及异常率却均高于未接种疫苗者;分析导致其差异的原因可能是ALT 主要分布于肝细胞胞质内,肝内浓度比血清浓度高千倍,是提示肝脏损伤非常灵敏的指标,易受药物、乙醇等因素干扰[13,16-17],而AST 主要分布于肝细胞线粒体,少量分布于细胞质,因此AST 升高可提示不同程度的肝细胞损伤[18-19];此外,由于部分患者入院前后出现发热、干咳等症状,可能存在服用退热药物史等,还有部分患者入院前或入院后服用过抗病毒药物、抗菌药物以及不同成分的中药等,这也是导致患者ALT异常的重要原因之一。本研究各组间ALB、LDH水平有统计学差异,但是患者的ALB 及LDH 水平基本属于临床正常参考范围,异常率较低,无明显临床参考意义。CAI等[20]研究显示,21.5%的ALT和AST水平升高的COVID-19患者在住院期间出现肝损伤,而肝功能异常的患者进展为重症的风险会增加。由于目前新冠病毒影响肝损伤的机制尚不完全清楚,仍需在以后临床中进一步观察,患者若出现肝功能异常,需仔细分析引起肝损伤的原因,及时避免使用引起肝损伤的药物,加强护肝治疗。
综上所述,接种北京生物生产新冠病毒疫苗的Omicron 变异株感染患者的年龄较小、轻症比例较高、在一定程度上可保护患者的肝功能,接种不同新冠病毒疫苗后的患者感染新冠病毒后均可产生更高水平的IgG、IgM 抗体。但目前国内针对Omicron 变异株的相关研究仍有限,由于本研究收集的重型病例数较少且大部分患者已经接种不同类型的疫苗或在入组前已经服用影响肝功能的药物,因此仍存在一定的局限性。面对不断进化变异的新冠病毒,在疫情防控上应该加快推进全国人民的疫苗接种,坚持常态化疫情防控,保护易感人群。

