CEA、CYFRA21-1和NSE监测晚期肺腺癌免疫治疗中肿瘤反应研究
刘 恒 向绍华 王 庆
肿瘤的发生除肿瘤细胞自身存在众多的基因表达改变外,更是一个全身性疾病的局部反应,是生物体作为一个生物系统的整体平衡失调的结果。近年来的免疫治疗方法出现了具有高抗肿瘤反应的强大治疗选择。这些效果可以通过重定向、刺激或基因重组患者的免疫系统以靶向癌细胞来实现。血清生物学标志物如癌胚抗原(carcinoembryonic antigen,CEA)、细胞角蛋白片段19(CYFRA21-1)和神经特异性烯醇化酶(neuron specific enolase,NSE)作为肺腺癌(lung adenocarcinoma,LUAD)化疗患者的主要预后或预测标志物[1~3]。CEA是一种血清糖蛋白,目前是结直肠、乳腺肿瘤中应用最广泛的肿瘤标志物[4~6]。CYFRA21-1是肺组织中丰富的细胞角蛋白19片段,并且CYFRA21-1在类癌组织和肺鳞癌组织中含量较高,与肿瘤直径、淋巴结状态以及临床分期等具有一定相关性[7]。因此,CEA和CYFRA21-1已被证明为恶性肿瘤有价值的预后血清生物学标志物,可作为靶向治疗或化疗的疗效预测因子,并用于监测术后复发和转移风险的辅助评估[8]。NSE是一种在大脑组织中高水平表达的细胞质酶,主要在神经元和神经内分泌细胞中表达,是神经元损伤后出现的一种特异性的血清生物学标志物,具有较高的特异性(85%),并对肺腺癌患者的生存预后、治疗和复发监测等均具有价值[9]。Feinberg等[10]在晚期LUAD中,较高NSE水平与标准一线化疗反应之间存在显著相关性,但与生存预后之间的相关性并不显著。Saab等[11]研究发现,在使用表皮生长因子酪氨酸激酶抑制剂(EGFR-TKIs)靶向治疗的NSCLC患者时,高水平NSE具有较高的疗效预测作用。
由于CEA、CYFRA21-1和NSE在监测LUAD患者免疫治疗应答中的作用有待阐明,所以本研究监测了目标血清生物学标志物的变化情况。最终发现CEA、CYFRA21-1和NSE与基线比较的差异可能作为使用帕博利珠单抗治疗的晚期LUAD患者的治疗疗效和生存预后的预后指标,具有潜在的临床应用价值。
对象与方法
1.研究对象:本研究纳入2019年10月~2021年10月笔者医院接受化疗的74例晚期LUAD患者。此外,该研究得到了笔者医院临床医学伦理学委员会的批准(批准号:2019CQSDWRMYYEC-013),研究中涉及患者的临床基本特征数据均获得了患者的书面知情同意。
2.标本收集和肿瘤标志物分析:在本研究中,帕博利珠单抗(keytruda)治疗周期为每3周30min内200mg静脉滴注,直到疾病进展,不可接受的毒性或无疾病进展的患者长达24个月为止。纳入研究的患者可能出现恶心、呕吐、食欲不振、腹泻、便秘;钠水平低,肝功能或甲状腺功能异常;发烧,感到虚弱或疲倦;咳嗽、声音嘶哑、呼吸困难;瘙痒、皮疹或脱发;血压升高;肌肉、骨骼或关节疼痛等不良反应。若出现严重并发症,该患者将中止帕博利珠单抗的治疗,自动退出本研究项目。血清CEA水平检测试剂使用化学发光微粒免疫试剂试剂盒(美国Abbott公司),而CYFRA21-1和NSE则使用免疫细胞角蛋白19片段IRMA试剂盒和NSEIRMA试剂盒(美国Beck公司)进行检测。CEA正常范围0~5ng/ml,CYFRA21-1正常范围0~3.3ng/ml,NSE正常范围0~13.4ng/ml。

结 果
1.患者及肿瘤特征:74例患者中有70例在4个周期的帕博利珠单抗治疗后进行了血清生物学标志物检测和肿瘤反应评估(4例患者出现溶血反应被排除)。患者年龄44~75岁,中位年龄为60岁,68.57%的患者为男性。大多数患者为吸烟者(87%),转移性肺癌(96%)和ECOG PS评分0~1(92%)。免疫治疗前3个指标的血清水平中位数分别为CEA 6.6(0.8~2615.0)ng/ml、CYFRA21-1 5.0(0.2~126.4)ng/ml和NSE 7.5(3.1~46.8)ng/ml。患者具体临床基本信息详见表1。
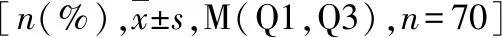
表1 纳入本研究患者的临床基本信息
2.血清生物学标志物水平、临床病理特征与肿瘤反应的相关性:年龄、性别、组织学、临床分期、ECOG PS评分、吸烟和血清水平变化与对帕博利珠单抗的反应无关(P>0.05)。患者在接受4个周期的帕博利珠单抗治疗后,与NSE比较,CEA的中位值保持相当稳定(5.1~7.4ng/ml),而CYFRA21-1的中位值水平下降到2.7ng/ml(表2)。在那些获得了DCR的患者中这3种血清生物学标志物均有所下降,有肿瘤反应者和无肿瘤反应者之间存在明显的差异(P<0.05)。根据之前已发表文献对接受标准一线化学疗法治疗的晚期非小细胞肺癌患者的研究结果,治疗后血清浓度下降≥20%被用作定义标志物反应的截止水平[12]。CEA、CYFRA21-1和NSE降低≥20%与肿瘤反应的阳性结果占比分别为17/50(34%)和16/44(36%),并且CEA和CYFRA21-1的降低与良好的肿瘤反应相关(表3)。

表2 CEA、CYFRA21-1和NSE的变化与帕博利珠的肿瘤反应的关系[M(Q1,Q3)]
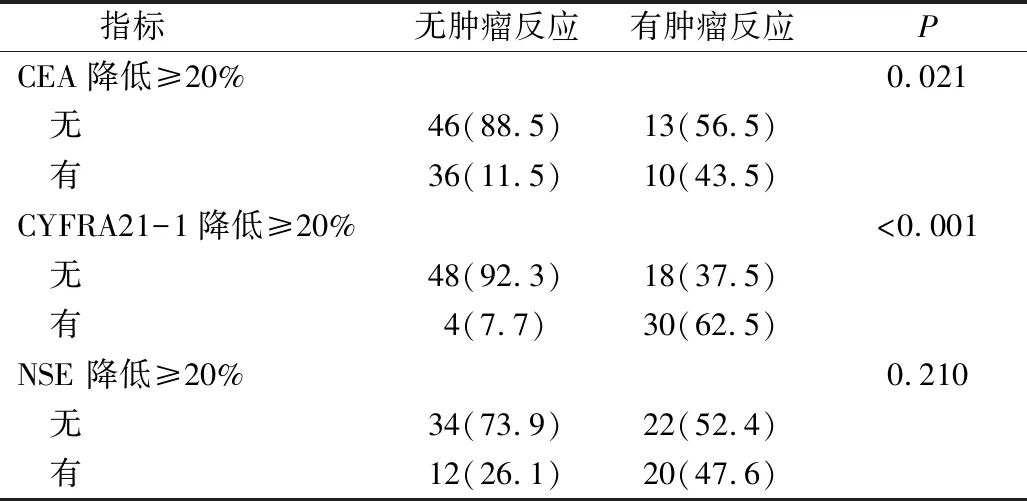
表3 CEA、CYFRA21-1和NSE降低≥20%与肿瘤反应的关系[n(%)]
3.CEA、CYFRA211、NSE与PFS的相关性分析:在本研究中,67例患者的中位PFS为1.9个月(95%CI:1.7~2.2个月),但年龄、性别、组织病理学、吸烟以及血清生物学标志物水平与PFS无关。在基线CEA值正常时,PFS(2.7个月 vs 1.7个月,P=0.026),然而这部分患者在接受4个周期帕博利珠单抗治疗后,CEA和CYFRA21-1降低≥20%(CEA:7.1个月 vs 1.9个月,P=0.028;CYFRA21-1:7.9个月 vs 1.9个月,P<0.001)。但笔者也观察到NSE降低≥20%与PFS之间未见明显的相关性(4.7个月 vs 1.9个月,P=0.35,图1)。
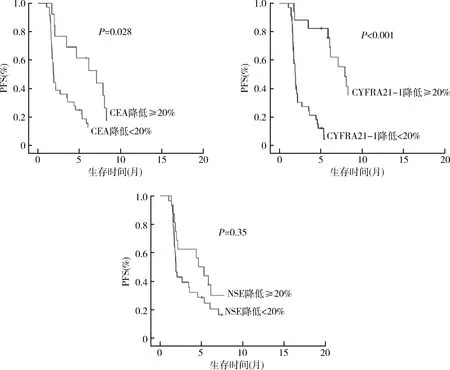
图1 CEA、CYFRA21-1和NSE降低≥20%的无进展生存期PFS分析
本研究中患者在接受4个周期的帕博利珠单抗治疗后,CEA或CYFRA21-1降低≥20%提示着积极的预后情况(表4),特别是Kaplan-Meier生存曲线提示CEA患者降低≥20%比没有标志物减少的患者存活时间更长(15.0个月 vs 9.9个月,P=0.026)或CYFRA21-1(14.6个月 vs 10.0个月,P=0.019,图2)。同时,本研究进一步对患者的性别、年龄、既往治疗路线和血清CEA、CYFRA21-1和NSE水平的多因素分析显示,免疫治疗次数较高的患者预后更好(HR=0.67,95%CI: 0.48~0.94,P=0.022),并且CEA(CEA<5ng/ml:HR=0.70, 95%CI:0.49~1.01,P=0.057)和CYFRA21-1(CYFRA21-1<3.3ng/ml:HR=0.68,95%CI: 0.46~1.01,P=0.055),上述数据也提示患者预后良好。
讨 论
免疫检查点抑制剂(如PD-1/PD-L1单抗)广泛用于晚期癌症的治疗,包括晚期LUAD。然而,有部分患者对PD-1/PD-L1单抗出现耐药情况(原发性耐药和继发性耐药),并表现出严重的毒性不良反应,迫使免疫治疗中断[13]。由于这些原因,一些具有能够预测功能的生物学标志物的探索就显得至关重要了,它们将有助于肺腺癌患者选择不同方案进行个体化治疗。相关研究已经阐明并验证了血常规中生物学标志物和免疫反应之间的关系[14]。在晚期LUAD中,有一些血液生物学标志物已被发现可作为帕博利珠单抗治疗的预后相关的生物学标志物[15]。特别是中性粒细胞与淋巴细胞的比值(neutrophils lymphocytes ratio,NLR)和淋巴细胞比值(preoperative plateletlymphocyte ratio,PLR)显示与较差的生存预后显著相关(P<0.05)[16]。
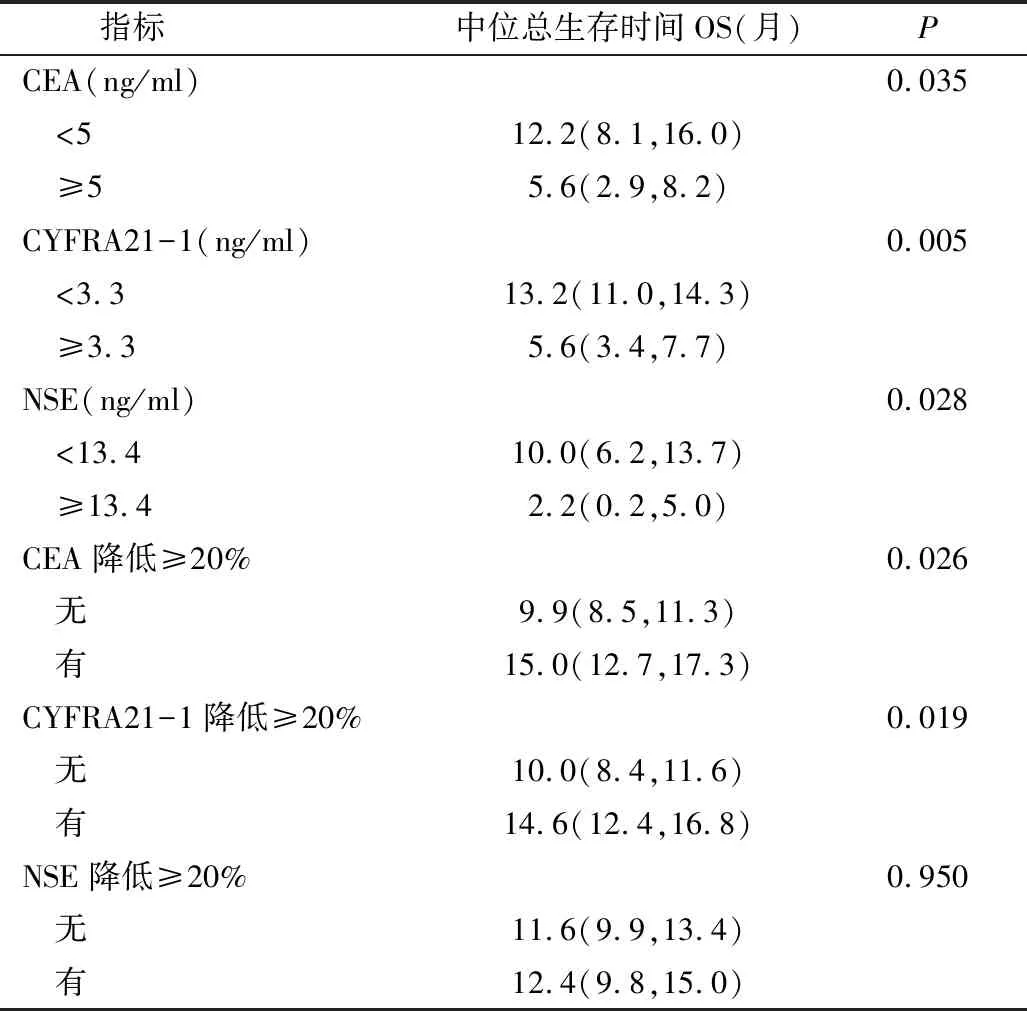
表4 CEA、CYFRA和NSE降低≥20%与总生存时间OS的相关性分析[M(Q1,Q3)]
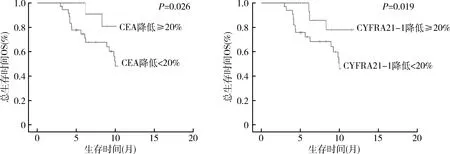
图2 CEA和CYFRA21-1降低≥20%与总生存时间OS相关性分析
CEA和 CYFRA21-1在一线化疗中监测肿瘤反应的作用已经在之前的研究中得到了证实,但它们作为免疫治疗疗效预测中的监测标志物的作用尚未阐明[17]。因此,本研究重点研究CEA、CYFRA21-1和NSE作为晚期肺腺癌与帕博利珠单抗肿瘤反应之间的关系。LUAD患者接受4个周期帕博利珠单抗治疗后,笔者观察到CEA或CYFRA21-1降低≥20%与更好的生存预后显著相关(P<0.05)[18]。最近的一项研究报道,提前预处理的血清CYFRA21-1≥2.2ng/ml是良好PFS的独立预测因子,而血清CYFRA21-1≥5ng/ml与更差的PFS有一定的相关性(中位PFS:15.5天 vs 51.5天,P=0.05)[19]。Rubenstein等[19]研究发现,免疫治疗联合化疗与免疫单药治疗的肿瘤反应性比较,差异无统计学意义,但在不良反应方面,联合化疗组的不良反应发生率明显增多,差异有统计学意义。在本研究中,多变量分析提示正常水平CEA或CYFRA21-1水平是接受帕博利珠单抗治疗的患者的独立预后因素。此外,笔者观察到4个周期帕博利珠单抗后标志物的降低与生存结果指标之间也有显著相关性(P<0.05),即CEA或CYFRA21-1降低≥20%与总无进展生存期PFS具有一定的相关性[20]。更重要的是在晚期腺癌患者中,笔者观察到CEA或CYFRA21-1降低≥20%与更长的PFS呈正相关,而在肺鳞癌患者中,CYFRA21-1降低≥20%也同样有统计学意义[21,23]。对PFS与3种血清生物学标志物进行相关性分析时,在这两种组织病理类型数据中发现具有相似的中位OS,然而只有在CEA降低≥20%的腺癌患者中观察到较长的中位OS[24]。因此,CEA和CYFRA21-1在监测腺癌患者时似乎有更好的预测趋势,而在肺鳞癌患者中的数据上的差异并不显著(P>0.05)[25]。
因此,本研究认为CEA和CYFRA21-1降低≥20%与晚期肺腺癌患者肿瘤反应和较长的PFS显著相关(P<0.05),这将有助于推动晚期肺腺癌免疫治疗过程中肿瘤反应的动态检测,以及实时评估与预测患者的生存预后与复发风险,为临床医生的治疗方案调整提供数据支持和研究支持。

