TNF-α/hs-CRP双标记时间分辨荧光免疫法用于脓毒症早期筛查诊断的研究
李云鹏,郝培远,曹雪明,闫兆月,王恩锋,黄书满,代荣钦△
脓毒症是一种由感染引起的全身炎症反应综合征,如不及时治疗,可致器官衰竭和休克,也是重症监护病房患者(包括婴幼儿、儿童等)死亡的主要原因之一。脓毒症早期症状不明显,病情进展较快,病死率可达30%~70%[1]。因此,脓毒症早期诊断对最佳治疗时机的选择十分重要。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达与炎症反应关系密切,是重要的促炎介质之一,可诱发白细胞介素(interleukin,IL)-6等次级炎性因子水平升高和白细胞数量的增多,导致过度炎症反应。研究认为,TNF-α介导的炎症反应是导致脓毒症损伤的重要机制之一[2]。超敏C-反应蛋白(hypersensitive Creactive protein,hs-CRP)属于炎症类物质,机体发生细菌感染时hs-CRP水平会迅速升高,可以作为脓毒症早期诊断的标志物[3]。研究发现,炎性因子的检测可用来预测脓毒症的发生、发展以及治疗效果评估,多指标同时检测可提高检测的准确性[4-5]。然而,可同时进行检测的技术较少,能满足同时检测多指标的试剂更少。双标记时间分辨荧光免疫法(time-resolved fluorescence immunoassay,TRFIA)采用镧系元素铕(Eu3+)和钐(Sm3+)作为标志物,是一种可实现双指标同时检测的超微量免疫分析技术,具有灵敏度、特异度高,线性范围宽等特点[6],可满足脓毒症多炎性因子的同时检测。本研究拟建立一种双标记TRFIA 法用于检测血清TNF-α和hs-CRP 水平,以期为脓毒症的早期筛查、疗效评价和预后评估等提供参考。
1 资料与方法
1.1 一般资料和仪器 收集2020年5月—2021年10月收治的70 例脓毒症阳性患者的血清样本,其中46 例来自河南省人民医院,余24例来自华中阜外医院;男45例,女25例,年龄12~55 岁,平均(28.3±14.9)岁。阳性:体温>38.3 ℃或者体温<36 ℃;心率升高、血压降低、血糖升高、精神状态不佳,白细胞计数(WBC)>12×109/L,血浆C-反应蛋白升高,血浆降钙素原升高、高乳酸血症等。同期健康体检阴性血清样本者100例,男52例,女48例,年龄15~45岁,平均(29.4±12.8)岁,均来自河南省人民医院。阴性:没有临床脓毒症的症状,血常规、尿常规、血压血糖等正常。2 组性别(χ2=2.537)、年龄(t=0.515)差异无统计学意义。抗TNF-α 包被抗体(编号3E2)、检测抗体(编号5B3),抗hs-CRP 包被抗体(编号4E2)和检测抗体(编号10D3)以及TNF-α 和hs-CRP 标准抗原购自广州优迪生物科技股份有限公司;Eu3+和Sm3+标记试剂盒、Sephades-G50 填料和时间分辨荧光免疫检测仪(型号Victor 1420)均购自PerkinElmer 公司;牛血清白蛋白(bovine serum albumin,BSA)购自Fitzgerald 公司;96 孔反应板购自Costar公司。
1.2 反应板包被 以50 mmol/L、pH=9.6 的碳酸盐缓冲液将抗TNF-α包被抗体和抗hs-CRP包被抗体分别稀释到2 mg/L,加入96 孔反应板中,每孔100 μL,4 ℃包被过夜;拍干包被液,5% BSA 封闭,每孔250 μL,37 ℃孵育2 h;拍干封闭液,0.5%吐温-20(Tween-20)的PBS 洗涤3 次,拍干后真空冷冻干燥,4 ℃冰箱保存。
1.3 Eu3+和Sm3+抗体偶联物制备 参考试剂盒说明书和参考文献[7]行Eu3+、Sm3+抗体偶联。
1.4 试剂盒组装 将TNF-α标准品母液分别稀释成0、0.1、1、10、50 及100 ng/L,将hs-CRP 标准品母液分别稀释成0、0.1、1、10、50 及100 mg/L;均1 mL/瓶分装后冻干。Eu3+和Sm3+抗体偶联物分别分装,10 mL/瓶。分析缓冲液20 mL/瓶、洗涤液50 mL/瓶、增强液20 mL/瓶。将上述成分和反应板放置于纸质试剂盒中,组装成TRFIA法检测试剂盒。
1.5 TRFIA 试剂盒检测血清TNF-α 和hs-CRP 水平 向包被反应板中依次加入25 μL的血清样品或标准品、100 μL分析缓冲液、100 μL Eu3+和Sm3+抗体偶联物,室温振动孵育1 h。洗涤液洗涤6 次,最后每孔加入200 μL 增强液,振摇5 min后,在Victor 1420全自动时间分辨荧光免疫分析检测仪检测荧光值。
1.6 TRFIA试剂盒性能评估
1.6.1 标准曲线的绘制 使用1.4中制备的TRFIA试剂盒测定TNF-α/hs-CRP标准品,每个标准品浓度设置重复3次,平行测定3次,计算各标准品荧光值的平均值,进行线性拟合,得到标准曲线及其相关系数。试剂盒灵敏度参照文献[8]方法确定。
1.6.2 准确度和精密度试验 将TNF-α和hs-CRP标准品母液分别用阴性血清稀释为低(TNF-α:1 ng/L;hs-CRP:2 mg/L)、中(TNF-α:10 ng/L;hs-CRP:50 mg/L)和高(TNF-α:50 ng/L;hs-CRP:100 mg/L)3个质量浓度,每个质量浓度进行10次平行检测,计算检测平均值、标准差(standard deviation,s)、变异系数(coefficient of variation,CV)以及加标回收率(测定浓度/加标浓度×100%)。
1.6.3 特异性试验 用TRFIA 试剂盒检测血清中常见的干扰物质:降钙素原(procalcitonin,PCT)标准品(100 μg/L)、人血清白蛋白标准品(100 μg/L)、纤维蛋白原标准品(100 μg/L)和基质金属蛋白酶(MMP)-9标准品(100 μg/L),每个样本设置重复3 次,计算交叉反应率(检测值/理论值×100%),结合试剂盒对TNF-α和hs-CRP检测阈值,评估检测特异性。
1.6.4 稳定性试验 TRFIA试剂盒分别存储于4 ℃6个月和37 ℃7 d,对试剂盒的外包装进行评估,并测定各标准品的荧光值,计算荧光值变化率=|稳定性试验前荧光值-37 ℃7 d或4 ℃6个月荧光值|/稳定性试验前荧光值×100%,确定试剂盒的稳定性。
1.6.5 检测阈值的确定 采用本试剂盒分别测定100例健康志愿者血清中TNF-α 和hs-CRP 的水平,分析正态性并确定95%CI,计算TNF-α 和hs-CRP 的参考值的上限,即检测阈值。
1.7 临床样本对比检测 70 例脓毒症阳性血清样本,15 份健康志愿者阴性血清样本,采用TRFIA 试剂盒进行检测,对比检测结果与临床结果,以确定本试剂盒筛查脓毒症的准确性。
1.8 统计学方法 采用SPSS 17.0软件进行数据分析。符合正态分布的计量资料用±s表示,采用Excel 软件,以TNF-α和hs-CRP 标准品浓度为横坐标,其对应的荧光值的对数值为纵坐标绘制标准曲线。
2 结果
2.1 标准曲线 TNF-α标准曲线方程:Y=0.037 1X+0.913 2,R2=0.992 7,线性范围0~100 ng/L;hs-CRP标准曲线方程:Y=0.037 4X+1.028 4,R2=0.990 6,线性范围0~100 mg/L。见图1。平行测定10 次浓度为0的参考标准品的荧光值,得到本TRFIA 试剂盒对TNF-α的检测灵敏度为0.05 ng/L,对hs-CRP的检测灵敏度为0.02 mg/L。

Fig.1 Standard curves of TRFIA kit for detecting TNF-α and hs-CRP levels图1 TRFIA试剂盒检测TNF-α和hs-CRP水平的标准曲线
2.2 准确度和精密度试验结果 TNF-α高、中、低3个质量浓度的加标回收率为92.00%~107.00%,hs-CRP 的高、中、低3 个质量浓度的加标回收率为95.00%~106.82%。TNF-α批内CV为4.57%~9.24%,批间CV为5.13%~9.27%;hs-CRP 批内CV为3.57%~7.69%,批间CV为6.07%~10.00%,批内和批间的CV均≤10.00%,见表1。
2.3 特异性试验结果 血清中常见的干扰物质的检测值均较小,得到的交叉反应率均小于2%;且检测值均小于TNF-α 和hs-CRP 的检测阈值,结果判定为阴性,即高浓度的干扰物质不影响检测结果判定,见表2。

Tab.2 The specific test results of TRFIA kit表2 TRFIA试剂盒特异性试验结果
2.4 稳定性试验结果 37 ℃7 d热破坏性试验示试剂盒外包装无明显变化,各标准品荧光值未随着时间的改变而发生明显改变,荧光值变化率均小于1.5%;4 ℃冰箱中储存6 个月,试剂盒外包装无明显变化,各标准品荧光值亦未随时间的改变而发生明显改变,荧光值变化率均小于2.5%,见表3。
2.5 检测阈值确定结果 血清中TNF-α 检测阈值为0.44 ng/L;hs-CRP检测阈值为1.41 mg/L。
2.6 临床样本对比检测 70 例临床阳性样本,TRFIA 试剂盒检测结果均为阳性;15 份临床阴性样本,TRFIA 试剂盒检测结果均为阴性。本TRFIA 试剂盒检测结果与临床情况相一致,符合率100%。
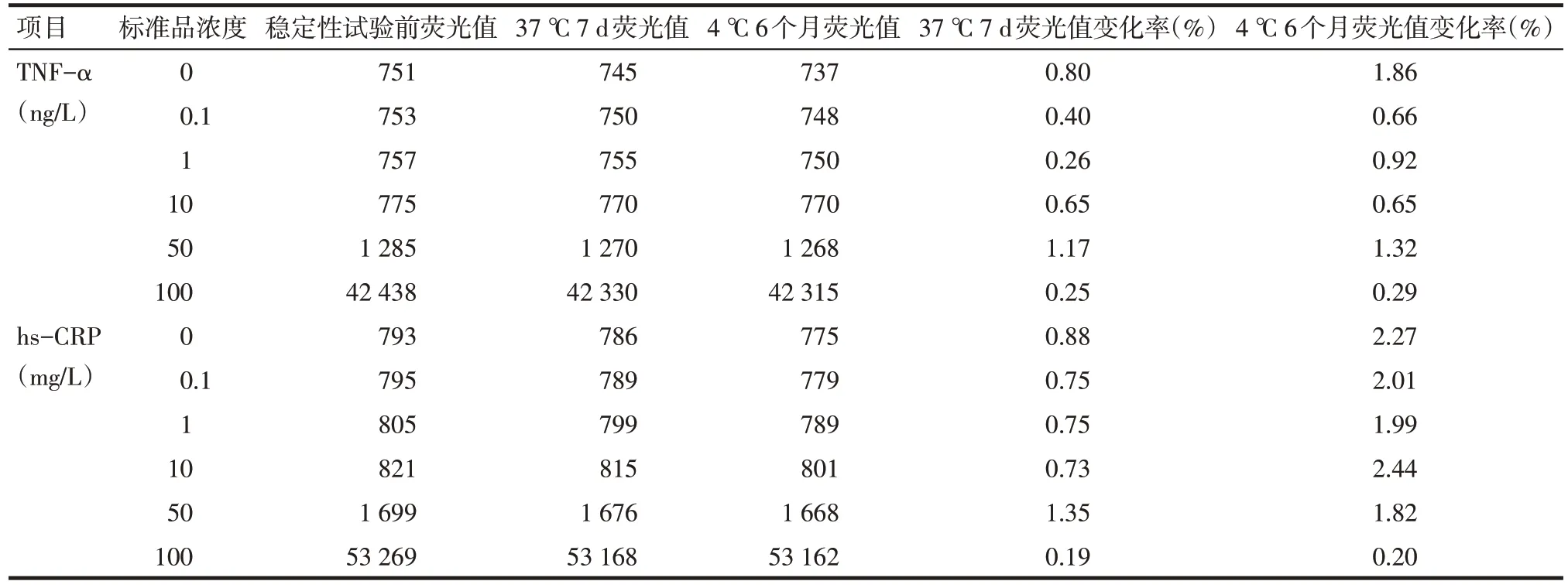
Tab.3 The stability results of TRFIA kit表3 TRFIA试剂盒稳定性实验结果
3 讨论
脓毒症是机体应对感染时过度激活免疫系统,引起全身炎性因子的瀑布式释放,从而导致器官及组织衰竭的一种综合征,致死率高,全球范围内每年脓毒症发病人数多达1 800万,因脓毒症导致的死亡人数每天将近1 400 例[9-10]。婴幼儿和儿童因其身体器官发育尚不成熟,抵抗力较差,更容易受到脓毒症的损害[11]。因此,准确、高效地检测脓毒症特异性标志物的变化,预测脓毒症的发生与发展,对脓毒症患者的医治具有重要指导意义。临床上对脓毒症感染检测指标选择较多,有白细胞、中性粒细胞等,但其用于诊断感染的准确率较低[12]。脓毒症作为一种炎性疾病,炎性因子(TNF-α、IL-6等)在其疾病发展初期已开始被分泌并释放到血液中,多种炎性因子的检测可用来预测脓毒症的发生、发展以及治疗效果等[13]。对于炎性因子的检测,临床上有多种方法,如酶联免疫吸附测定法、放射免疫法、化学发光法和TRFIA等,检测性能各有优劣,TRFIA因其可进行双指标同时检测而备受关注。
双标记TRFIA方法作为一种新兴的免疫检测方法,已广泛用于临床样本检测、食品检测以及兽医学检测等多个领域[13-14]。其具有高灵敏度、高特异性,适合临床样本分析的优势,是单标记诊断方法的良好替代[14]。本研究结果显示,TNF-α在0~100 ng/L范围内检测线性较好,hs-CRP 在0~100 mg/L 范围内检测线性较好,检测灵敏度分别为0.05 ng/L 和0.02 mg/L,可满足临床检测的需要;TNF-α 和hs-CRP 的加标回收率90%~110%,批内与批间CV均小于10%,表明本TRFIA 法检测TNF-α 和hs-CRP的准确度和精密度较高,达到了临床样本检测要求;稳定性试验结果显示,该TRFIA试剂盒稳定性较好;比对试验表明,该TRFIA 试剂盒能够准确地筛查脓毒症临床样本。计算得到的参考阈值说明当血清TNF-α≥0.44 ng/L、hs-CRP≥1.41 mg/L 时,患者有发生脓毒症的危险。欧赛英等[15]建立的吖啶脂化学发光法最低TNF-α 检测限为0.245~0.519 ng/L,线性范围5~1 000 ng/L,回收率为92.6%~104.9%,总CV<10%。本检测方法的灵敏度高于上述检测方法,线性范围小于上述方法,准确性和精密度等同。双标记TRFIA 检测hs-CRP 和脂蛋白(a)的研究显示,对hs-CRP 检测灵敏度为0.052 mg/L,批内批间CV均小于10%[16]。本研究TRFIA法检测hs-CRP的分析性能与上述TRFIA等同。因此,笔者认为,与其他检测方法相比,TRFIA是一种应用前景广、可实现多指标同时检测的新型技术。
综上所述,本研究建立的TNF-α/hs-CRP 双标记时间分辨免疫荧光试剂盒具有高灵敏度和高特异性的优点,能够实现对TNF-α/hs-CRP 的快速检测,可作为辅助脓毒症早期筛查的技术手段在临床推广应用。

