北柴胡水提液中13种化学成分分析及其肝损伤保护作用研究
杨奇涛,汪玉馨,吴殷囡,刘洋,孟长虹,谭力,陆益红,史清水(1.中国药科大学新药安全评价研究中心,南京 11198;.江苏省食品药品监督检验研究院,南京 10019;3.徐州医科大学药物分析教研室,江苏 徐州 1004)
北柴胡作为常用的大宗药材,具有疏散退热、疏肝解郁、升举阳气之功效,其药效成分以柴胡皂苷为主,还有少量其他成分,而在较多的柴胡皂苷同分异构体中,柴胡皂苷A、D 的含量相对较高[1]。目前《中国药典》一部中普遍用单一或几个化学成分来对药材、饮片及其制剂进行定性和定量,这种方法忽略了中药多组分、多靶点、多途径协同作用的特点,利用单一或几个成分进行评价和控制,不能正确衡量中药的质量与药效,只有充分利用现代色谱、光谱、质谱手段,特别是液相色谱/质谱联用技术,才能实现在单次分析中对多个微量及痕量成分,包括同分异构体的定性和定量分析[2-5]。
因此本研究利用HPLC-Q-TOF-MS/MS 技术对北柴胡水提液的有效成分群进行表征,首先通过对各化合物进行鉴定并获得精确分子量以及充分的碰撞解离碎片信息,并对其二级裂解规律进行了分析,从而鉴定出北柴胡水提液中的主要化学成分,为柴胡以及其相关制剂标准的制订和体内物质基础研究提供参考。前期课题组曾对柴胡及其制剂正柴胡颗粒对对乙酰氨基酚(APAP)所致急性肝损伤的作用进行研究,发现柴胡预给药具有减毒作用[6-8],故利用APAP 诱导的LO2 肝细胞损伤模型对北柴胡水提液中主要活性成分进行筛选与比较,以期能够较为全面地评价北柴胡各单体成分的药效及毒性。
1 材料与仪器
1.1 材料
北柴胡生药饮片(由南通精华药业有限公司提供并鉴定为伞形科植物柴胡Bupleurum chinensisDC.的干燥根);柴胡皂苷A(纯度≥98%,批号:MUST-17120313)、柴胡皂苷B1(纯度≥99%,批号:MUST-18010302)、柴胡皂苷B2(纯度≥99%,批号:MUST-18032104)、柴胡皂苷B3(纯度≥98%,批号:MUST-18060116)、柴胡皂苷B4(纯度≥97%,批号:MUST-17110117)、柴胡皂苷C(纯度≥98%,批号:MUST-18031402)、柴胡皂苷D(纯度≥99%,批号:MUST-17111510)、柴胡皂苷F(纯度≥98%,批号:MUST-18031806)、柴胡皂苷G(纯度≥98%,批号:MUST-18072216)、柴胡皂苷H(纯度≥98%,批号:MUST-18040205)、柴胡皂苷I(纯度≥97%,批号:MUST-18072205)、山柰苷(纯度≥99%,批号:MUST-18042701)、黄芩苷(纯度≥98%,批号:MUST-18010408)(对照品,成都曼斯特生物科技有限公司);对乙酰氨基酚[纯度≥99%,批号:G1816129,阿拉丁试剂(上海)有限公司]。
人源化非肿瘤肝细胞LO2(中国科学上海院细胞研究所);DMEM 培养基(批号:8119007)、胎牛血清(批号:1828728)、青霉素-链霉素溶液(含10 000 单位·mL-1青霉素和10 000 µg·mL-1链霉素,批号:1970741)(美国GIBCO 公司);0.25%胰酶消化液(美国HyClone 公司,批号:J180013);二甲基亚砜(DMSO,美国Solarbio 生化试剂公司,批号:MKBP4399V);MTT 试剂(美国Sigma 公司,批号:1213C0338);甲醇、乙腈、甲酸(均为色谱纯,德国默克公司);其他试剂为分析纯;实验用水均由Millipore 超纯水仪制备。
1.2 仪器
AB SCIEX Triple TOF 5600 组合式高分辨质谱仪,包括四元泵溶剂系统、在线脱气机和自动进样器(上海爱博才思分析仪器贸易有限公司);MassLynxTM 质谱工作站(Waters 公司);真空离心浓缩挥干仪(美国Thermo 公司);L-550 台式低速离心机(湖南湘潭离心机有限公司);Beckman Coulter Allegra 64R 台式高速冷冻离心机(美国贝克曼库尔特有限公司);生物安全柜(Thermo 1300series A2,美国赛默飞世尔科技公司);5%CO2箱培养箱(德国Memmert 公司);倒置显微镜(OLYMPUS IX53)、光学显微镜(OLYMPUS BX41)(日本奥林巴斯株式会社);高压蒸汽灭菌器(Panasonic MLS-3781L,日本松下电器株式会社);细胞计数仪(Countstar BioMed,上海睿钰生物科技有限公司);全自动酶标仪(Molecular Devices);超纯水机(美国Millipore 公司)。
2 方法
2.1 HPLC-Q-TOF-MS/MS 法分析北柴胡水提液有效成分
2.1.1 北柴胡水提液制备 称取适量北柴胡生药饮片,浸泡30 min,首次加10 倍水煎煮90 min,第二次加8.5 倍水煎煮90 min,将所得药汁水提醇沉24 h 后过滤,合并滤液,并浓缩至1000 mL,每1 mL 北柴胡水提液中含生药3.8 g,本提取液由南通精华药业公司协助制备。
2.1.2 样品前处理 精取北柴胡水提液1 mL,加甲醇9 mL,混匀,4000 r·min-1离心10 min。取上清液,挥干后加50%甲醇1 mL 复溶,13 000 r·min-1离心10 min,取上清液进行HPLC-QTOF-MS/MS 分析。
2.1.3 色谱条件 色谱柱Agilent Zorbax Eclipse Plus C18柱(2.1 mm×100 mm,3.5 µm); 柱温35 ℃;流速0.2 mL·min-1;流动相由水(含0.05%甲酸,A)和乙腈(B)组成,梯度洗脱条件见表1;进样量2 μL。
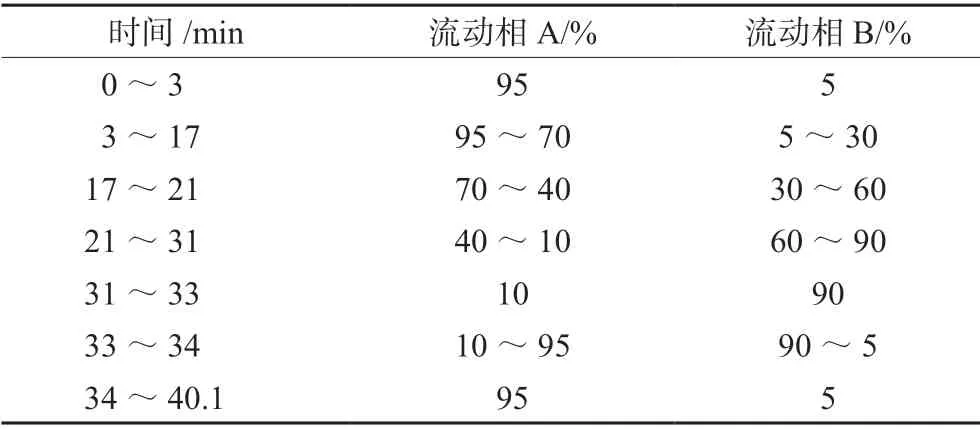
表1 梯度洗脱条件Tab 1 Gradient elution
2.1.4 质谱条件 采用电喷雾离子源(ESI),负离子模式;喷雾电压:-4500 V,离子源温度:550℃,碰撞能量(CE):-30℃;雾化气(GS1):45 psi,辅助气(GS2):55 psi,气帘气(CUR):40 psi;为获得更多定性信息,采用全扫描模式,扫描范围为MS1:m/z150 ~1350,MS2:m/z100 ~1300。
2.1.5 数据分析 将HPLC-Q-TOF-MS/MS 所得结果用PeakView 2.1 软件处理并分析。
2.2 细胞实验
2.2.1 细胞培养 LO2 细胞培养于含10%胎牛血清和1%双抗的DMEM 完全培养基中,在37℃、5%CO2培养箱培养。
2.2.2 APAP 损伤模型构建 将对数期生长的LO2 细胞用0.25%胰酶消化液、离心后重悬。根据实测细胞浓度,用细胞培养液稀释成1×105个·mL-1的细胞悬浮液备用。
取96 孔细胞培养板,每孔加1×105个·mL-1的细胞悬浮液100 µL,置于37℃、5%CO2培养箱中培养24 h 后,弃去细胞培养液上清液,每孔加100 µL 无血清培养基,培养1 h 后,更换为含APAP 0、0.5、1、2、2.5 mg·mL-1的无血清培养基,处理24 h,光学倒置相差显微镜下观察细胞生长情况。每孔加MTT(5 mg·mL-1)10 µL,培养4 h 后弃上清液,加入100 µL DMSO 作用5 min 后,震荡10 min,待紫色结晶完全溶解后以空白孔调零,在自动酶标仪490 nm 波长处读取各孔吸光度值(OD值),计算APAP 的IC50值。
2.2.3 北柴胡水提液13 种主要成分的预保护作用筛选 实验分为空白对照组、模型组(APAP,1.2 mg·L-1)、预给药组(柴胡各主要成分对照品,给药浓度为0.4 mg·L-1与2.0 mg·L-1,该浓度由前期预实验结果所得)。取96 孔细胞培养板,每孔加1×105个·mL-1的细胞悬浮液100 µL,置于37℃、5%CO2培养箱中培养24 h,弃去细胞培养液,空白对照组与模型组更换为无血清培养基,实验组更换为含药无血清培养基,培养1 h 后,除空白对照组外,其余各组均加入APAP 造模处理24 h,光学倒置相差显微镜下观察细胞生长情况。每孔加MTT(5 mg·mL-1)10µL,培养4 h 后弃上清液,加入100 µL DMSO 作用5 min 后,震荡10 min,待紫色结晶完全溶解后以空白孔调零,在自动酶标仪490 nm 波长处读取各孔吸光度值,计算LO2 细胞存活率。
3 结果
3.1 北柴胡水提液化学成分鉴定
在负离子模式下,北柴胡化学成分的特征离子主要为[M-H]-、[M+HCOO]-,通过一级质谱采集,得到了各化合物的母离子精确分子量信息,并根据该信息及软件预测功能,推测出可能的化学元素组成。通过查阅文献并结合二级碎片信息,对主要化学成分进行推测,通过对照品的保留时间及质谱参数,对北柴胡水提液中相应丰度较高的化合物进行确证。北柴胡水提液总离子流图谱见图1,鉴定出的北柴胡水提液中13 种化学成分结构式见图2,13 种化学成分提取离子流图谱见图3,表2中列出了北柴胡水提液中13 种化学成分的保留时间、化学式等信息。
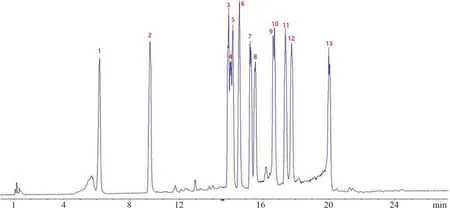
图3 北柴胡水提物中13 种化合物在负离子模式下的EIC 色谱图Fig 3 EIC chromatogram of the 13 chemical constituents in the aqueous extract of Bupleurum chinensis DC.in negative ion mode(ESI-)
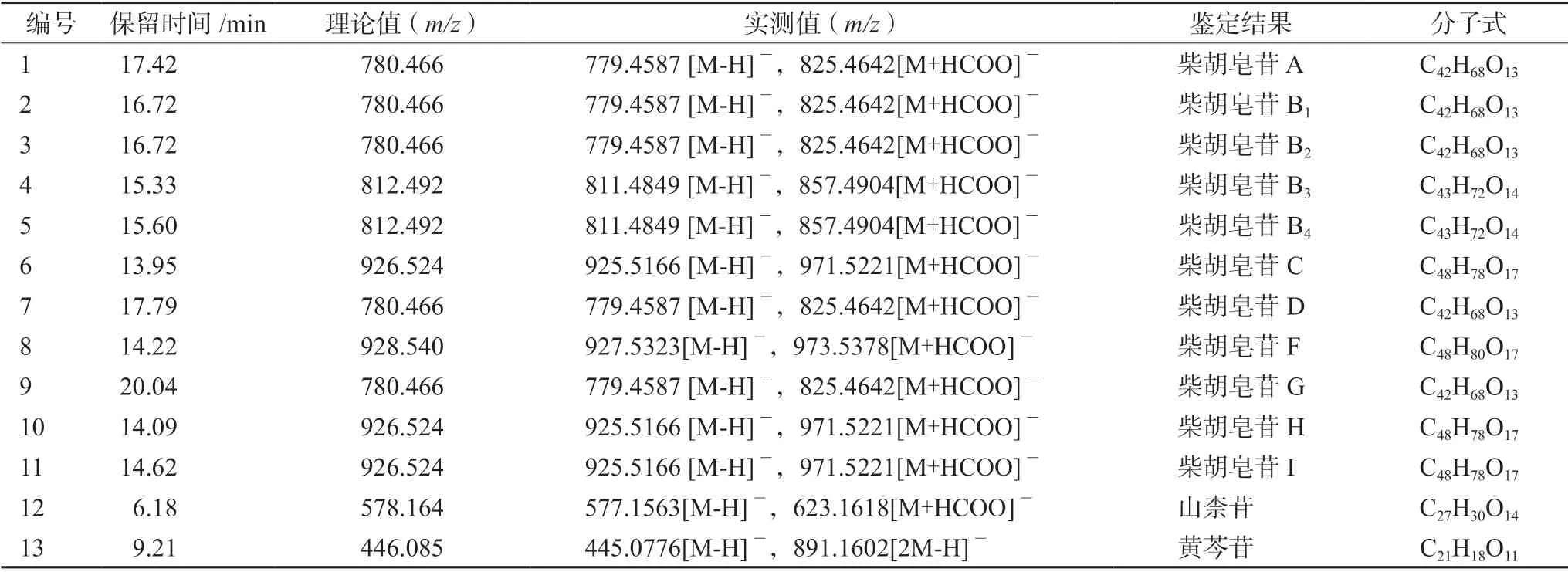
表2 HPLC-Q-TOF-MS/MS 分析的北柴胡水提物中13 种化学成分鉴定的质谱数据Tab 2 Mass spectral data of compounds in the aqueous extract of Bupleurum chinensis DC.by HPLC-Q-TOF-MS/MS
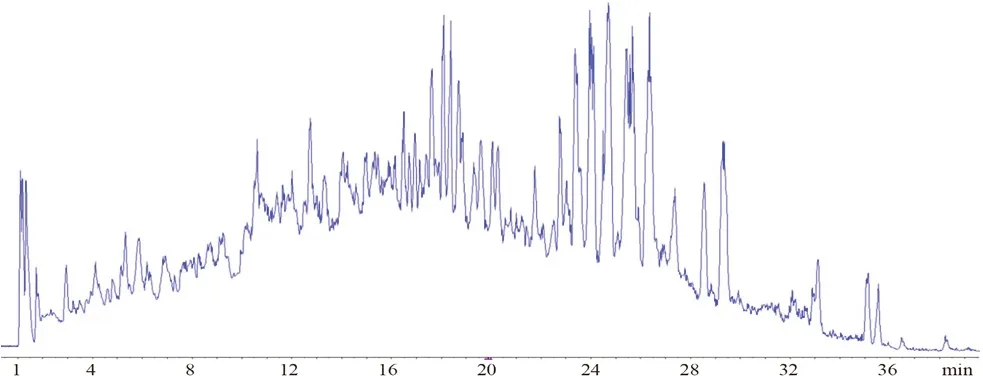
图1 负离子模式下北柴胡水提物的TIC 色谱图(ESI-)Fig 1 TIC chromatogram of the aqueous extract of Bupleurum chinensis DC.in negative ion mode(ESI-)
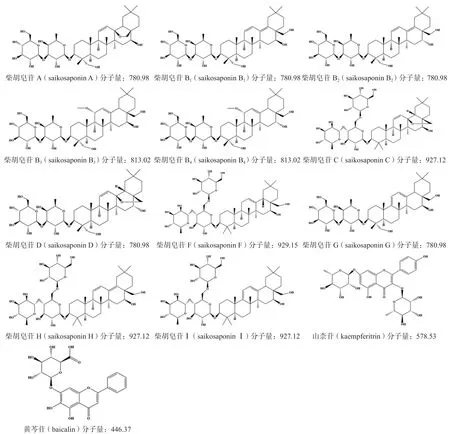
图2 北柴胡水提物中13 种化学成分的准确鉴定结构Fig 2 Accurate identification of structures of the 13 chemical constituents in the aqueous extract of Bupleurum chinensis DC.
3.2 LO2 肝细胞急性损伤模型IC50 值测定
APAP 诱导LO2 细胞建立的损伤模型因稳定性好、造模时间短在急性肝损伤相关研究中得到越来越多的应用,而对于保肝护肝作用的研究来说造模剂量至关重要,因此通过MTT 法测定不同浓度APAP 对LO2 细胞的效应值(见图4),将各浓度响应值转换成细胞生长抑制率,用GraphPad Prism 5 软件计算出细胞生长抑制达到50%(IC50)时APAP 的质量浓度为1.2 mg·mL-1。
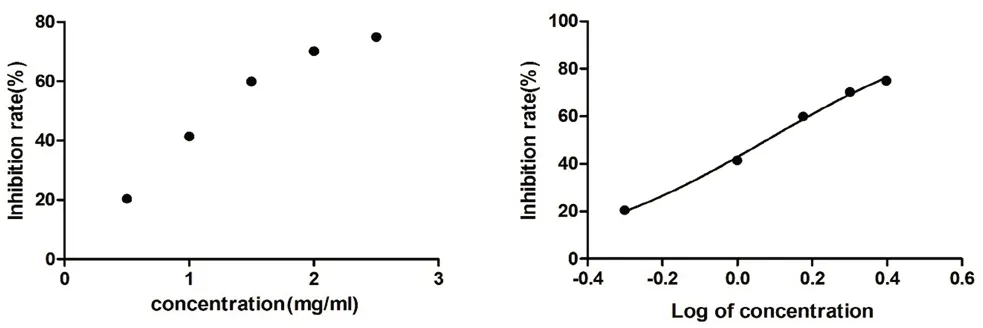
图4 APAP 诱导的LO2 细胞中IC50 的测定Fig 4 IC50 in LO2 cells induced by APAP
3.3 北柴胡水提液中肝损伤保护作用筛选
通过北柴胡水提液中13种化学成分预给药后,以1.5 mg·mL-1浓度(略大于50%抑制率时的剂量)的APAP 进行LO2 细胞急性肝损伤诱导,前期预实验结果发现13 种化学成分的预保护作用差异较大,选取其中保护作用较大的8 种化学成分分为高、低剂量组预给药,进一步考察其对APAP所致肝损伤的保护作用,结果见表3。由表3 可知高低剂量组结果差异不大,柴胡皂苷F 与黄芩苷与给药后细胞存活率与模型组相比提高约1.5 倍,可能存在潜在的肝损伤预保护作用。剩余5 种化学成分低剂量给药对APAP 所致肝损伤的保护作用结果发现,在该剂量下预给药后与模型组的细胞存活率比值小余1 或约为1(见表3)。
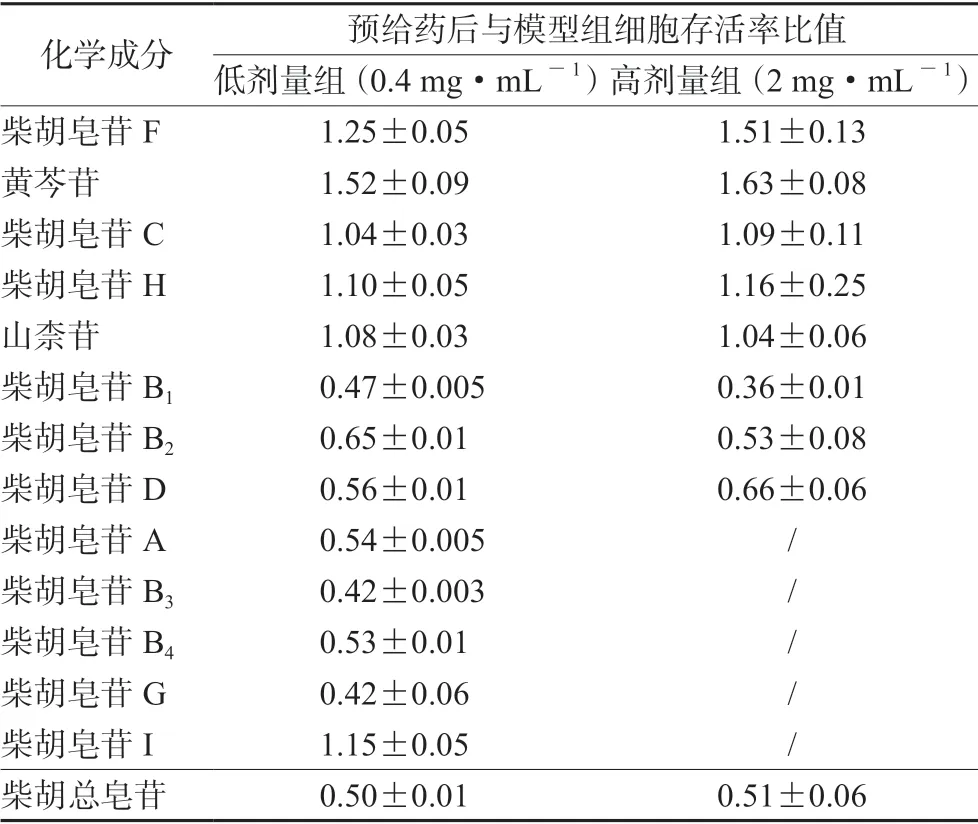
表3 北柴胡水提物中13 种化学成分对肝损伤的预保护作用Tab 3 Pre-protective effect of 13 chemical constituents in the aqueous extract of Bupleurum chinensis DC
4 讨论
中药的物质基础并不是单一的化合物,而是指其中发挥作用的化学成分(群)[9]。由于中药化学成分复杂多变,同一药材因其基原、部位、炮制、提取方式的差异,化学成分种类及其含量均有可能千差万别,因此中药药效物质基础研究也就成为了中药现代化的重点和难点[10]。由于中药基质复杂,许多成分浓度较低、对照品缺乏、结构不稳定,因此中药化学成分的鉴定是一个繁琐而又耗时的工作。目前在复杂基质及未知化合物结构鉴定方面应用较多的是液质联用(LC-MS)及核磁共振技术(NMR),但由于NMR 对化合物结构、浓度均要求较高[11],无法满足复杂基质中多组分特别是微量、痕量化合物的鉴定,因此在中药复方、单体化学成分及体内代谢物鉴定和分析中,质谱技术尤其是高分辨质谱(Q-TOF、ITTOF)应用更为广泛。Q-TOF 及IT-TOF 扫描速度快、质量范围宽、全扫描模式下灵敏度高,并可提供大量母离子及子离子精确分子量信息,从而实现复杂基质中化合物的定性、定量[12-14]。
本文利用高分辨飞行时间串联质谱(Q-TOFMS/MS),对北柴胡水提液中的化学成分进行分析鉴定,根据收集到的母离子的精确分子量信息,利用PeakView 2.1 对化学式进行预测,并根据特征碎片离子信息、查阅文献以及PubMed 数据库检索结果,对化合物结构进行推测。但由于北柴胡水提液中以柴胡皂苷为主,且其多为同分异构体,特征碎片离子相似,故通过借助对照品溶液,根据化合物色谱保留时间对多个成分一一确证,最终确证了13 个化合物。
中药药效物质基础研究也是中药安全性和有效性的关键,如何对原方中的有效成分进行准确识别和科学评价至关重要,通过识别、筛选、验证环节,将体内外成分与药理效应相结合,才能更好地找到体内活性成分[15]。目前对于柴胡各成分究竟是保肝还是伤肝这一问题,结论还比较模糊。有研究认为柴胡皂苷D 可通过抑制肝细胞中的PDGF-βR/p38MAPK 信号通路,使LO2 细胞线粒体受损从而激活下游凋亡通路,同时激活细胞膜上的fas 受体及 caspase-8,将凋亡信号传递至线粒体,加速细胞凋亡[16];或者通过降低细胞超氧化物歧化酶活性,破坏细胞膜,导致细胞损伤[17]。也有研究发现柴胡皂苷D-黄芩苷配伍可使体内TLR4-NFκB 信号通路下调,降低炎症,从而保护CCl4损伤的LO2 细胞[18]。可见,仅在柴胡皂苷D 这一单体与LO2 肝细胞关系上的研究结果就存在争议。而LO2 细胞是目前用于保肝药物筛选的常用细胞模型,很多中药单体或提取物以该细胞为模型研究保肝作用[19-21]。因此本研究建立APAP 诱导LO2 细胞急性肝损伤模型对北柴胡水提液主要化学成分群活性进行比较。结果发现,柴胡皂苷F 及黄芩苷预给药后,细胞存活率提高约1.5 倍,具有潜在肝损伤预保护作用。但体外实验结果也表明,北柴胡水提液中化学成分复杂,各成分活性也具有双向性,考虑柴胡药效作用的发挥与体内吸收、代谢、排泄过程密切相关,是多个成分及其代谢产物综合作用的结果,因此对其药效及毒性的评价还是应以整体为单位,以全面阐明其代谢通路及效应机制。

