miR-181d-5p对宫颈癌细胞放射敏感性的影响及机制
李祥双,于海霞,叶燕珍,温慧敏,杜丽苹,傅丽玲,于卫华
联勤保障部队第九一〇医院健康医学科,福建泉州 362000
宫颈癌是世界上常见的妇科恶性肿瘤之一,其发病率和病死率呈逐年上升趋势[1]。近年来,尽管放射治疗和化学疗法已用于宫颈癌的治疗,但由于该疗法在某些情况下无效,导致该病5 年生存率仅为40%~50%[2]。已有研究显示,部分肿瘤细胞对X射线的敏感性降低,并且对宫颈癌患者的治疗效果远未达到预期效果[3-4]。因此,迫切需要探索宫颈癌细胞的抗辐射机制,改善患者预后。miRNA 是一类内源性非编码RNA 分子,能参与基因表达的转录后调控,可能会引起目标mRNA 的降解或抑制基因表达[5]。miR-181d-5p是miR-181家族成员,miR-181d-5p可通过靶向调控PTEN 抑制人结肠癌细胞凋亡[6],而DEAD盒多肽3(DDX3)作为DEAD盒蛋白RNA解旋酶家族成员之一,可抑制DDX3表达,增加前列腺癌细胞放射敏感性[7],而 miR-181d-5p 及 DDX3 对宫颈癌细胞放射敏感性的影响鲜见报道。2020年6月—2021 年 5 月,我们探讨 miR-181d-5p 通过调控 DDX3影响宫颈癌细胞放射敏感性的可能机制。
有一年,父亲因为手术后养病,大一放暑假的我第一次扛起铁锹,穿上父亲的雨靴去浇水。从没有打过拦水坝的我站在水中,一次次放土方,可土方一次次被水冲走,最终还是在母亲的帮助下才打好了坝。我精疲力尽地坐在渠沿上,看着被泥水灌湿了的双腿,深深体会到了父亲浇水的不易。
1 材料与方法
1.1 材料 实验细胞:人宫颈癌细胞SiHa、HeLa、C33A、HCC-94 及人正常宫颈上皮细胞HCer Epic 均购自中国科学院上海细胞库,将细胞置于含有10%FBS 的 DMEM 培养基,并于 37 ℃、5%CO2培养箱中培养。主要试剂与仪器:miR-181d-5p 模拟物(miR-181d-5p)及其阴性对照(miR-NC)、miR-181d-5p 抑制物(anti-miR-181d-5p)及其阴性对照(anti-miRNC)、DDX3 siRNA(si-DDX3)及其阴性对照(si-NC)均购自美国ThermoFisher 公司;LipofectamineTM2000转染试剂盒、胎牛血清(FBS)、DMEM 培养基蛋白提取试剂盒、BCA 试剂盒均购自美国Bio-Rad 公司;CCK-8 试剂盒、反转录试剂盒、TransStart®Green qPCR SuperMix 均购自 TaKaRa 公司;TRIzol 试剂、ECL化学发光试剂盒均购自美国Sigma 公司;Annexin VEGFP/PI 细胞凋亡检测试剂盒、DDX3、β-actin 兔多克隆抗体(anti-DDX3、anti-β-actin)、辣根过氧化物酶(HRP)标记的羊抗兔IgG 二抗均购自美国Abcam公司;荧光定量PCR 仪、CO2培养箱均购自德国Sigma公司。
1.2 放疗抵抗的宫颈癌HeLa细胞株构建 参照文献[8],将培养至对数期的HeLa细胞接种于6孔板中,给予浓度持续增加的X 射线(0.1~3 Gy)处理后,淘汰致死细胞,剩下的存活细胞按照上述方法继续筛选,直至3 Gy X射线照射后HeLa细胞正常增殖且无明显死亡,即为宫颈癌X 射线抵抗细胞株,命名为HeLa-X细胞。
1.3 细胞培养与转染 将HeLa-X 细胞置于含有10% FBS 的 DMEM 培养基,并于 37 ℃、5%CO2条件下培养。将HeLa-X 细胞随机分为miR-NC 组、miR-181d-5p mimics 组、si-NC 组、si-DDX3 组、si-DDX3+anti-miR-NC 组 、si-DDX3+anti-miR-181d-5p 组 。 待细胞融合度达70%~80%时,加入不含FBS 的DMEM培养基 1 500 µL 培养 2 h,按照 LipofectamineTM2000试剂说明书操作,分别转染miR-181d-5p 模拟物阴性对照、miR-181d-5p 模拟物、DDX3 siRNA 阴性对照、DDX3 siRNA、DDX3 siRNA 和 miR-181d-5p 抑制物阴性对照、DDX3 siRNA 和miR-181d-5p 抑制物序列 5 µL,6 h 后更换培养基为含 FBS 的 DMEM 培养基,继续培养24 h,用于后续实验。将转染后的HeLa-X细胞用4 Gy X射线照射,分别命名为4 Gy组、4 Gy+miR-NC组、4 Gy+miR-181d-5p mimics组、4 Gy+si-NC 组、4 Gy+si-DDX3 组、4 Gy+si-DDX3+anti-miRNC组、4 Gy+si-DDX3+anti-miR-181d-5p组。
1.6 HeLa-X 细胞凋亡检测 采用流式细胞术。转染后,将HeLa-X 细胞于4 Gy 辐射下培养24 h,收集各组细胞,用预冷的PBS洗3次,加入200µL Annexin V-FITC 结合液轻轻重悬细胞,之后分别加入Annexin V-FITC、碘化丙啶(PI)染色液各10µL,避光孵育2 h,进行流式细胞仪检测。
1.8 蛋白质印迹分析 使用预冷的RIPA裂解缓冲液提取细胞总蛋白,BCA试剂盒测定蛋白质浓度。使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶(PAGE)电泳分离40µg总蛋白,并将其转移到PVDF膜上。将膜用5%脱脂奶封闭1 h后,分别添加兔多克隆抗体anti-DDX3(1∶3 000)、anti-β-actin(1∶2 000)于 4 ℃下孵育过夜,然后与HRP标记的羊抗兔IgG二抗(1∶2 000)在室温条件下孵育2 h。每个样品设置6个重复,最后使用ECL化学发光试剂观察蛋白质显色情况。
2.1 miR-181d-5p在不同宫颈癌细胞系中的表达比较 miR-181d-5p 在正常宫颈上皮细胞HCer Epic、宫颈癌细胞SiHa、HeLa、C33A、HCC-94 中的相对表达量分别为1.03±0.12、0.52±0.04、0.21±0.01、0.43 ± 0.03、0.36 ± 0.02,与 HCer Epic 细胞比较,宫颈癌细胞SiHa、HeLa、C33A、HCC-94 中miR-181d-5p表达降低,且miR-181d-5p在HeLa细胞中的表达最低(P<0.05),因此选用HeLa细胞作为实验研究对象。miR-181d-5p在HeLa、HeLa-X细胞中的相对表达量分别为 1.05 ± 0.14、0.43 ± 0.06,与 HeLa 细胞比较,HeLa-X细胞中miR-181d-5p表达降低(P<0.05)。
1.4 各细胞系中miR-181d-5p 表达检测 采用qRT-PCR 法。使用TRIzol 试剂提取不同细胞中总RNA。利用TaqMan 逆转录试剂盒将RNA 合成为cDNA。使用ABI 7500 Real-Time PCR 系统和Trans-Start®Green qPCR SuperMix 试剂盒检测 miR-181d-5p 表达。miR-181d-5p 正向引物:5'-AACATTCATTGTTGTCGGTGG-3',反向引物:5'-GTGCAGGGTCCGAGGTATTC-3';U6 正 向 引 物 :5'-CTCGCTTCGGCAGCACA-3',反 向 引 物 :5' -AACGCTTCACGAATTTGCGT-3'。以U6 为内参,每个样品设置6个重复,采用2-ΔΔCT法计算基因相对表达量。
1.7 miR-181d-5p 与DDX3 靶向关系验证 采用双荧光素酶报告基因实验。使用starbase 网站预测miR-181d-5p 与DDX3 的结合位点。分别构建DDX3的野生型(WT)和突变型(MUT)3'-UTR 区质粒,标记 为 WT-DDX3、MUT-DDX3。 按 照 LipofectamineTM2000 转染试剂盒说明书将WT-DDX3 和MUTDDX3 分别与 miR-NC 或 miR-181d-5p mimics 共转染于 HeLa 细胞,每组设置 6 个复孔,转染 48 h 后,通过双荧光素酶测定系统行荧光素酶报告基因测定。
从该次研究结果可以看到,肠内营养是胰腺癌合并糖尿患者术后最佳营养的支持方式。主要是由于肠内营养治疗更加符合人体生理状态,肠内营养剂是经过门静脉系统吸收输送到肝脏的,这种营养支持方式不仅对机体循环干扰较小,同时利于蛋白质的生成和调节。同时肠内营养支持方式有助于维持患者肠道黏膜结构和功能的完整性,利于保持肠道固有菌群的正常生长,减少肠道细菌移位和肠源性高代谢,从而实现快速改善重症疾病患者营养状态的目的。
1.9 统计学方法 采用SPSS25.0统计软件。计量数据符合正态分布以表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
1.5 HeLa-X 细胞增殖能力检测 采用CCK-8 法。选择处于对数生长期的HeLa-X细胞,并以2×103个/孔的细胞密度接种于96 孔板中。用4 Gy 辐射剂量照射细胞,孵育48 h 后,添加10µL CCK-8 溶液于每个孔中。每组设置6 个复孔,利用酶标仪测定细胞在450 nm 处的光密度值(OD450值),OD450值越大表明细胞增殖能力越强。
(5)研发适合生产线的建筑3D打印设备。首先,开发与打印硬件设备良好兼容的设计软件是首要解决问题;其次,材料输送系统和打印喷头形式的设计,如何保证混凝土布料的精度;第三,研发具有良好力学性能,保温隔热性能,凝结硬化时间及抗裂性能等的新型打印材料;此外要想打印高层建筑,结构中的配筋问题也急需解决。
第二个例子是产生一个圆分布的电场,为此将8个辅助偶极子天线阵列沿圆周均匀放置。最后一个例子是生成开放L形的电场分布, 为此将5个辅助偶极子组成的接收天线阵列沿L形线均匀放置。两个例子的模拟和测试结果如图7和图8所示,模拟和测量结果基本一致。
2.2 过表达miR-181d-5p 对HeLa-X 细胞放射敏感性的影响 miR-181d-5p mimics 组HeLa-X 细胞中miR-181d-5p 相对表达量为 2.53 ± 0.31,高于空白组(1.02 ± 0.13)和 miR-NC 组(1.01 ± 0.12),提示细胞转染成功。与空白组比较,4 Gy组HeLa-X细胞增殖能力降低、细胞凋亡率升高(P均<0.05);与4 Gy 组和 4 Gy+miR-NC 组比较,4 Gy+miR-181d-5p mimics组细胞增殖能力降低、细胞凋亡率升高(P均<0.05),见表1。
表1 各组细胞增殖能力及细胞凋亡率比较()
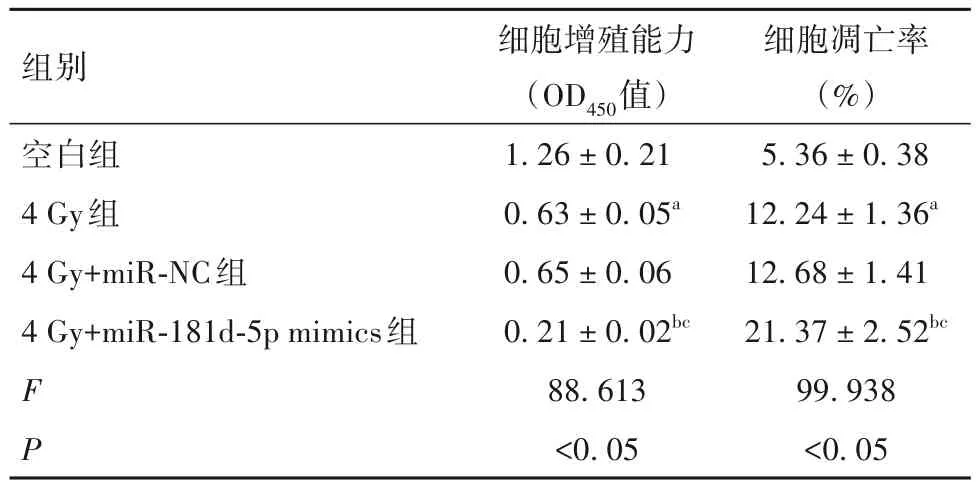
表1 各组细胞增殖能力及细胞凋亡率比较()
注:与空白组比较,aP<0.05;与4 Gy 组比较,bP<0.05;与4 Gy+miR-NC组比较,cP<0.05。
细胞凋亡率(%)5.36±0.38 12.24±1.36a 12.68±1.41 21.37±2.52bc 99.938<0.05组别空白组4 Gy组4 Gy+miR-NC组4 Gy+miR-181d-5p mimics组FP细胞增殖能力(OD450值)1.26±0.21 0.63±0.05a 0.65±0.06 0.21±0.02bc 88.613<0.05
2.4 miR-181d-5p 通 过 下 调 DDX3 增 强 HeLa-X 细胞放射敏感性 与空白组比较,4 Gy组HeLa-X细胞中DDX3 蛋白表达、细胞增殖能力降低,细胞凋亡率升高(P均<0.05);与4 Gy 组和4 Gy+si-NC 组比较,4 Gy+si-DDX3 组 HeLa-X 细胞中 DDX3 蛋白表达、细胞增殖能力降低,细胞凋亡率升高(P均<0.05);与4 Gy+si-DDX3 组和 4 Gy+si-DDX3+anti-miR-NC 组比较,4 Gy+si-DDX3+anti-miR-181d-5p 组 HeLa-X 细胞中DDX3蛋白表达、细胞增殖能力升高,细胞凋亡率降低(P均<0.05),见表2。
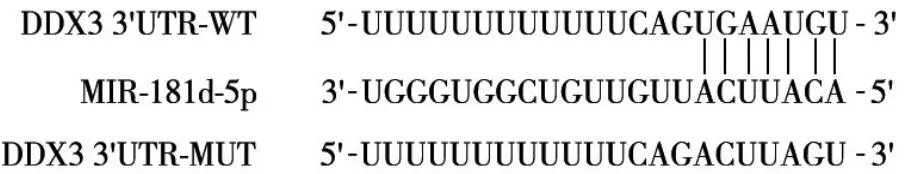
图1 starbase网站预测miR-181d-5p与DDX3的结合位点
2.3 miR-181d-5p靶向调控DDX3的表达 starbase网站预测miR-181d-5p 与DDX3 的结合位点结果见图1。双荧光素酶报告基因实验结果表明,miR-NC+WT-DDX3 组 、miR-181d-5p mimics+WT-DDX3 组 、miR-NC+MUT-DDX3 组、miR-181d-5p mimics+MUTDDX3 组荧光素酶相对活性分别为1.25 ± 0.16、0.31 ± 0.06、1.27 ± 0.14、1.24 ± 0.12,与miR-NC+WT-DDX3 组比较,miR-181d-5p mimics+WT-DDX3组荧光素酶相对活性降低(P<0.05),而miR-181d-5p mimics+MUT-DDX3 组 与 miR-NC+MUT-DDX3 组比较差异无统计学意义(P>0.05)。Western blotting结果显示,空白组、miR-NC 组、miR-181d-5p mimics组DDX3 蛋白相对表达量分别为1.08 ± 0.12、1.06 ± 0.13、0.41 ± 0.05,miR-181d-5p mimics 组DDX3 蛋白表达低于空白组和miR-NC 组(P均<0.05)。
表2 各组细胞中DDX3蛋白、细胞增殖能力、细胞凋亡率比较()
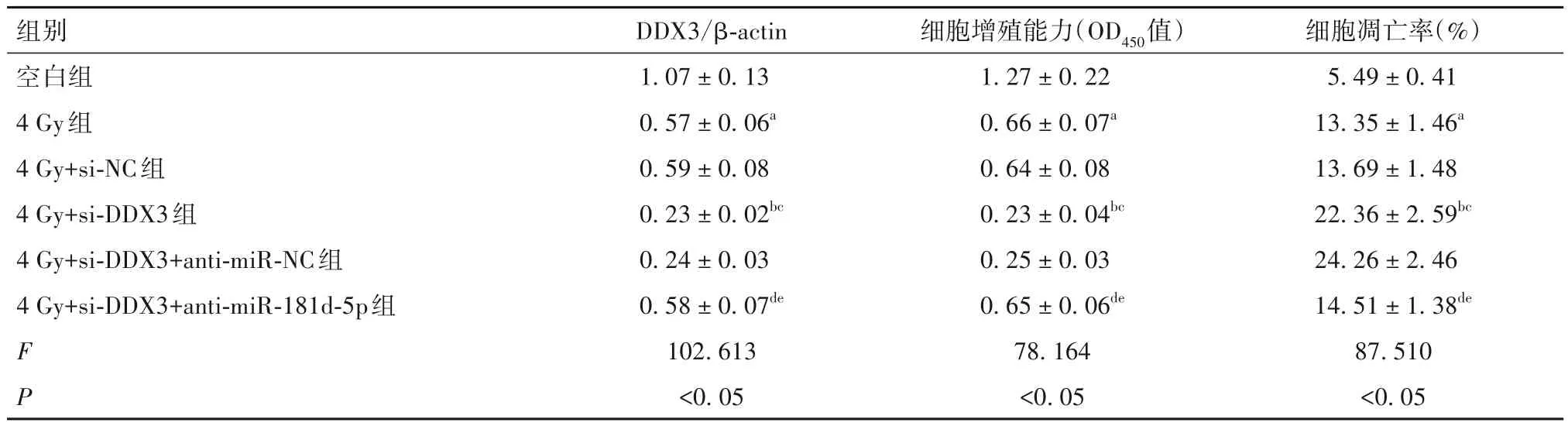
表2 各组细胞中DDX3蛋白、细胞增殖能力、细胞凋亡率比较()
注:与空白组比较,aP<0.05;与4 Gy组比较,bP<0.05;与4 Gy+si-NC组比较,cP<0.05;与4 Gy+si-DDX3组比较,dP<0.05;与4 Gy+si-DDX3+anti-miR-NC组比较,eP<0.05。
细胞凋亡率(%)5.49±0.41 13.35±1.46a 13.69±1.48 22.36±2.59bc 24.26±2.46 14.51±1.38de 87.510<0.05组别空白组4 Gy组4 Gy+si-NC组4 Gy+si-DDX3组4 Gy+si-DDX3+anti-miR-NC组4 Gy+si-DDX3+anti-miR-181d-5p组FP DDX3/β-actin 1.07±0.13 0.57±0.06a 0.59±0.08 0.23±0.02bc 0.24±0.03 0.58±0.07de 102.613<0.05细胞增殖能力(OD450值)1.27±0.22 0.66±0.07a 0.64±0.08 0.23±0.04bc 0.25±0.03 0.65±0.06de 78.164<0.05
3 讨论
外科手术和化学疗法联合放射疗法是目前治疗宫颈癌的主要方法。近年来,随着放射治疗技术的进步和发展,其在临床中的作用日益突出[9-10]。然而,癌细胞对放射治疗的敏感性降低成为部分患者肿瘤复发和转移的重要原因[11]。
地基处理后,新路竣工运营20 a后,路堤表面最大工后沉降为2.2 cm,在此沉降变形作用下,路面各结构层的拉应力云图,如图7所示。
研究表明,肿瘤细胞对X 射线的敏感性与miRNA 的异常表达密切相关[12]。据报道,过表达miR-195-5p可降低细胞存活率,诱导细胞凋亡,从而增强食管鳞癌细胞的放射敏感性[13];miR-3182 在肝癌细胞系中表达下调,miR-3182 过表达可促进肝癌细胞凋亡、抑制其存活从而提高肝癌细胞的放射敏感性[14];miR-145 在非小细胞肺癌细胞中低表达,上调其表达能够抑制细胞增殖,促进细胞凋亡,进而增强放射敏感性[15];miR-551b-3p 在肺癌细胞中低表达,过表达miR-551b-3p 可促进肺癌细胞凋亡,增强细胞放射敏感性[16]。本研究结果显示,miR-181d-5p在宫颈癌细胞SiHa、HeLa、C33A、HCC-94 中表达低于人正常宫颈上皮细胞HCer Epic,且miR-181d-5p 在HeLa 细胞中的表达量最低,因此选用HeLa 细胞作为实验研究对象。利用X射线照射构建放疗抵抗的宫颈癌细胞株HeLa-X,发现HeLa-X 细胞中miR-181d-5p 表达量低于 HeLa 细胞,经 4 Gy 辐射剂量照射后,过表达miR-181d-5p可抑制HeLa-X细胞增殖、促进细胞凋亡,进而增强HeLa-X 细胞的放射敏感性。
miRNA 可通过靶向其下游靶基因进而调控肿瘤细胞的放射敏感性[17]。如miR-133b 可靶向下调HER-2 表达,抑制结肠癌细胞存活,促进细胞凋亡,增强放射敏感性[18];上调 miR-3942-3p 通过靶向负调控BARD1,使癌细胞增殖能力降低,凋亡率升高,进而增强细胞的放射敏感性[19];miR-424-5p 通过靶向抑制HMGA1 表达提高宫颈癌细胞的放射敏感性[20];过表达 miR-216a-5p 通过靶向下调 TRIP4,抑制乳腺癌细胞增殖、促进细胞凋亡,从而增强细胞的放射敏感性[21]。DDX3 是具有 ATP 酶依赖性解旋酶活性的DEAD 盒RNA 解旋酶,其过表达可促进宫颈癌细胞的增殖、迁移和侵袭,并诱导上皮间质转化[22]。本研究结果显示,双荧光素酶报告基因实验证实 DDX3 为 miR-181d-5p 的靶基因,miR-181d-5p可靶向下调DDX3 蛋白表达,经4 Gy 辐射剂量照射且抑制DDX3表达后,细胞增殖能力降低、凋亡能力增强,而在该基础上抑制miR-181d-5p 表达后,细胞增殖、凋亡能力又恢复到4 Gy 辐射剂量照射时的状态,提示miR-181d-5p 通过下调DDX3 增强HeLa-X细胞的放射敏感性。
综上所述,miR-181d-5p 在宫颈癌细胞中低表达,过表达miR-181d-5p 通过靶向下调DDX3 表达,抑制HeLa-X 细胞增殖,促进HeLa-X 细胞凋亡,进而增强HeLa-X细胞的放射敏感性。

