骨钙素在神经退行性疾病中的研究进展
康宁 杨宁 郭向阳
北京大学第三医院麻醉科,北京 100191
1 骨钙素的结构与功能
1.1 骨钙素的结构
骨钙素(osteocalcin,OC)是由成骨细胞产生的非胶原蛋白,部分存储在骨基质中,最早由Price从牛骨和人骨中分离出来。由 49个氨基酸(在小鼠中为46个)组成,被认为是骨形成的生物标志物[1]。OC结构中含有3个谷氨酸残基,在γ-谷氨酰基羧化酶的作用下,以维生素K、二氧化碳作为辅助因子进行羧化[2-3]。羧化的OC增加了对羟基磷灰石晶体的亲和力,嵌入在骨基质中[4]。在骨吸收过程中,OC在吸收陷窝的酸性环境下脱羧,成为羧化不全骨钙素(undercarboxylated osteocalcin,GluOC),这降低了其对骨的亲和力,GluOC会释放进入血液循环作用于全身多个器官。见图1。
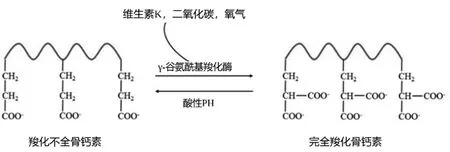
图1 骨钙素与羧化不全骨钙素的结构及相互转变(引用并改编自文献[5])Fig.1 Structure of OC and GluOC and transformation (cited and adapted from literature [5])
1.2 OC与外周器官
GluOC被认为是OC的活性形式[6],除了调节骨矿化外,还可以调节全身能量代谢及性功能[7]。OC可以通过结合于脂肪细胞、肝细胞、骨骼肌细胞、胰岛β细胞、睾丸间质细胞上的G蛋白偶联受体C族6组成员A(G-protein coupled receptor family C group 6 member A,Gprc6A),增加脂肪细胞中脂联素的表达,使脂肪细胞对胰岛素的敏感性增加[8];增加肝细胞对胰岛素的敏感性,减少肝脏中脂肪的积累[4];促进骨骼肌细胞对葡萄糖的摄取及细胞中线粒体的生物发生[9];促进胰岛β细胞的增殖及胰岛素的合成与分泌[7];增加睾丸间质细胞中睾酮的合成分泌,进而调节男性性功能[10]。有研究表明,骨钙素与相应受体结合后,至少招募了两条信号通路:①磷脂酶C(phospholipase C,PLC)-1,4,5-三磷酸肌醇(inositol 1, 4, 5-trisphosphate,IP3)-Ca2+;②腺苷酸环化酶(adenylyl cyclase,cAMP)-蛋白激酶A(protein kinase A,PKA)-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MEK)-细胞外信号调节激酶(extracellular signal regulated kinase,ERK)[11]。
1.3 OC与中枢神经系统
近年来研究还发现,血液循环中的GluOC可以穿过血脑屏障,与海马CA3区中脑的腹侧被盖区(ventral tegmental area,VTA)、脑干中缝背核(dorsal raphe nucleus,DRN)和中缝内核(medial raphe nucleus of brainstem,MRN)神经元上的Gpr158结合,进而促进单胺类神经递质、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和视网膜母细胞瘤结合蛋白48(retinoblastoma associated protein 48,RbAp48)的合成,减少GABA的合成,从而促进空间学习和记忆,抑制焦虑、抑郁行为和年龄相关性记忆丧失[1]。最近Li等[12]的动物实验表明OC通过GPR37(G protein coupled receptor 37,Gpr37)调节中枢神经系统少突胶质细胞分化和髓鞘化的作用。Paula等[13]研究显示在0~9个月龄的雌性及雄性小鼠血清中OC水平呈现逐渐下降的趋势。Bradburn等[14]研究表明在30岁前的女性和50岁前的男性血OC水平迅速下降。Lori等[15]将3个月龄的野生型小鼠富含OC的血浆注射给16个月龄的老年小鼠体内,新物体识别实验和高架十字迷宫实验结果显示老年小鼠的认知水平得到改善,焦虑减轻。Oury等[16]在动物实验中发现OC会穿过胎盘屏障,促进胎儿神经发育,防止细胞凋亡。此外,在成年小鼠中,建立空间学习和记忆需要来自于母体的OC。以上提示OC水平的改变可能与年龄相关的认知记忆减退相关。见图2、3。
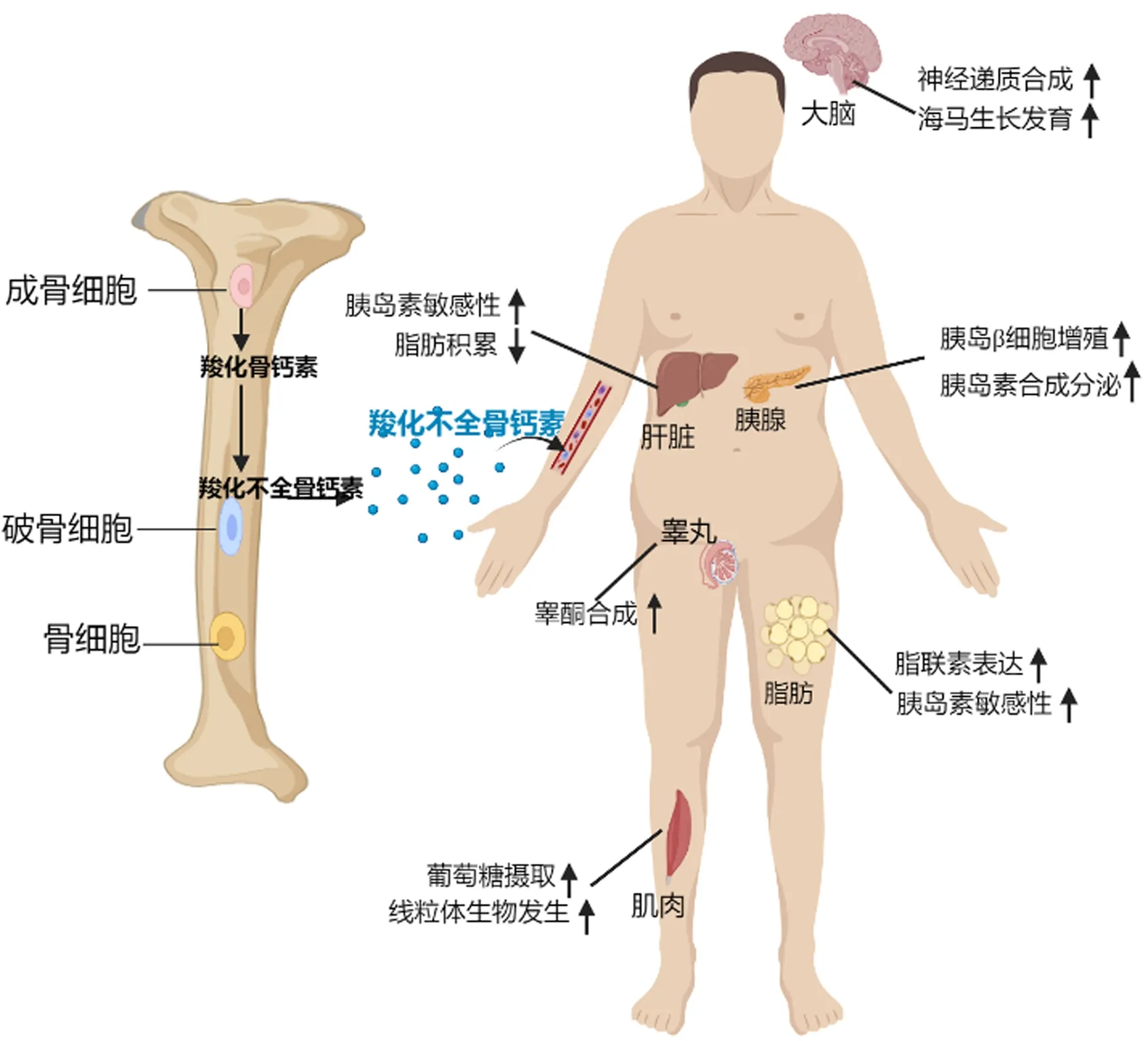
图2 骨钙素对全身器官的影响Fig.2 Effects of osteocalcin on systemic organs
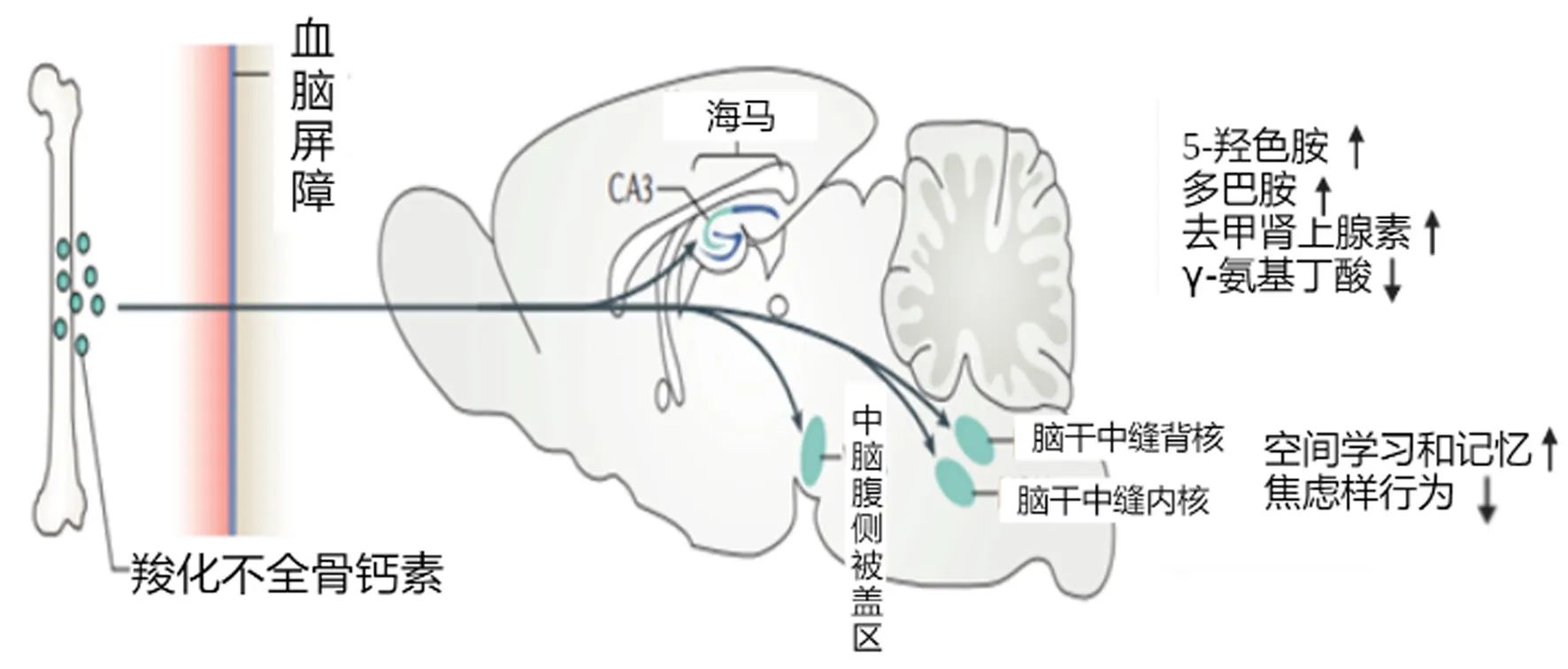
图3 骨钙素对中枢神经系统的影响(引用并改编自文献[1])Fig.3 Effects of osteocalcin on central nervous system (citation and adapted from the literature [1])
2 OC与阿尔茨海默症
2.1 阿尔茨海默症的发生发展与骨代谢存在联系
阿尔茨海默症(Alzheimer disease,AD)是痴呆症最常见的病因,约占所有痴呆症病例的一半,主要影响年龄在65岁以上的人群[17]。AD患者的特征性症状主要包括记忆丧失、语言障碍、执行功能障碍、定向障碍、情绪波动、失去动力、无法自我照顾和其他行为问题[18]。骨质疏松也是一种老年退行性疾病,主要发生在年龄大于65岁的老年人中。Zhao等[19]的研究表明AD患者髋骨骨折风险比正常对照组较高(OR=1.80,95%CI=1.54~2.11)。进一步分析显示,AD患者的髋关节骨密度(bone mineral density,BMD)较健康对照组低(SMD=-1.12,95%CI=-1.34~-0.90)。Natalia等[20]对71例早期AD患者和69例非AD对照组参与者进行了全身BMD测量,MRI检查并计算标准化全脑体积,评估认知功能。与对照组相比,早期AD组的平均BMD较低,且与年龄、性别、体育活动、吸烟、抑郁、雌激素替代治疗和E4载脂蛋白状态无关;在AD组患者中,BMD与全脑体积和认知功能呈正相关。以上结果表明AD患者骨量更容易丢失,并且可能与中枢机制有关。Zhou等[21]对946名年龄范围在60~75岁的男性和女性进行了腰椎和髋部双X线BMD测定研究,并在5年期间每年进行随访,采用中文版简易精神状态检查(mini-mental state examination,MMSE)和日常生活工具活动(activities of daily living,ADL)评估患者的认知和功能状态,结果显示BMD减少的程度与认知功能下降程度呈正相关,BMD在最低1/4的受试者与对照组相比,患AD的风险增加了2倍。以上研究提示,骨质疏松和AD发病之间可能存在着共同的生物学机制,骨代谢与AD的发生发展可能存在关联。
2.2 OC直接作用于中枢神经系统减轻AD中枢病变
骨是一个活跃的内分泌器官,可以通过分泌一系列蛋白影响其他器官功能。由成骨细胞分泌的OC会穿过血脑屏障影响中枢神经系统,并可能影响AD的病理生理过程。Oury等[16]的研究显示OC可以穿过大鼠血脑屏障与海马CA3区神经元结合,增加单胺类神经递质合成,减少GABA类神经递质合成从而改善大鼠认知功能。Shan等[22]给AD小鼠中枢和外周注射GluOC,结果显示一段时间后小鼠海马和皮质的淀粉纤维样斑块沉积以及海马APP和Aβ蛋白的表达明显减少,AKT/mTOF相关蛋白表达增加;体外实验采用老化Aβ1-42处理PC12细胞24 h,并提前2 h采用不同浓度GluOC干预,结果显示GluOC可减轻老化Aβ-42造成的PC12细胞活性损伤,增加细胞中AKT/mTOR相关蛋白的表达。以上研究提示在体内和体外实验GluOC均可以通过AKT/mTOR通路减轻AD小鼠中枢神经系统病变并且对受损神经元起到保护作用。
2.3 OC通过调节脂质代谢减轻AD的中枢病变
OC还可以通过影响脂代谢间接影响中枢神经系统,Chen等[23]用放射免疫法测定了783名男性和946名绝经后女性的血清总OC及血脂,发现血清OC水平和甘油三酯和总胆固醇呈负相关。Zhang等[24]研究发现GluOC通过抑制肝脏新生脂肪生成和促进脂肪酸β氧化改善了KKAy小鼠的血脂异常并减轻了肝脏脂肪变性并且这种改善作用呈剂量依赖性。Otani等[25]的动物实验显示高剂量GluOC通过激活CREB-p300的方式上调质膜FasL,进而激活邻近脂肪细胞的Fas信号,从而触发脂肪细胞坏死。以上研究表明OC可以调节全身脂代谢。高血脂会通过载脂蛋白增加β淀粉样蛋白(amyloid-β,Aβ)的形成来破坏神经突触的完整性,从而导致AD的病理变化[26],而OC可能通过调节血脂减轻AD中枢神经系统的病理变化。
2.4 OC通过调节糖代谢降低AD的发生风险
神经元对葡萄糖毒性较为敏感,急性或者慢性血糖紊乱都可以引起神经元损伤从而损害认知功能。有一项流行病学研究报告显示[27],2型糖尿病(tpye 2 diabetes mellitus,T2DM)患者患AD的风险比健康人高50%~100%。Yaffe等[28]对1 983名女性进行了研究,发现HbA1c水平>7.0%的参与者发生认知功能障碍的风险比健康人群增加了4倍。神经元摄取葡萄糖并不依赖胰岛素,当在高血糖环境下,细胞内葡萄糖水平会异常升高。在这种情况下,葡萄糖会被氧化形成自由基和活性羰基,进一步激活有丝分裂原活化蛋白激酶(MAPK),从而改变细胞表型状态,继而导致神经元受损。有研究显示[29],鼻内滴胰岛素可以改善AD患者认知水平。OC对糖代谢具有强大的调控作用,也许OC可以间接调节认知功能。Yang等[30]的一项研究显示与健康对照组相比,老年T2DM患者认知功能评分低于对照组(P=0.025),并且血清骨钙素水平低于对照组(P<0.01);并且在老年T2DM患者中MMSE分值与骨钙素水平呈正相关(r=-0.462,P=0.014)。以上研究结果提示,OC可能参与了糖尿病患者认知功能损害的过程,补充OC可能对于降低糖尿病转变为AD的风险具有一定的作用。
3 OC与帕金森病
3.1 帕金森病的发生发展与骨代谢存在联系
帕金森病(Parkinson disease,PD)是一种常见的神经退行性疾病,以黑质多巴胺能神经元(dopaminergic neuron,SN)进行性缺失和纹状体多巴胺损耗为主要的病理缺陷[31]。临床上以运动症状为主,包括肌强直、静止性震颤和运动迟缓。而由成骨细胞分泌的OC可与中脑神经元结合,促进多巴胺类神经递质的形成[16],可以推测PD与骨代谢之间存在联系。近年来有研究显示PD患者更容易发生骨质疏松。Bezza等[32]收集了52例PD患者和52名对照人员,用双能X线测量腰椎和髋骨BMD,结果显示PD患者BMD明显低于对照组(spine:1.031 vs. 1.175 g/cm;hip:0.968 vs. 1.054)。Lin等[33]收集了50例PD患者脑脊液及50例年龄相匹配的健康人的脑脊液,检测其中的OC,结果显示 PD患者脑脊液中OC水平明显低于健康对照组[PDvsHC 14 817.5 pg/mL (8 145.9~18 998.3) vs. 18 264 pg/mL (12 835.5~22 342.3)]。Guo等[34]在PD大鼠模型中得到了相同的结论。
3.2 OC可减少多巴胺能神经元的耗竭
Guo等[34]将OC直接注射到PD大鼠的右侧纹状体,结果显示6周后实验组大鼠的运动距离明显长于对照组,OC改善了实验组大鼠运动功能。进一步探究发现实验组大鼠黑质和纹状体TH+神经元耗竭明显减少。以上结果表明OC可以直接减轻PD大鼠中枢病变从而改善PD大鼠的运动功能障碍。Guo等[34]又进行了离体实验,观察OC对6-OHDA诱导的PC12细胞毒性的保护作用,并采用CCK8,流式细胞凋亡和凋亡蛋白检测手段进行验证;同时观察细胞模型组中AKT/GSK3β信号通路变化,并采用AKT/GSK3β相应抑制剂确认OC对神经细胞保护作用的机制。研究结果表明AKT/GSK3β介导了OC对PC12细胞的保护作用。以上研究提示OC可以通过AKT/GSK3β通路减少PD大鼠中多巴胺能神经元损耗进而改善PD大鼠运动症状。
3.3 OC可减轻中枢神经炎症
TNF-α和IL-1β等促炎因子的过表达是PD的常见特征[35],星形胶质细胞和小胶质细胞是大脑中最常见的两种与慢性炎症反应相关的细胞,参与PD等神经退行性疾病的发生发展[36-37]。Guo等[34]用6-OHDA损伤大鼠黑质并且测量了纹状体中TNF-α和IL-1β的mRNA水平,然后将黑质和纹状体中GFAP和Iba1阳性胶质细胞进行染色。结果显示,用6-OHDA损伤的大鼠黑质中,损伤侧星形胶质细胞显著增加;给予OC后纹状体中TNF-α和IL-1β的表达降低并且黑质中星形胶质细胞和小胶质细胞数量显著减少。以上研究提示OC可以通过降低炎症因子的表达以及抑制星形胶质细胞和小胶质细胞的增殖改善PD症状[38]。
3.4 OC通过肠道菌群影响PD
近年来,肠道菌群与中枢神经系统疾病的关系越来越受到关注[39-41],短链脂肪酸(short chain fatty acids,SCFAs)是肠道微生物的主要代谢物,将肠道微生物群的信号传递给宿主。有研究表明[42-43],SCFAs对调节脑功能和血液组织屏障的完整性有有益的作用。然而,与一般公认的有益作用相反,一项研究[40]显示,在PD模型中,SCFAs是加速神经炎症和α-突触核蛋白病的主要调节因子。因此,从微生物群角度寻找治疗PD的方法具有重要意义。
Hou等[44]用16SrRNA测序结果显示PD小鼠与对照组小鼠相比肠道菌群发生了明显的改变,厚壁菌门和拟杆菌门显著减少;而OC处理后显著逆转了这种变化。并且与对照组相比,PD小鼠粪便丙酸显著减少,但给予OC后显著逆转了这种变化。以上研究提示肠道群菌改变是PD的病理变化之一,OC可以改善PD小鼠肠道群菌组成,或许可以对PD患者起到一定治疗作用。
4 小结与展望
OC可以通过多种方式对AD及PD的病理过程产生影响。Oury等[16]提出,随着年龄增长改善骨骼健康可能对认知功能产生有益影响。Cheng等[45]的动物实验表明小鼠小胶质细胞自噬功能缺陷会激活炎症小体进而引起帕金森样症状。OC是否会影响小胶质细胞自噬从而改善PD相关症状,有待于进一步探究。亨廷顿舞蹈症也是一种神经退行性病变,有研究显示亨廷顿舞蹈症与多巴胺系统功能障碍有关[46],OC是否会对亨廷顿舞蹈症病理过程产生影响有待于进一步探索。未来,有必要更深入地研究OC对神经退行性疾病的作用机制,为OC作为外周潜在靶点治疗神经退行性疾病提供更多实验依据。

