原发性干燥综合征合并肾小管酸中毒患者发生骨质疏松的风险
刘晓敏 鲁宽亮 赵剑波 王永福 鲁芙爱*
1.内蒙古科技大学包头医学院第一附属医院,内蒙古 包头 014010 2.内蒙古包头市达茂联合旗医院,内蒙古 达茂联合旗 014500
原发性干燥综合征(primary Sjogren’s Syndrome,pSS)是一种以外分泌腺及多系统受累为主的自身免疫性疾病。骨质疏松(osteoporosis,OP)是一种全身性疾病,特点是骨密度降低,导致骨折风险增加。近年来有文献报道[1],pSS能够继发OP,可能是由于pSS的炎症反应及糖皮质激素的使用导致的骨丢失。另外,pSS还可累及肾脏,常见的表现为肾小管酸中毒(renal tubular acidosis,RTA),酸性环境能够引起钙磷代谢紊乱,致使骨溶解增高,进而引起骨损害[2]。本研究拟对pSS合并RTA患者骨密度的变化及意义进行探讨,为早期防止pSS合并RTA患者发生 OP及骨折提供理论依据,提高患者的生活质量。
1 资料与方法
1.1 研究对象
选取2017年-2021年于内蒙古科技大学包头医学院第一附属医院风湿科确诊的pSS患者64例,包括pSS合并RTA患者33例、pSS患者31例,同时选取体检科正常人群31例作为健康对照组。诊断标准:(1)pSS诊断符合2002年美国风湿病学会/欧洲抗风湿病联盟(ACR/EULAR)制定的诊断标准[3];(2)RTA的诊断主要依靠实验室检查[4]。纳入标准:年龄均大于18岁,且实验室指标、骨密度等资料均齐全。排除标准:(1)同时伴有两种及两种以上自身免疫性疾病;(2)伴有其他影响骨密度的疾病,如糖尿病、甲状腺疾病等。将受试者分为pSS合并RTA组、pSS组和健康对照组。其中pSS合并RTA组33例,包括女性32例、男性1例,平均年龄为(58.36±10.79)岁;pSS组31例,包括女性30例、男性1例,平均年龄为(57.61±11.07)岁;健康对照组31例,包括女性30例,男性1例,平均年龄为(56.65±9.89)岁;三组受试者的年龄(F=0.211)、性别(χ2=0.002)均无统计学差异(P>0.05),pSS合并RTA组和pSS组使用糖皮质激素的人数、剂量及时间均无统计学差异(P>0.05)。该研究通过了内蒙古科技大学包头医学院第一附属医院医学伦理会的批准。
1.2 骨密度测定
采用法国OSTEOCORE 双能X线骨密度测定仪检测三组受试者的3 D 骨密度、股骨二维骨密度(BMD)及10年骨折风险。骨质疏松的诊断参照WHO推荐的骨质疏松症诊断标准[5]:骨密度低于同性别、同种族健康成人的骨峰值不足 1 个标准差为骨量正常;骨密度降低1~2.5个标准差为骨量减少,降低≥2. 5 个标准差则为骨质疏松,符合骨质疏松诊断标准同时伴有一处或多处骨折时为严重骨质疏松。
1.3 25羟基维生素D测定
清晨抽取受试者空腹静脉血5 mL,于-80 ℃环境下冻存,融化后使用,采用ELISA方法进行检测,试剂盒为酶联生物提供。
1.4 统计学方法
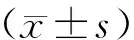
2 结果
2.1 各组受试者股骨3 D体积骨密度变化
比较pSS合并 RTA组、pSS组、健康对照组受试者股骨颈、大转子、转子间隙、全股骨的3 D体积骨密度。结果显示,pSS合并RTA组患者股骨骨小梁部位的体积骨密度较pSS组及健康对照组明显降低(P<0.05),见表1。

表1 pSS-RTA组、pSS组及健康对照组的股骨3D体积骨密度的比较Table.1 Comparison of 3D volume bone mineral density of femur in PSS-RTA group, pSS group and healthy control group
2.2 各组受试者股骨3 D平均骨皮质厚度变化
比较pSS合并RTA组、pSS组、健康对照组受试者股骨颈、股骨转子、股骨干的前中后段、侧面及总体的平均皮质骨厚度,结果提示pSS合并RTA组股骨颈的前、后节段、总体及股骨转子的平均皮质骨厚度较pSS组及健康对照组明显降低(P<0.05);pSS组股骨颈的侧面及股骨干的前节段平均皮质骨厚度较健康对照组明显降低(P<0.05),差异有统计学意义,见表2。
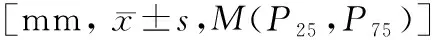
表2 pSS-RTA组、pSS组及健康对照组的股骨3D皮质骨厚度平均值的比较Table.2 Comparison of mean 3D cortical bone thickness of femur in PSS-RTA group, pSS group and healthy control group[mm,
2.3 各组受试者股骨、髋部二维骨矿密度的变化
比较pSS合并RTA组、pSS组、健康对照组受试者股骨颈、股骨转子、转子间隙、整髋等部位的二维BMD。结果表明,pSS合并 RTA组受试者股骨的BMD明显低于pSS组及健康对照组,pSS组受试者股骨转子的BMD明显低于健康对照组,比较差异有统计学意义(P<0.05),见表3。

表3 pSS-RTA组、pSS组及健康对照组的二维BMD的比较Table.3 Comparison of BMD in PSS-RTA group, pSS group and healthy control
2.4 各组受试者髋关节10年骨折风险评估
比较pSS合并RTA组、pSS组、健康对照组受试者的10年骨折风险,结果显示,pSS合并RTA组患者10年内骨折风险明显高于pSS组及健康对照组,差异有统计学意义(P<0.05),见表4。
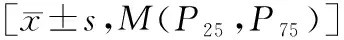
表4 pSS-RTA组、pSS组及健康对照组10年内骨折风险的比较Table.4 Comparison of fracture risk in PSS-RTA group, pSS group and healthy control group during 10 years
2.5 pSS合并RTA组血清中指标与髋部二维BMD比较
pSS合并RTA组患者血清中25羟基维生素D3较pSS组患者低(P<0.05),且血清中25羟基维生素D3水平与股骨颈二维BMD呈正相关(r=0.359,P<0.05),血钙、血钾、血磷、血沉、C-反应蛋白与股骨二维BMD均无相关性(P>0.05)。
3 讨论
风湿免疫病患者继发OP的风险较高,特别是类风湿关节炎、系统性红斑狼疮等疾病。本研究发现pSS患者股骨转子的BMD较健康人群低,提示pSS患者较健康人群更易发生OP。目前认为风湿免疫病患者OP的发生可能与自身免疫炎症激活破骨细胞、关节肿痛使患者活动减少、长期口服激素及免疫抑制剂等有关[1,6-7]。另外,pSS患者大部分为绝经后女性,雌激素水平下降也会增加pSS患者发生OP的风险[8]。
pSS患者可合并RTA,RTA是以近端小管重吸收HCO3-和(或)远端小管分泌H+障碍为特点的代谢性酸中毒,可引起矿物质代谢紊乱,进而导致骨质的破坏。Krieger等[9]在敲除质子受体OGR1的小鼠模型中发现骨转换增加,骨的形成大于骨的吸收,进而使骨密度增加,表明OGR1的缺失能够抑制酸诱导的骨吸收,为减轻RTA引起的骨丢失提供一种新的思路。慢性酸中毒能够引起骨钙的丢失,早期主要是通过物理化学矿物质溶解引起的钙丢失,后期的骨钙流失主要是由细胞介导的骨吸收所致,本质是由于酸中毒会增强成骨细胞中环氧化酶-2(COX-2)的表达,使前列腺素E2(PGE2)增加,导致破骨细胞生成增加、成骨细胞减少,最终使骨吸收增强[10]。酸中毒还能增强破骨细胞因子受体激活因子NF-κB配体(RANKL)的表达,进而减少破骨细胞的凋亡,增加骨吸收[11]。肿瘤坏死因子(TNF)能够增强RANKL的活性,pSS患者TNF升高,因此,pSS能够增强RTA的骨吸收,增加了pSS合并RTA患者继发OP的风险。本研究发现,pSS合并RTA组患者骨小梁部位的体积骨密度及股骨颈、股骨转子的平均皮质骨厚度较pSS组明显降低;还发现了pSS合并RTA组股骨BMD明显低于pSS组,提示pSS合并RTA患者更易发生OP,且全身均可发生骨量的流失,但是全身各部位骨量流失的差异较大,pSS合并RTA患者股骨骨小梁骨量流失较多。
长期的RTA可能会引起全身的pH下降,骨骼作为主要的质子缓冲液,借助矿物质来维持正常的pH值,骨骼的这种保护机制可能会引起高钙尿,致使骨钙的流失,最终引起骨质的损伤[12]。也有文献报道[13],RTA虽然能够引起患者全身性酸中毒,破坏骨质,但是患者并不会出现高钙尿,因此,RTA患者发生OP的风险是否与尿钙有关仍需进一步研究。另有文献报道[14],RTA抑制了肾小管重吸收钙,引起钙、磷代谢紊乱,甚至引起甲状旁腺功能亢进,最终导致骨钙流失,使OP和骨折的风险增加。RTA可能影响维生素D的活化,干扰钙磷平衡,进而破坏骨质[15]。本研究发现,pSS合并RTA患者血清中25羟基维生素D3水平较pSS患者水平低,且25羟基维生素D3与股骨颈的BMD呈正相关,提示RTA发生OP的风险增加可能与患者25羟基维生素D3水平降低有关,这可能是由于RTA损伤肾小管,致使1-α-羟化酶功能丧失,从而引起25羟基维生素D3水平降低[16],增加OP的风险。本研究并未发现血钙、血磷、血钾与骨密度改变有明显相关性,这可能是由于人体内98 %的钙储存于骨骼中,丢失的钙大部分来源于骨骼,未引起血中矿物质的改变。因此,RTA合并OP的具体机制目前尚不明确,未来仍需进行大量的研究来探讨。
杨肖红等[17]分析了9例RTA患者,其中有3例发生了病理性骨折,且有国内外文献报道,RTA患者可并发OP及骨软化症。本研究评估了受试者10年的骨折风险,发现pSS合并RTA组较pSS组患者10年内骨折风险明显增高,提示pSS合并RTA患者有较高的骨折风险,并认为全身的炎症反应、绝经女性、年龄大、糖皮质激素的使用都是这类患者发生骨折的相关危险因素[7]。但是有些患者发生骨质疏松后的临床症状并不明显,往往容易被忽视而延误诊治。因此,临床医生应关注pSS患者,尤其是pSS合并RTA患者的骨密度,并在早期给予积极干预,以防止OP及骨折的发生。
综上,pSS合并RTA患者发生OP及骨折的风险较高,发病机制较复杂,早期临床表现较隐匿。而一旦发生骨质疏松性骨折会显著降低患者的生活质量,甚至降低生存率。建议临床医生应在pSS合并RTA疾病早期开始筛查OP及骨折的相关危险因素,监测骨密度,以便及早发现OP、减少骨折的发生,提高患者的生活质量,改善预后。

