基于八角转录组序列的SSR分子标记引物开发
余兴华,杨艳梅,李玉祥,陶永宏,孟凡来,滕 娟
(1.文山州农业科学院,云南 文山 663099;2.云南农业大学,昆明 650201)
【研究意义】八角茴香又称八角、大料,是木兰科八角属植物,主产于中国的广西、云南、贵州等省。八角具有浓郁的香气,在增香矫味、腥膻味去除、卤制品的制作等方面具有很好的调味作用[1]。同时具有药用价值[2],由于其味甘、性温,具有开胃理气、暖肾散寒等功效,可用于治疗寒疝腹痛、胃寒呕吐、肾虚腰痛、脘腹冷痛等症[3]。八角为二倍体(2n=28)[4],在中国已有一千多年的栽培历史,经过长期的自然选择,其叶、花、果、树形、分枝习性等方面具有明显的差异,形成了众多的类型和农家品种,遗传多样性丰富[5]。目前,八角良种选育主要以优树选择为主,依据表型、生物学特性等进行评选,通过这种方式评选出的优良单株易受环境影响、稳定性差。【前人研究进展】分子标记技术是遗传改良和种质资源研究中一个有效的研究方法和辅助手段,孙雪阳[6]利用AFLP分子标记鉴别八角属种质资源;吴涛等[7]利用筛选出的13个ISSR引物分析八角居群内和居群间遗传多样性与种质资源鉴定;陈海云等[8]利用RAPD分子标记研究了云南省八角的遗传多样性,但少有研究者应用SSR标记进行八角分子生物学的相关研究。简单重复序列(Simple Sequence Repeat,SSR)又称微卫星标记,分为基因组(Genormic-SSR)和表达序列标签(Expressed sequence tags-SSR, EST-SSR)标记,从基因组序列和转录的RNA序列中鉴定出来[9]。其串联重复序列包含1~6个核苷酸单元,具有多态性高、共显性遗传和重复性好等优势。近年来,第二代转录组测序技术的高通量、低成本、精确、高效的特点,可较好的用于发掘不同物种的综合表达序列数据[10]。已在杜仲[11]、红松[12]、山桐子[13]、枸杞[14]等物种上得到了较好的应用。基于DNA测序仪的SSR荧光标记毛细管电泳法,检测效率高于银染法,结果精确灵敏,在分子标记开发[15]、基因分型[16]、种质鉴定[17]等中得到很好的结合。【本研究切入点】随着研究的不断深入,需要对八角进行遗传改良、种质创新、遗传多样性评价等方面的系统研究,而八角SSR标记的开发研究还缺乏。【拟解决的关键问题】本研究通过转录组Illumina HiSeq4000 测序平台测序获得八角的SSRs数据,开发其EST-SSR标记,并对其特征、分布及组成进行分析,进一步开发出适用于八角的SSR分子标记,为八角遗传多样性、种质资源的挖掘利用、分子标记辅助育种等提供理论依据。
1 材料与方法
1.1 转录组数据来源
于2020年8月取云南省文山州西畴县香坪山林场柔枝红花八角的根、茎、叶、果4个部分组织,采集后用蒸馏水冲洗并擦干表面,然后立即放入液氮中冻结并转存于-80 ℃保存备用。样品送往广州基迪奥生物科技有限公司并利用Illumina高通量测序技术获取八角转录组数据,共得到44 267条Unigenes。
1.2 材料编号及DNA提取
用于SSR引物筛选的材料采自本课题组收集保存的8个单株,均为生产上的栽培种质,2份来自广西,6份来自文山,其花的颜色包含红花和白花2种类型,柔枝红花八角材料编号为:2020-303、2020-304、2020-215、2020-261、2020-307、2020-308;柔枝白花八角材料编号为2020-305和2020-306,其中2020-307、2020-308的种质来源于广西。在枝条的顶端,采集幼嫩叶并立即带回实验室使用试剂盒TSINGKE提取植物DNA。
1.3 EST-SSR引物设计与筛选
在八角转录组数中,利用MISA(Microsatellite,http://pgrc.ipk-gatersleben.de/misa/)软件进行微卫星的挖掘,参数设置为:二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸重复类型的最少重复次数分别为6、5、4、4、4次;2个SSR 之间的距离最大为100 bp;运用Primer3.0(http://www.broadinstitute.org/genome_software/other/primer3.html)在SSR位点的侧翼进行引物设计,其主要参数为:每个位点设计3对引物;引物长度18~27 bp;退火温度(Tm)为57~63 ℃;GC含量为50%~60%;预期扩增片段长度100~300 bp;其它参数为默认值。随机挑选100对引物送昆明擎科生物科技有限公司合成,使用8份材料进行引物筛选。PCR 扩增体系为20 μL,其中金牌 Mix(green) 16.45 μL、Primer F(加接头)0.15 μL、Primer R 1.2 μL、Tag (荧光:CAGTCGGGC GTCATCA)1.2 μL、DNA 1 μL。扩增程序为:98 ℃预变性2 min; 98 ℃变性10 s,58~60 ℃退火10 s,72 ℃ 10 s,35个循环;72 ℃延伸5 min,4 ℃保存。将扩增好的PCR产物进行琼脂糖凝胶电泳,通过胶图确定模板浓度,加水稀释到毛细管电泳所需浓度,上机到3730测序仪进行毛线管电泳。随后根据位点信息筛选出特异性高,多态性好的引物。
1.4 数据统计与分析
应用Excel 2010进行图表的制作与统计,电泳结果通过Gene Mapper 4.1软件进行统计分析,将有效峰转化为0、1原始数据矩阵。应用POPGENE Version 1.32软件计算观测等位基因数(Na)、有效等位基因数(Ne)、香农指数(I)、多态性信息指数(PIC)、观测杂合度(Ho)、期望杂合度(He)等SSR位点的遗传多样性指标。用NTSYSpc Version 2.10软件按照非加权组平均法(UPGMA)进行聚类分析。平均距离=搜索序列总长度/SSR个数;SSR出现频率=搜索出的SSR个数/搜索序列数;SSR发生频率=搜索出的含有SSR的序列数目/搜索序列数目。
2 结果与分析
2.1 八角转录组序列中SSR的总体特点
通过对八角转录组的44 267条Unigenes序列进行搜索(表1),结果表明碱基序列总数为44 112 675 bp,发现其中6304条Unigenes序列中含有8210个SSR 位点,其中含1个EST-SSR 位点的Unigenes有4919条,比例为11.11%。含有2个或2个以上的EST-SSR 位点的Unigenes有1385 条,比例为3.13%。有923条Unigenes为复合SSR,比例为2.09%。Unigene出现频率为18.55%,SSR 发生频率为14.24%,平均每5.37 kb出现一个SSR。
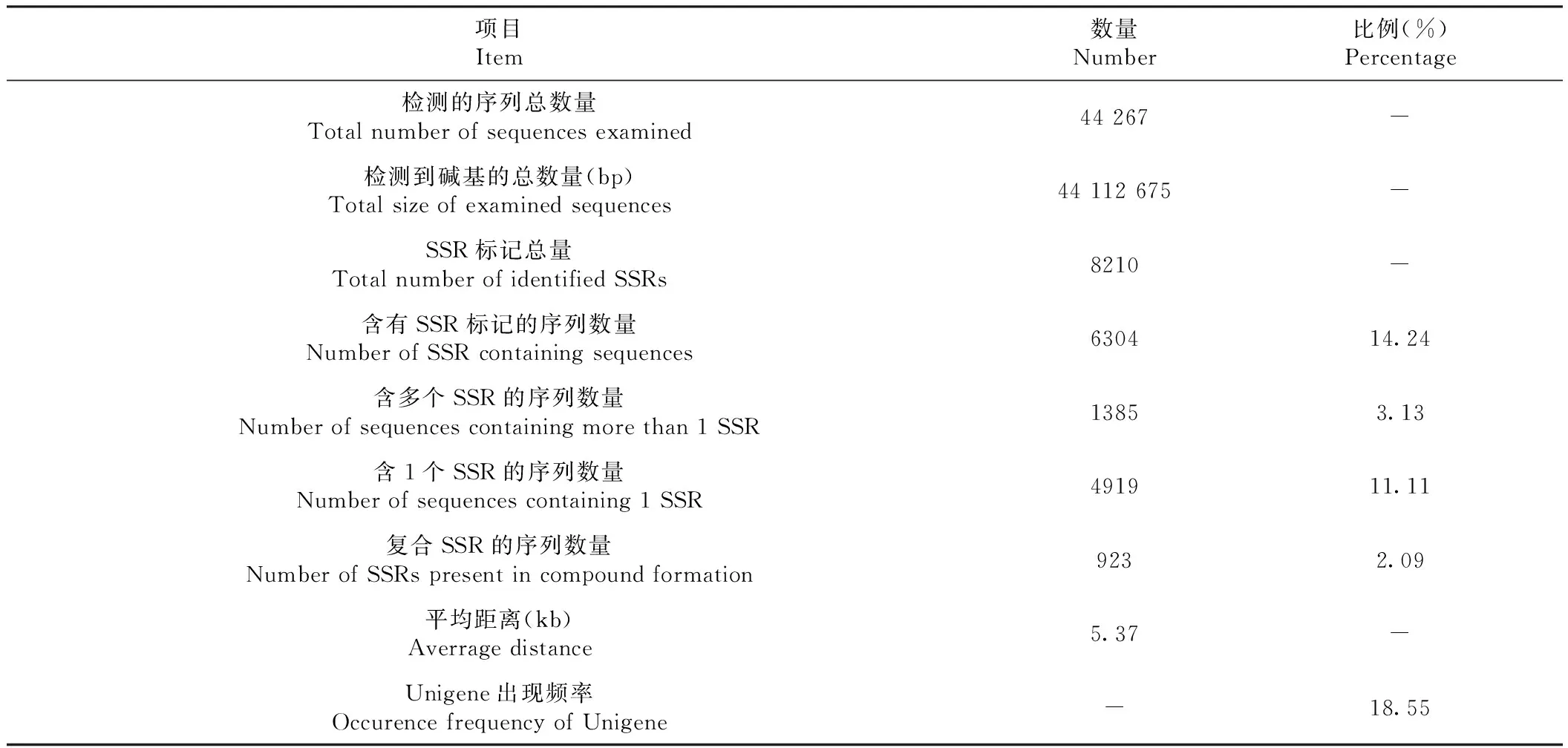
表1 八角转录组中SSR分布情况Table 1 Distribution of SSR in Illicium verum transcriptomic sequences
2.2 八角转录组中SSR基序类型与频率
八角转录组微卫星重复类型较为丰富,且检出的各重复类型EST-SSR的数量相差较大。其中,二核苷酸重复数最多,为4206个,其次是三核苷酸,为3366个,四核苷酸为282个,五核苷酸为111个,六核苷酸为245个(图1)。在二核苷酸中,AG/CT出现的频率最高,为3779个,占比46.03%;其次是AC/GT(391个,占比4.76%);接着是AT/AT(28个,占比0.34%)。三核苷酸主要有9种类型,AAG/CTT的占比最高(1361个,占比16.58%);其次是ACC/GGT(636个,占比7.75%);其它类型及占比依次为:ATC/ATG(5.36%)、AGC/CTG(4.14%)、AGG/CCT(2.18%)、AAC/GTT(2.18%)、CCG/CGG(1.69%)、ACG/CCT(0.54%)、ACT/AGT(0.34%)。四、五、六核苷酸的重复类型及占比相对较少,分别为282、111、245个,占比分别是3.43%、1.35%、2.98%。
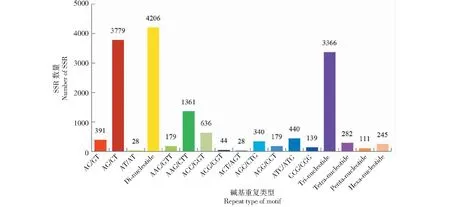
图1 八角转录组SSR基序类型分布特征Fig.1 Distribution characteristics of SSR motif types in the transcriptome of Illicium verum
2.3 八角转录组中SSR基序重复次数与长度分布
在八角转录组中,SSR重复单元的重复次数为4~40次(图2),其中4次重复为473个,占比5.76%;5次重复数最多,为1854个,占比22.58%;再者是6次重复,为1628个,占比19.83%;7~14次重复及占比分别为:905个(11.02%)、644个(7.84%)、483个(5.88%)、311个(3.79%)、201个(2.45%)、184个(2.24%)、146个(1.78%)、234个(2.85%)。基序大于15次的重复较少,共占13.97%。八角转录组微卫星长度分布为12~80 bp个碱基不等(图3),重复序列长度12~15 bp的最多,为3070个(37.39%);其次是长度16~20 bp,为2146个(26.14%);21~25 bp和26~30 bp分别为1160个(14.13%)、793个(9.66%),大于31 bp的占比为12.68%。

图2 八角转录组中SSR数量随重复次数的变化Fig.2 Changes of the number of SSR with repeat times of motif in Illicium verum transcriptome
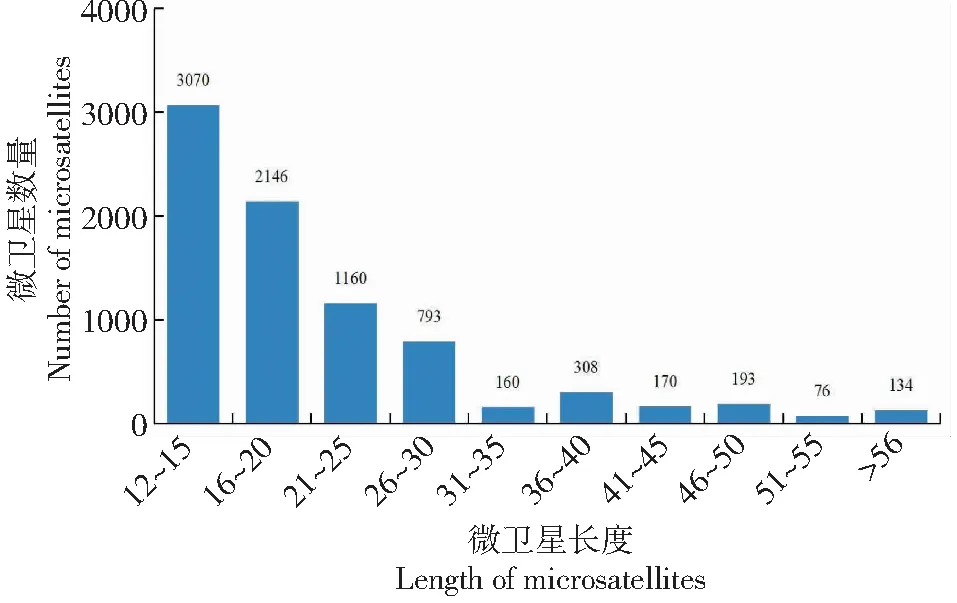
图3 八角转录组数据中微卫星的长度分布Fig.3 Length distribution of microsatellites in Illicium verum transcriptome
2.4 EST-SSR 引物筛选及多态性分析
为了验证所设计引物标记的可用性,随机选择100 对EST-SSR引物进行扩增,共筛选出16对多态性较高的引物(表2)。其筛选到的SSR重复基序以二重复为主,包含9对,其次三重复有5对,四重复有2对。8个样本共检测出80个等位基因位点,Na在3~8,平均值为5,引物IvSSR15最高;Ho为0.13(IvSSR39)~0.88(IvSSR33),平均值为0.50;He为0.54(IvSSR77)~0.88(IvSSR9),平均值为0.72;Ne和I数值变化范围分别为2.03~5.82、0.83~1.84,平均值分别为3.44和1.34,Ne和I最高的引物是IvSSR5,最低的引物是IvSSR77。PIC除引物IvSSR77为0.43外,其余引物PIC均大于0.5,平均值为0.63,IvSSR5、IvSSR9、IvSSR15、IvSSR48具有较高的PIC值,呈现出较高的多态性信息。图4为部分八角种质IvSSR9引物的SSR 位点基因型,呈现出在不同位点的基因型差异。

图4 4份八角种质IvSSR9的SSR 位点基因型Fig.4 IvSSR9 SSR locus genotypes of 4 Illicium verum germplasm
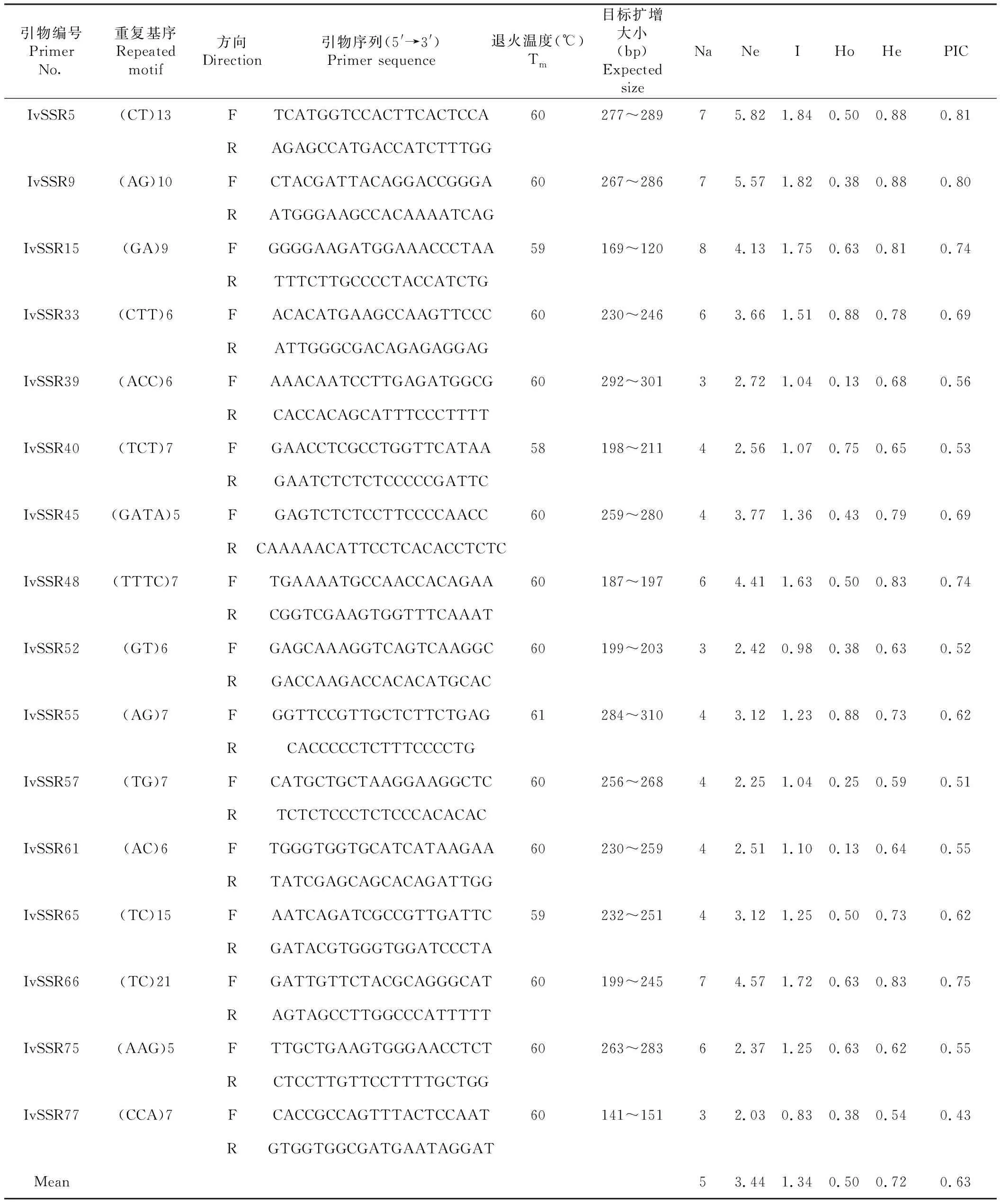
表2 16 对EST-SSR引物在8份八角种质中的特征Table 2 Genetic characteristics of 8 Illicium verum germplasm as revealed by 16 pairs of EST-SSR primers
2.5 基于EST-SSR 标记的遗传关系分析
基于16对多态性SSR引物分析8个样本的遗传关系(图5),UPGMA聚类图总体上呈现出白花类型与红花类型八角的分类,2个白花类型八角2020-305、2020-306的亲缘关系较近,相似系数为0.825,与其它红花类型的八角亲缘关系相对较远。红花类型的八角单株间同样具有不同的遗传关系,其遗传距离为0.525~0.713,2020-303与2020-305、2020-306的亲缘关系较远,表明八角不同花色种质间的亲缘关系存在差异。不同地理来源之间的八角种质并未形成明显的差异,这可能与八角种质的交流有关,文山与广西相邻,文山种植的八角普遍由广西引进,两地种质间的亲缘关系自然较为相近。因此,应用开发的SSR分子标记判断种质遗传关系可为八角遗传多样性、育种改良等提供依据。

图5 基于SSR标记的8份八角种质聚类Fig.5 Cluster of 8 Illicium verum varieties based on SSR markers
3 讨 论
3.1 八角EST序列中SSR的特征
本研究基于八角转录组的44 267条Unigenes展开SSR 分析和引物开发,发现含有SSR 位点标记的序列数量有6304个,发生频率为14.24%,平均每5.37 kb出现一个SSR位点。在不同物种间EST-SSR的发生频率存在很大的差异[18],马尾松4.69%[19]、荔枝16.53%[20]、刺梨20.37%[21]。这与SSR的估计频率、数据库的大小、SSR搜索标准及使用的挖掘工具有关[18]。研究者对不同物种EST-SSR的重复基序分析指出不同植物的主要重复类型不一样,但二核苷酸和三核苷酸是最常见的EST-SSR重复基序类型[22],二核苷酸重复数量较多的物种是桃子[23]、橡胶[24]、红松[12]、水杉[25]、杜仲[11]等。三核苷酸重复数量较多的物种是柑橘[26]、杉木[27]、文冠果[28]等。八角EST-SSR结构中,二核苷酸重复数最多,为4206个,占比26.70%;其次是三核苷酸,为3366个,占比21.37%。二核苷酸中AG/CT出现的频率最高,占比为46.03%,其二核苷酸类型与火龙果[29]、草莓[30]、猕猴桃[31]研究结果一致。AG/CT可能与丙氨酸和亮氨酸的密码子CUC和UCU关系密切,也是蛋白中最为常见的2种氨基酸[32]。植物中,较常见的三碱基重复是AAG[33],在识别出八角EST-SSR位点中,三核苷酸中AAG/CTT重复基元丰富,有1361个,发生频率为16.58%,与胡椒[34]、刺梨[21]、水松[35]研究认为三核苷酸中主要重复类型是AAG/CTT 的结论相一致。二核苷酸中AG/CT重复基序占优势,三核苷酸中AAG/CTT重复基序占优势,这与双子叶植物中AAG/CTT重复基序占优势的规律相符合[36]。
3.2 引物的筛选及遗传多样性
本研究从100对SSR引物中仅筛选出16对多态性、稳定性好的SSR引物,占引物总数的16%,包含二、三、四核苷酸,以二、三核苷酸重复的低级单元序列为主,呈现出低级单元大于高级单元SSR的多态性,这与Dreisigacker等[37]研究结果一致,因此在筛选SSR引物时应侧重于含低级单元的重复基序。引物平均PIC为0.63,它的大小反映等位基因的数量与分布频率[38],可作为检测引物多态性能力的一种度量指标。PIC 值大于0.5,代表位点具有高度多态性,基因变异程度大;在0.25~0.50,代表位点具有中度多态性,基因变异程度一般;PIC 值小于0.25 时代表位点具有低多态性,基因变异程度不明显[39]。本研究中除IvSSR77的PIC为0.43外,其余15对引物均大于0.5,其中IvSSR5、IvSSR9、IvSSR15、IvSSR33、IvSSR48、IvSSR55、IvSSR66的Na和PIC值相对较高,具有高度的多态性,可为核心引物。SSR标记在属内种间乃至属间的基因组具有一定的通用性[40-41],全世界八角属植物约50种,中国约有30个种[42],应用高通量测序开发的八角EST-SSR引物可为近缘属种鉴定、遗传多样性评价、分子标记辅助育种等提供依据。8个样本的亲缘关系表明白花八角与红花八角具有不同的遗传距离,红花类型的单株间同样具有不同的遗传关系,表明不用优良单株具有较高的遗传多样性和广泛的遗传基础。若需要了解更多八角的遗传信息和遗传关系,还需选取更多的试验材料和SSR标记。
3.3 关于SSR标记的检测方法
SSR标记检测法常用琼脂糖凝胶电泳法、聚丙烯酰胺电泳法和毛细管荧光电泳法,琼脂糖凝胶电泳法分离结果不理想,聚丙烯酰胺电泳法需要经过电泳和银染2个步骤,过程繁琐,且易产生杂带的干扰。荧光标记毛细管电泳法是以DNA 测序仪为平台,具有所需样量少,精确度、灵敏度高,自动化的特点[16]。本研究采用ABI3730 DNA分析仪对100对荧光SSR引物扩增、筛选与分析,试验结果更加客观。
4 结 论
本研究将八角转录组测序获得的44 267条Unigene进行了简单重复序列位点挖掘,共获得8210个SSR位点,发生频率为14.24%。SSR位点中二、三核苷酸重复类型占主导地位,二核苷酸中AG/CT出现的频率最高,三核苷酸中AAG/CTT出现的频率最高。不同SSR的重复次数为4~40次,长度分布为12~80 bp。随机选择100对EST-SSR引物进行扩增,共筛选出16对多态性较高的引物,引物以二重复基序为主。运用筛选到的多态性引物分析优良单株间的遗传关系,初步验证了SSR位点在八角标记中的可行性。开发的EST-SSR引物可为八角遗传多样性分析、指纹图谱构建、分子标记辅助育种等奠定基础。

