低磷胁迫条件下大豆磷高效近等基因系相关酶活性的变化
董蓉娇,彭进乔,尹元萍,王天明,梁 坤,杨晓菲,董文汉,张雅琼,梁 泉
(1.云南农业大学农学与生物技术学院,昆明 650201;2.云南农业大学资环学院,昆明 650201;3.云南农业大学科技处,昆明 650201;4.云南中医药大学民族医药学院,昆明 650500)
【研究意义】磷是作物养分三要素之一,参与了植物的光合作用、呼吸代谢、能量转化、信号转导、生物大分子合成以及酶活性的调节等,缺磷将导致作物营养失调,最终影响其产量和品质。作物所需的磷素90%以上来自土壤,土壤缺磷的现象在世界范围内普遍存在,至少有30%~40% 的作物产量受到低磷胁迫的严重抑制,中国南方地区酸性土壤上尤为严重[1]。土壤中全磷含量并不低,但由于有效磷含量低、磷的移动性差、磷容易被土壤固定,以及磷的当季利用率低等原因[2-3],远远不能满足作物生长发育的需要。传统种植中主要通过施用磷肥来解决土壤磷供应不足的问题。但是,施用的磷肥容易被土壤固定为难溶性磷,并且磷肥的当季利用率一般只有10%~20%,大部分磷肥由于不能被作物及时吸收利用而流失,导致水体富营养化,造成环境的污染。因此,开展作物磷高效利用的种质资源筛选,培育磷高效利用的作物新品种,提高作物活化和利用土壤磷库的能力,是解决作物需磷与土壤供磷矛盾、改善植物磷素营养状况的有效途径。植物对磷的吸收和利用能力的相对大小以磷效率(Phosphorus efficiency)来表示。了解作物高效吸收利用磷的生理和分子机制是作物磷效率遗传改良的基础和关键。前人提出诸如生理指示性状、生长发育指标以及经济产量等一系列磷效率的评价指标,如根系形态[4]、根冠比[5]、单株籽粒重[6]等。但由于取样分析难度大以及缺乏特异性指标,导致准确性不高、筛选效率低。【前人研究进展】拟南芥[7]、水稻[8]、大豆[9]、菜豆[10]、玉米[11]、柱花草[12]、脐橙[13]在低磷胁迫条件下根系酸性磷酸酶(ACP)活性都增加。田江等研究表明大豆真叶和根ACP活性随着缺磷处理时间显著增加[14]。敖雪等在对磷胁迫条件下不同大豆基因型保护酶活性的研究中,发现磷高效品种的过氧化物酶(POD)活性在生殖生长阶段较高,后期仍保持较高水平[15]。李涛通过对低磷胁迫下熊猫豆侧根增多的生理机制研究,发现低磷胁迫条件下根系中吲哚乙酸氧化酶(IAAO)和POD活性高于正常施磷水平[16]。李玉京等研究表明低磷营养胁迫条件下,长春偃麦草—中国春和灯芯偃麦草—中国春两套二体异附加系分泌的ACP和核糖核酸酶(RNAse)活性都不同程度的显著提高[17]。【本研究切入点】根系是植物吸收利用土壤磷的主要器官。因此,提高作物磷效率重点在于提高根系对磷的吸收利用。目前关于低磷胁迫条件下大豆根际酶活性变化方面的相关研究较少。【拟解决的关键问题】本研究设置高磷(1 mmol/L KH2PO4)和低磷(0.5 μmol/L KH2PO4)的水培试验,探索大豆磷高效近等基因系根际ACP、POD、RNAse、IAAO活性的变化,为大豆耐低磷生理机制及磷高效大豆品种选育提供依据。
1 材料与方法
1.1 材料
供试材料为本课题组培育的大豆磷高效相关根形态构型近等基因系(NIL)[18]及其受体亲本BD2(CK)。
1.2 方法
1.2.1 试验设计 采用水培试验,在云南农业大学温室进行,设置高磷(1 mmol/L KH2PO4,HP)和低磷(0.5 μmol/L KH2PO4,LP)2个磷水平,3次重复,每重复中NIL和BD2分别种植12株,每批次测定1种酶,15 d取样分析。
每个处理各挑选60粒饱满种子,用10%过氧化氢进行表面消毒,放在喷洒过1/2大豆水培全营养液的滤纸上萌发和催芽,将发芽盒放置在光照培养箱(光照12 h/d),每日喷洒1/2大豆水培全营养液,待种子主根长出1 cm左右,将种苗移栽到装有1/2大豆水培全营养液的塑料盆中培养。待大豆两片子叶完全展开时,取生长均匀一致的幼苗移入对应磷浓度营养液(HP、LP)中。移苗时要注意保持根部的完整性,按照定植板上的标签对号移入,用海绵固定幼苗。水培期间定时通气,每隔2 d用H2SO4或KOH调节pH(5.8~6.0),每隔3 d全部处理更换高、低磷营养液。大豆幼苗生长期间的平均温度为 28/19 ℃(日/夜),相对湿度为 80%,光照时间为12 h/d。
1.2.2 酶活性测定方法 采用南京建成生物工程研究所生产的比色法酸性磷酸酶测定试剂盒、比色法过氧化物酶测定试剂盒、植物核糖核酸酶酶联免疫分析试剂盒、植物吲哚乙酸氧化酶酶联免疫分析试剂盒,按照说明书的步骤操作。
1.3 统计分析
采用Excel 2010对试验数据进行整理统计,利用DPS软件对试验数据进行单因素方差分析,采用Duncan法检验不同处理间的差异显著性,Excel 2010进行制图。
2 结果与分析
2.1 酸性磷酸酶活性分析
由图1可见,低磷胁迫条件下,NIL与BD2(CK)根系的ACP活性均显著高于高磷水平,分别增加31.66%、17.25%;NIL和BD2(CK)叶片的ACP活性都高于其高磷水平,其中NIL叶片ACP活性显著提高,增加14.73%,但BD2(CK)叶片ACP活性仅增加6.21%,与高磷水平差异不显著。NIL与BD2(CK)比较,2种供磷条件下NIL根系ACP活性均显著高于BD2(CK),分别增加6.78%、19.91%;高磷条件下NIL和BD2(CK)叶片ACP活性差异不显著,低磷条件下NIL叶片ACP活性显著高于BD2(CK),增加10.47%。高磷和低磷条件下,NIL根系ACP活性分别是叶片的2.79、3.2倍,BD2(CK)根系ACP活性分别是叶片的2.67、2.95倍。
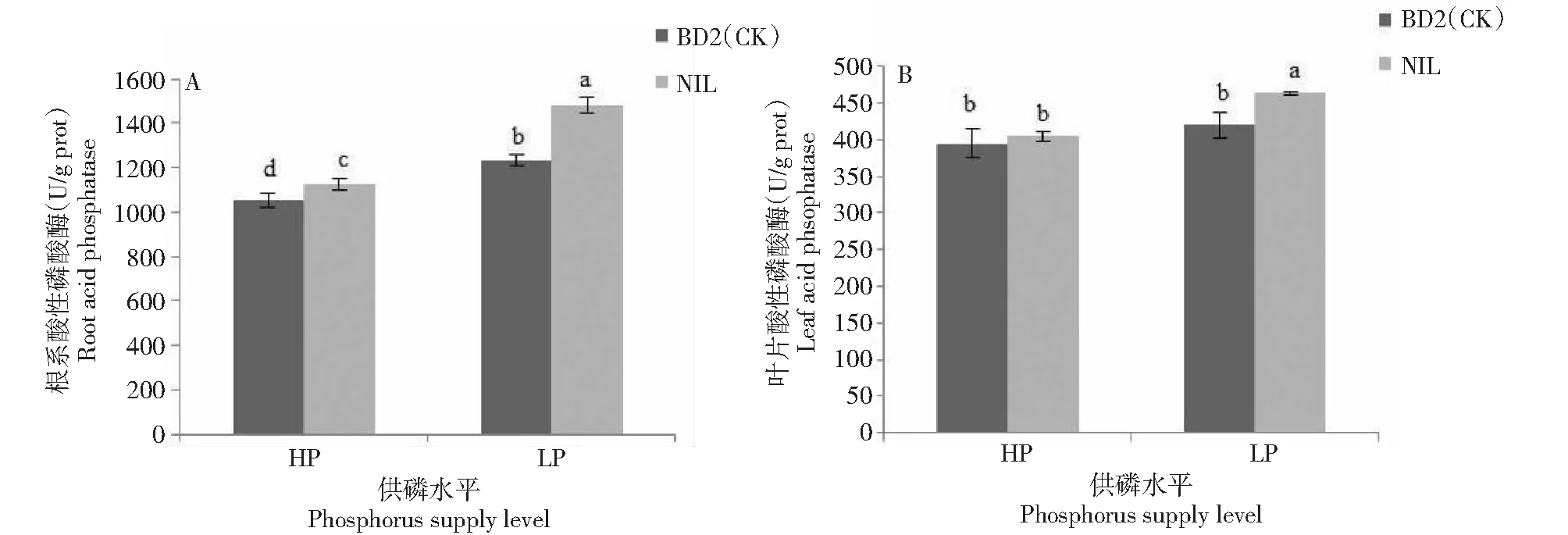
图中不同小写字母表示差异达5%显著水平,下同Different lowercase letters in the figure indicate that the difference reaches a significant level of 5%, the same as below图1 不同供磷条件下NIL和BD2(CK)酸性磷酸酶活性比较Fig.1 Comparison of acid phosphatase activity between NIL and BD2(CK) under different phosphorus supply conditions
2.2 过氧化物酶活性分析
由图2可见,低磷胁迫条件下,NIL和BD2(CK)根系POD活性均显著高于高磷水平,分别增加20.98%、30.58%;NIL和BD2(CK)比较,高磷和低磷条件下,NIL根系POD活性都显著高于BD2(CK),分别高19.24%、10.48%。低磷胁迫条件下,NIL和BD2(CK)叶片POD活性均显著高于其高磷水平,分别增加23.4%、6.55%;NIL和BD2(CK)比较,高磷和低磷条件下NIL叶片POD活性都显著高于BD2(CK),分别高9.54%、26.86%。高磷和低磷条件下,NIL和BD2(CK)根系POD活性明显高于其叶片,NIL根系POD活性分别是其叶片的6.23、6.11倍,BD2(CK)根系POD活性分别是其叶片的5.72、7.01倍。
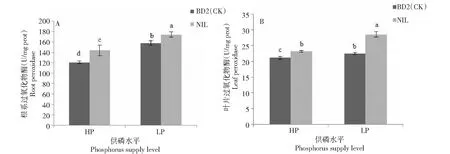
图2 不同供磷条件下NIL和BD2(CK)过氧化物酶活性比较Fig.2 Comparison of peroxidase activity between NIL and BD2(CK) under different phosphorus supply conditions
2.3 核糖核酸酶活性分析
由图3可见,低磷胁迫条件下,NIL和BD2(CK)根系RNase活性均显著高于高磷水平,分别增加21.93%、49.60%;NIL和BD2(CK)比较,高磷和低磷条件下NIL根系RNAse活性均显著高于BD2(CK),分别增加49.34%、21.71%。低磷胁迫条件下,NIL和BD2(CK)叶片的RNase活性显著高于其高磷水平,分别提高120.95%、99.73%;NIL和BD2(CK)比较,高磷条件下NIL和BD2(CK)叶片RNAse活性差异不显著,低磷条件下NIL叶片RNAse活性显著高于BD2(CK),高15.94%。NIL和BD2(CK)根系和叶片RNAse活性比较,高磷和低磷条件下NIL根系RNAse活性分别是其叶片的2.42、1.34倍,BD2(CK)根系RNAse活性分别是其叶片的1.7、1.27倍。
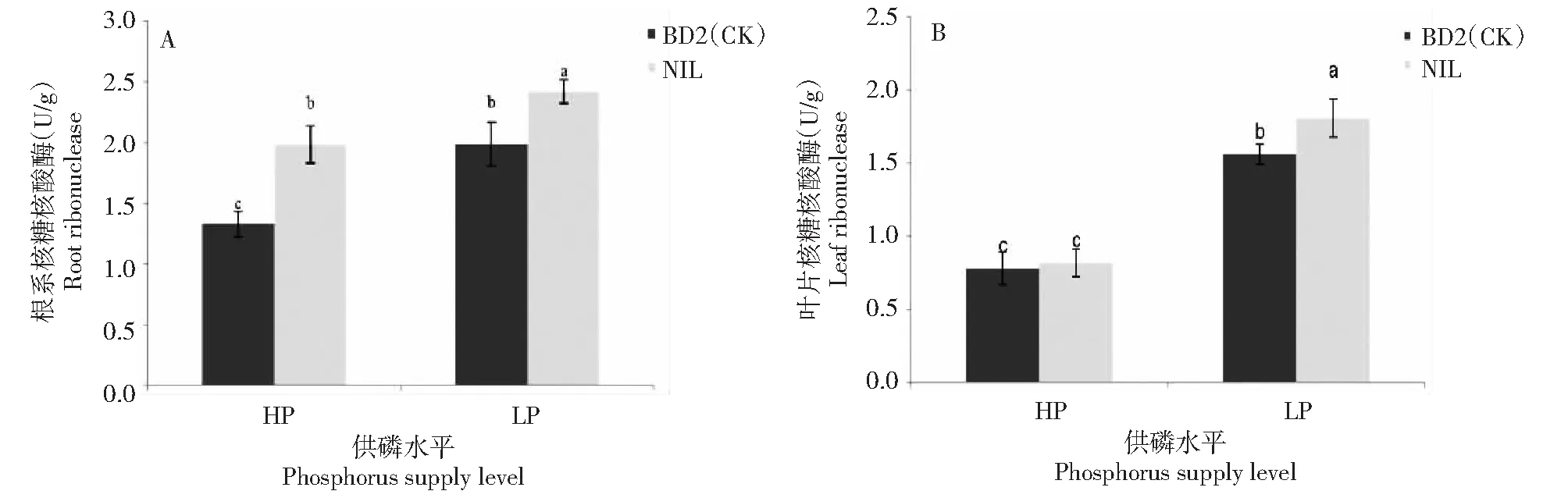
图3 不同供磷条件下NIL和BD2(CK)核糖核酸酶活性比较Fig.3 Comparison of ribonuclease activities between NIL and BD2(CK) under different phosphorus supply conditions
2.4 生长素氧化酶活性分析
由图4可见,低磷胁迫条件下,NIL和BD2(CK)根系IAAO活性都显著高于高磷水平,分别增加41.89%、52.32%;NIL和BD2(CK)比较,高磷和低磷条件下NIL根系IAAO活性都显著高于BD2(CK),分别高31.31%、22.31%。低磷胁迫条件下,NIL和BD2(CK)叶片IAAO活性均显著高于高磷水平,分别增加18.52%、21.63%;NIL和BD2(CK)比较,高磷和低磷条件下NIL叶片IAAO活性都显著高于BD2(CK),分别高11.55%、8.7%。NIL和BD2(CK)根系和叶片IAAO活性比较发现,高磷和低磷条件下NIL根系IAAO活性分别是其叶片的1.43、1.71倍,BD2(CK)根系IAAO活性分别是其叶片的1.21、1.52倍。
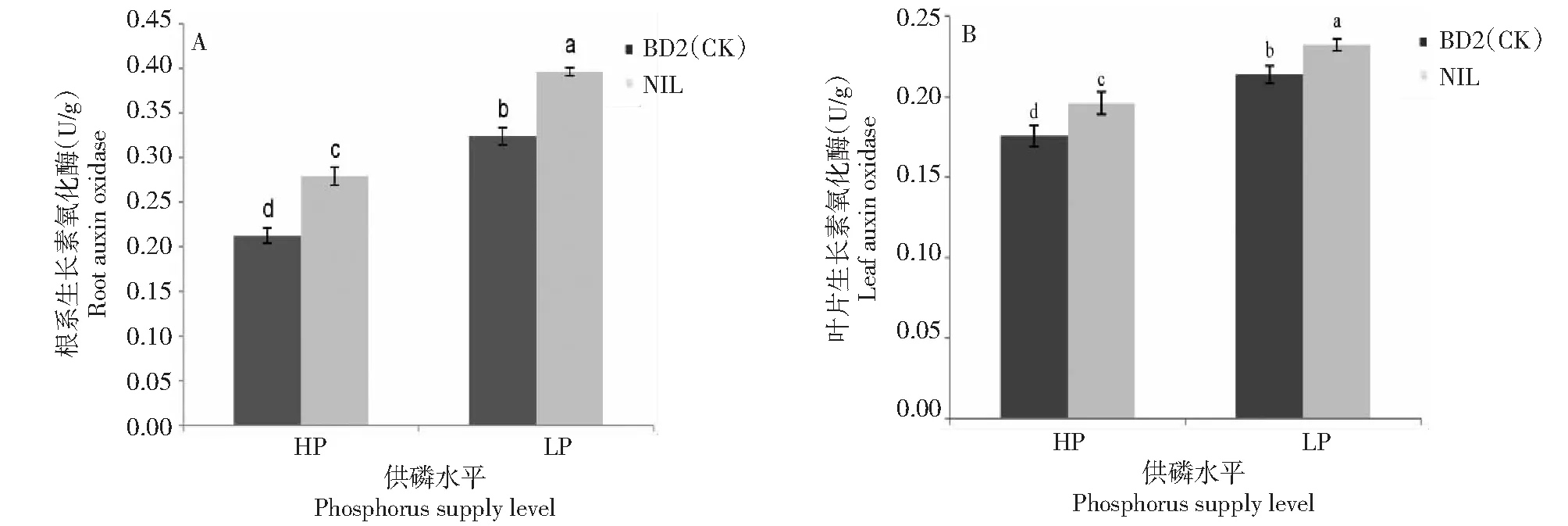
图4 不同供磷条件下NIL和BD2(CK)生长素氧化酶活性比较Fig.4 Comparison of auxin oxidase activity between NIL and BD2(CK) under different phosphorus supply conditions
3 讨 论
ACP活性受植物供磷状况的影响,低磷胁迫条件下植物体内ACP活性提高,有利于有机磷的分解和再利用,根系分泌的ACP能水解土壤中的有机磷,提高磷效率[19]。不同大豆品种间,ACP活性越高的品种对磷吸收和再利用能力越强,耐低磷能力较强[20];不同大豆基因型在不同磷胁迫时间内ACP酶活性均增加,磷高效基因型根部和叶片酶活性增幅远高于磷低效基因型,各基因型根部酶活性高于其叶片[21;磷高效大豆基因型的子叶ACP活性远高于磷低效大豆基因型[22];通过对不同磷处理下276个大豆基因型根部和叶部ACP活性研究发现,低磷条件下142个大豆基因型叶部和根部ACP活性高于高磷处理,66个基因型叶部ACP活性显著高于根部,53个基因型根部ACP活性显著高于叶部,说明低磷条件下不同基因型酶活性存在明显差异,不同基因型根部和叶部酶活性高低也存在不同[23]。本研究中,低磷胁迫条件下NIL和BD2(CK)根系和叶片ACP活性与高磷水平相比差异显著;不同磷水平下不同大豆基因型根系ACP活性均高于叶片,NIL根系和叶片的ACP活性显著高于BD2(CK);低磷胁迫条件下,不同大豆基因型ACP活性差异显著,故ACP活性可作为磷高效基因型筛选指标。
POD在植物体内活性较高,是主要防御因子之一,能够减少逆境胁迫对植物体的损伤,因此酶活性的变化程度可反应出植物耐低磷能力的强弱[24]。研究表明低磷胁迫促使谷子根系POD活性增加[25];小麦叶片POD活性上升[26];不同基因型大豆POD活性降低,磷高效大豆品种BX10降幅小于磷敏感对照品种BD2[27]。本研究中,低磷胁迫条件下NIL和BD2(CK)根系和叶片POD活性与高磷水平相比差异显著;不同磷水平下不同大豆基因型根系POD活性均高于叶片,NIL根系和叶片POD活性显著高于BD2(CK),说明POD活性越高的品种对低磷胁迫的适应性越强,故POD活性可作为磷高效基因型筛选指标。
植物体内RNAse活性增强使RNA降解加剧释放磷酸根离子,使其重新参与体内磷素循环,根系分泌到根际中的RNAse能降解土壤中有机物质释放磷酸根离子[28],故RNAse活性增强对于充分利用磷养分具有重要意义。低磷处理后不同基因型玉米RNase活性都有升高的趋势,其中磷高效品种差异达极显著水平[29],说明RNase活性是磷高效品种的重要评价指标。然而有研究认为低磷胁迫条件下苗期水稻根系RNase活性均明显提高,但RNase活性在品种间差异不显著,不可作为磷高效品种筛选指标[30],与本文研究结论存在一定差异,低磷胁迫条件下,NIL和BD2(CK)两种基因型大豆根系和叶片的RNAse活性不同程度显著提高,NIL酶活性显著高于BD2(CK);不同磷水平下不同大豆基因型根系RNAse高于叶片,因此RNAse活性增强是植物对低磷胁迫的一种适应性变化,可作为磷高效基因型大豆筛选指标。
IAAO是IAA分解代谢的关键酶,IAAO与植物不定根形成有关[31],IAAO还与植物抗逆性有关,有研究发现油菜子叶在营养胁迫1 d时,IAAO活性明显下降,但之后逐渐增强,在11 d达到高峰,高出对照酶活性1倍以上,比处理前酶活性增加30%以上[32]。本研究中低磷胁迫条件下不同基因型大豆根系和叶片IAAO活性不同程度显著提高,NIL酶活性显著高于BD2(CK);不同磷水平下不同大豆基因型根系IAAO活性高于叶片,可知IAAO活性增加是植物对低磷胁迫的适应性反应之一,故IAAO活性可作为磷高效基因型筛选指标之一。
4 结 论
低磷胁迫条件下,NIL根部ACP、POD、RNAse、IAAO活性均显著高于BD2(CK),分别提高19.91%、10.48%、21.71%、22.31%;叶部ACP、POD、RNAse、IAAO活性均显著高于BD2(CK),分别提高10.47%、26.86%、15.94%、8.7%。其中NIL和BD2(CK)根系ACP、POD、RNAse、IAAO活性均高于叶片,说明不同组织部位在磷胁迫条件下相关酶活性增加幅度存在差异,NIL和BD2(CK)适应磷胁迫环境方面存在基因型差异,NIL明显优于BD2(CK),故ACP、POD、RNAse、IAAO活性可作为磷效率评价指标用于大豆磷高效基因型的筛选。

