灯盏花中灯盏乙素生物合成相关基因转录组分析
闫亚哲,闻 豪,杜 江,杨 勇,刘正杰,3,林 春,3,文国松,3,毛自朝,3
(1.云南农业大学农学与生物技术学院,昆明 650201;2.云南生物谷药业股份有限公司,昆明 650503;3.云南农业大学小宗作物研究中心,昆明 650201)
【研究意义】灯盏花学名短葶飞蓬[Erigeronbreviscapus(Vant.) Hand.-Mazz.]为菊科飞蓬属草本植物。从灯盏花中已鉴定出黄酮及黄酮苷类、吡喃酮类、倍半萜、咖啡酰类等成分,其中黄酮及黄酮苷类和咖啡酸酯是其主要活性化合物[1-3]。灯盏乙素是从灯盏花中提取的黄酮苷类活性成分,能透过血脑屏障,可以有效改善血液循环,临床多用于预防和治疗心脑血管疾病,如中风、冠心病、心绞痛、脑缺血等[4]。由于过度开采,灯盏花野生资源日益枯竭,筛选高灯盏乙素种源,培育优良栽培品种是今后灯盏花育种的一个重要方向[5]。【前人研究进展】随着测序技术的高速发展,转录组测序已经成为挖掘药用植物新基因、解析次生代谢生物合成途径和基因表达水平的重要方法[6]。Chen等[7]利用茉莉酸甲酯(MeJA)处理的灯盏花样品转录组测序鉴定了13个类黄酮合成相关的候选基因。张薇等[8]通过对自花授粉和异花授粉的灯盏花转录组测序,分析自交不亲和相关的候选基因。田宝强等[9]利用Illumina测序技术对低氮胁迫(LN)和正常对照(CK)的灯盏花进行转录组测序,探究了灯盏花对低氮胁迫的响应机理。2017年通过组合2代与3代测序技术,组装scaffold水平的基因组草图[10],2019年通过PacBio和Hi-C测序灯盏花基因组组装到染色体水平[11],为灯盏花药用活性化合物的合成与积累提供研究基础。灯盏乙素生物合成途径已经被阐明,分为以下3个阶段。具体是①苯丙烷途径:苯丙氨酸在苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟基化酶(C4H)和4-香豆酸辅酶A连接酶(4CL)的作用下生成4-香豆酰辅酶A;②核心类黄酮途径:4-香豆酰辅酶A在查尔酮合酶(CHS)和查尔酮异构酶(CHI)的作用下生成柚皮素;③柚皮素在黄酮合酶(FSII)的催化下脱氢形成芹菜素,芹菜素在黄酮6-羟化酶(F6H)和野黄芩苷7-O-葡糖醛酸转移酶(F7GAT)催化下形成灯盏乙素[10-15]。柚皮素是其他黄酮类化合物的主要前体物质,通过不同的分支途径,分别可以生成花青素、原花青素、黄酮、黄酮醇和异黄酮等[16],如在黄烷酮3-羟化酶(F3H)作用下进入花青素、原花青素途径[17-18]。云南农业大学杨生超研究团队与中科院天津工业生物技术研究所江会锋研究团队合作,在灯盏花基因组测序的基础上,筛选到灯盏花素合成途径中的关键酶基因(EbF6H和EbF7GAT),并在酿酒酵母底盘细胞中构建了灯盏乙素全合成的细胞工厂,首次实现了灯盏乙素的全合成[19]。【本研究切入点】首先通过HPLC测定灯盏乙素含量,再对高、低灯盏乙素样品进行转录组测序。分析灯盏乙素生物合成相关基因的表达情况,对所得差异表达基因进行qRT-PCR验证。【拟解决的关键问题】通过对差异表达基因的分析为进一步研究灯盏乙素合成与积累,为灯盏花种质资源筛选及分子育种提供基础。
1 材料与方法
1.1 试验材料
试验材料为灯盏花“生物谷1号”, 采集地为云南生物谷药业股份有限公司弥勒灯盏花种植基地。弥勒市属灯盏花道地产区,亚热带季风气候,年降雨量952 mm,年均温度18.8 ℃,日照时数长达2176 h,无霜期326 d,土壤为砂质红壤,红河州特殊的地理位置,得天独厚的气候条件,非常适宜灯盏花生长。
2017年8月16日于盛花期采灯盏花叶片样品,各样品一式两份,一份用于活性化合物的测定,另一份保存于液氮中用于转录组测序。灯盏花基因组数据由云南农业大学杨生超研究团队提供。
1.2 试验方法
1.2.1 灯盏乙素含量测定 参照《中国药典,2020》等方法[20-21],以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.1%磷酸溶液(40∶60)为流动相;流速为每分钟1.0 mL;柱温40 ℃;检测波长335 nm,每份样品测3个重复,测定灯盏花中灯盏乙素的含量。并用Excel和SPSS对所测数据进行统计分析。
1.2.2 转录组测序 基于灯盏乙素含量测定结果,选择有显著差异的4组灯盏花样品(每组3个生物学重复),送武汉古奥基因科技有限公司完成RNA测序,于2020年6月完成转录组测序。提取RNA质量检测合格后,进行mRNA富集纯化、片段化,构建Illumina测序文库,进行双端(pair-end)测序,每份样品获得约12 Gb数据。
1.2.3 转录组数据分析 灯盏花转录组测序所获得原始测序片段(Raw reads),过滤总体质量较低、含有测序引物、末端质量偏低等不合格的Reads后得到Clean reads;预处理后的Clean reads比对到灯盏花基因组,定量灯盏花基因表达水平。用DESeq2软件筛选灯盏花不同样品间DEGs。
1.2.4 实时荧光定量PCR 2020年10月采用实时荧光定量PCR方法检测部分DEGs的表达情况。各试剂加量及扩增程序参照TransStart Top Green qPCR SuperMix试剂盒说明书,内参基因为Actin基因,采用2-ΔΔCt法计算基因在各个样品中的相对表达量。
2 结果与分析
2.1 灯盏乙素含量
用HPLC测定33份灯盏花样品(每份样品测3个重复)叶片中灯盏乙素含量,选择4组灯盏花样品进行转录组测序,其中S3、S5和S6为高灯盏乙素含量样品,S4(CK)为低灯盏乙素含量对照样品(CK)。S3中灯盏乙素含量最高为4.53 mg/g,S4(CK)中灯盏乙素含量最低为2.00 mg/g;如图1所示,S3、S5的灯盏乙素含量极显著(P<0.01)高于S4(CK),S6的灯盏乙素含量显著(P<0.05)高于S4(CK)。

**表示差异极显著(P<0.01),*表示差异显著(P<0.05)** indicate the extremely significant difference (P<0.01),* indicates the significant difference (P<0.05)图1 灯盏花灯盏乙素含量Fig.1 Scutellarin content in E.breviscapus
2.2 转录组数据分析
灯盏花转录组测序的原始数据经过滤、除杂等预处理后共得到152.32 Gb的Clean reads,每个样品数据量在10.77~14.84 Gb,测序质量和深度符合要求,可以用于后续分析。预处理后的Clean reads与灯盏花参考基因组比对[11],其中S5比对率最高为71.46%,S6比对率最低为67.75%(表1)。
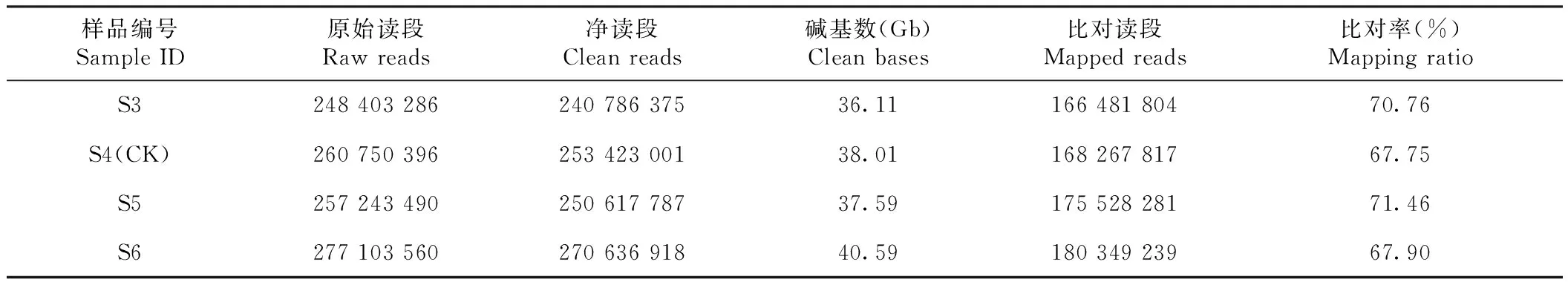
表1 灯盏花转录组数据预处理结果统计Table 1 Preprocessing results of transcriptome data of E. breviscapus
2.3 灯盏乙素合成相关基因表达分析
灯盏花基因组可编码基因中,注释到5条KEGG通路与灯盏乙素生物合成相关(表2)。KEGG通路中苯丙烷生物合成(ko00940)有200个基因,类黄酮生物合成(ko00941)有57个基因,苯丙烷代谢(ko00360)有36个基因,黄酮和黄酮醇生物合成(ko00944)有4个基因,异黄酮生物合成(ko00943)有3个基因。

表2 灯盏乙素合成相关途径及基因数目Table 2 Pathways and genes number related to scutellarin biosynthesis
如图2-A所示,与灯盏乙素生物合成相关的基因,苯丙烷途径中鉴定了6条PAL、2条C4H、5条4CL;核心类黄酮途径中鉴定了4条CHS、6条CHI;灯盏乙素分支途径中的FSII、F6H、F7GAT是单拷贝基因,3个基因串联定位在第1号染色体上115 kb的片段内。咖啡酸酯分支途径鉴定了5条HCT、4条C3H。其它分支途径鉴定了1条F3H、4条F3’H和5条FLS。这些酶基因在各个样品中的表达水平(TPM)以热图呈现(图2-B)。

A:灯盏乙素合成通路图;B:基因表达热图A: Scutellarin biosynthesis pathway; B: Heatmap of enzyme genes 图2 灯盏乙素合成通路及共表达基因热图Fig.2 Scutellarin biosynthesis pathway and genes heatmap
2.4 差异表达基因筛选
将高灯盏乙素含量样品S3、S5和S6分别与低灯盏乙素含量样品S4两两比较,分析差异表达基因DEGs。结S3vsS4共有2143个DEGs,S5vsS4有1968个DEGs,S6vsS4有1801个DEGs。3组两两比较的差异表达基因有490个共同基因(图3),其中277个在高灯盏乙素含量样品中上调表达,另外213个下调表达。它们可能在灯盏乙素的生物合成或调控中发挥重要作用,可作为后续研究的重点。

A、B、C分别表示S3vsS4、S4vsS5和S4vsS6差异表达基因火山图;D表示3组差异比较组合的韦恩图A, B and C represent differential expression genes of S3vsS4, S4vsS5 and S4vsS6, respectively; D represents the venn diagram of the three groups of difference comparison图3 灯盏花差异表达基因Fig.3 Differentially expressed genes in E. breviscapus
差异表达基因KEGG富集分析结果(图4)显示,S3vsS4、S4vsS5和S4vsS6分别有13、14、14条基因在类黄酮生物合成(ko00941:Flavonoid biosynthesis)途径。其中CHI有3条(Eb_V2_03181、Eb_V2_17259、Eb_V2_40770),F3H有1条(Eb_V2_40771),F3’H有2条(Eb_V2_04241、Eb_V2_04245),HCT有4条(Eb_V2_04655、Eb_V2_06276、Eb_V2_15753和Eb_V2_38267),CCoAMT有3条(Eb_V2_10078、Eb_V2_20841和Eb_V2_34161)。另外,灯盏乙素合成第三阶段的起始酶FSII在低灯盏乙素样品S4中表达量最低,但由于该基因基础表达水平较高,log2FoldChange小于1,没有被筛选为DEG,推测FSII在灯盏乙素积累也有重要作用。

图4 差异表达基因KEGG代谢通路富集Fig.4 DEGs enriched in KEGG pathway
2.5 差异表达基因qRT-PCR分析
为了验证转录组数据结果可靠性,选择灯盏乙素生物合成相关的5个差异表达基因CHI(Eb_V2_03181)、F3H(Eb_V2_40771)、F3’H(Eb_V2_04241)、HCT(Eb_V2_4655)、CCoAMT(Eb_V2_20841)进行qRT-PCR实验。结果表明,上述基因的差异表达趋势与转录组结果一致。类黄酮代谢下游的基因CHI、F3H和F3’H在低灯盏乙素样品S4(CK)中下调表达,参与咖啡酸酯途径的HCT和CCoAMT基因在S4(CK)中上调表达(图5)。
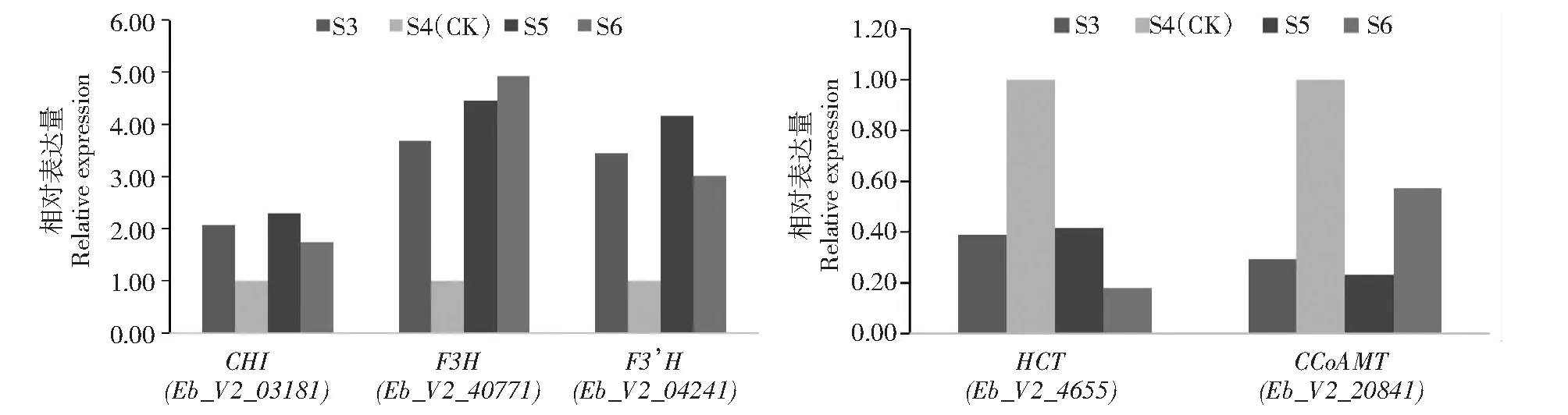
图5 5个差异基因的qRT-PCRFig.5 qRT-PCR of 5 DEGs
2.6 灯盏乙素合成相关DEGs生物信息学分析
CHI(Eb_V2_03181)蛋白质分子量(Molecular weight,Mw)为27.17 kD,理论等电点(Theoretical isoelectric point, pI)为4.66,F3H(Eb_V2_40771)蛋白质Mw为41.15,pI为5.67,F3’H(Eb_V2_04241)蛋白质Mw为39.92,pI为8.87,HCT(Eb_V2_4655)蛋白质Mw为46.88,pI为5.43,CCoAMT(Eb_V2_20841)蛋白质Mw为29.36,pI为5.32。在线预测结果显示F3’H(Eb_V2_04241)存在跨膜结构域。基因启动子区域顺式作用元件分析(图6)结果显示,启动子区域含有大量光反应元件,同时还有生长素、赤霉素、脱落酸、水杨酸和茉莉酸甲酯等激素响应元件。F3H(Eb_V2_40771)、F3’H(Eb_V2_04241)、HCT(Eb_V2_4655)基因启动子区域含有MYB结合位点。

图6 5个差异表达基因启动子区域顺式作用元件Fig.6 Cis-acting elements in promoter regions of 5 DEGs
3 讨 论
3.1 灯盏乙素生物合成关键基因
灯盏乙素是灯盏花中的黄酮苷,临床证明灯盏乙素对高血压、脑溢血、脑栓塞及其后遗症具有较好疗效[22-23]。随着灯盏花基因组的发表,灯盏乙素生物合成途径中合成酶基因及催化步骤已基本被阐明,并实现在酵母中表达来合成灯盏乙素[19]。灯盏花基因组可编码基因中,注释到5条KEGG通路与灯盏乙素生物合成相关。值得关注的是,直接参与灯盏乙素合成的FSII(Eb_V2_05115)、F6H(Eb_V2_05117)、F7GAT(Eb_V2_05114)都是单拷贝基因,且3个基因定位在第1号染色体上115 kb的片段内,形成功能相关的基因簇。推测该区间内存在响应生物或非生物信号的DNA片段,在灯盏乙素的合成和积累中发挥重要作用。类似于原核生物的操纵子,在玉米、水稻、拟南芥、番茄等植物的基因组中存在彼此功能相关的非同源基因簇,分别参与合成苯并噁唑嗪酮类、萜类和生物碱类等次生代谢产物[24]。基因簇可以通过不同调控因子和染色质重塑等调节作用,实现基因簇中各基因的共表达和共调控,从而使代谢途径的调控更具有协同性[25]。
3.2 灯盏乙素合成相关基因表达分析
本研究在HPLC测定灯盏花叶片灯盏乙素含量的基础上,结合RNAseq技术以高、低灯盏乙素含量叶片为材料筛选DEGs。差异表达基因KEGG富集分析分别有13、14、14条基因在类黄酮生物合成(ko00941:Flavonoid biosynthesis)途径,差异趋势一致的有3条CHI,1条F3H,2条F3’H,4条HCT,3条CCoAMT。其中类黄酮代谢下游的基因CHI、F3H和F3’H在高灯盏乙素含量样品中上调表达,参与咖啡酸酯途径的HCT和CCoAMT基因在低灯盏乙素含量样品S4中上调表达。
CHI是黄酮代谢途径中的一个关键酶,降低CHI活性或CHI基因突变体能导致黄酮化合物的含量显著降低[26],矮牵牛CHI基因转入番茄后,其果皮中黄酮类含量比对照增加了78倍。Chen等[27]通过构建过表达EbCHI的灯盏花毛状根体系,使灯盏乙素的积累有显著提高,其含量最高为天然根的10倍。本研究中,灯盏花CHI表达量在高灯盏乙素样品中明显高于低灯盏乙素样品,再次说明CHI在类黄酮代谢中发挥重要作用。参与花青素途径的基因F3H和F3’H,在高灯盏乙素样品中上调表达。相反,参与类黄酮上游咖啡酸酯途径的基因HCT和CCoAMT,在低灯盏乙素样品中上调表达。从苯丙烷代谢整体来看HCT和CCoAMT的高表达,使更多的原料去往咖啡酸酯途径,从而导致S4样品中的灯盏乙素含量显著降低。
4 结 论
通过对高、低灯盏乙素含量灯盏花样品进行RNAseq测序,筛选差异表达基因,并对5个与灯盏乙素生物合成相关DEGs进行qRT-PCR实验。结果与转录组测序TPM差异表达趋势一致,CHI、F3H和F3’H在高灯盏乙素样品中上调表达,HCT和CCoAMT基因在低灯盏乙素样品中上调表达。此外,发现单拷贝的FSII、F6H、F7GAT形成基因簇定位在1号染色体上。本研究有助于进一步了解灯盏乙素生物合成机制。

