炎症状态下人牙周膜成纤维细胞中SLC7A11和GPX4的表达水平及其意义
乔树伟,李保胜,李效宇,王子璇,李碧榕,董 博,孟维艳
(吉林大学口腔医院口腔种植科,吉林 长春 130021)
牙周膜是位于牙骨质与牙槽骨之间的结缔组织,起到连接牙齿与其他牙周组织的重要作用[1]。牙周膜成纤维细胞 (periodontal ligament fibroblasts,PDLFs)是牙周膜的主要组成细胞,对于调节炎症及维持牙周组织稳态至关重要[2]。牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)是牙周炎的主要致病菌,而其膜表面的脂多糖(lipopolysaccharide,LPS) 是主要的致病因子[3]。当发生牙周炎时,细菌及其产生的毒力因子会导致PDLFs进行性损伤,牙周膜受到破坏[4];而PDLFs产生的炎症介质,如肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)、白细胞介素 6(interleukin-6, IL-6) 和 白 细 胞 介 素 1β(interleukin-1β,IL-1β)会进一步造成牙槽骨吸收,最终牙齿脱落[5-6]。但牙周炎的发病机制目前尚未完全清楚。
溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)是胱氨酸/谷氨酸逆转运体的核心成分,其按1∶1的比例将胞内谷氨酸转运出细胞,同时将细胞外的胱氨酸转运到细胞内,用 于 谷 胱 甘 肽 (glutathione, GSH) 的 合 成[7]。GSH是谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)发挥作用的重要辅助因子,GPX4可以提高细胞的抗氧化能力,降低细胞内活性 氧 (reactive oxygen species, ROS) 水 平[8]。SLC7A11和GPX4在癌症、缺血性器官损伤和退行性疾病等方面起着重要作用,并在铁死亡中扮演重 要 角 色[9-10]。 近 期 有 多 项 研 究[11-13]显 示:SLC7A11和GPX4与各类炎症损伤性疾病有关,如类风湿性关节炎、急性肺损伤和急性肝衰竭。但目前尚未见关于牙周炎与SLC7A11和GPX4关系的报道,因此本研究初步探讨在P.g-LPS刺激的炎症状态下,人牙周膜成纤维细胞(human PDLFs, hPDLFs) 中SLC7A11和GPX4表达的变化,进一步了解P.g-LPS对hPDLFs的影响,并探讨其在诱导炎症方面的机制。
1 材料与方法
1.1 主要试剂和仪器 P.g-LPS(美国Invivogen公司),DMEM培养液、PBS缓冲液、青霉素链霉素双抗和胰蛋白酶(美国HyClone公司),胎牛血清(fatal bovine serum,FBS)(以色列BI公司),免疫显色试剂盒(福州迈新生物技术开发有限公司),DAB显色试剂盒(北京中杉金桥生物技术有限公司),波形蛋白(Vimentin)抗体和细胞角蛋白14(cytokeratin 14,CK14)抗体(沈阳万类生物科技有限公司),引物由生工生物工程(上海)股份有限公司合成,总RNA提取试剂盒、逆转录试剂盒和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(上海翌圣生物科技股份有限公司),β-actin抗体(美国ProteinTech公司),SLC7A11和GPX4抗体(美国Abcam公司),4′,6-二脒基-2-苯基吲哚(4′, 6-diamidino-2-phenylindole, DAPI)(北 京 索莱宝科技有限公司),RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5×)和ROS检测试剂盒(上海碧云天生物技术有限公司),ECL化学发光液(苏州新赛美生物科技有限公司)。Vanox倒置显微镜(日本Olympus公司),酶标仪(美国Bio-TEK公司),RT-qPCR仪(美国安捷伦公司),电泳仪(美国赛默飞世尔公司)。
1.2 hPDLFs的分离和培养 于吉林大学口腔医院颌面外科门诊收集8例患者(15~25岁)因正畸或其他原因拔除的健康第三磨牙,患者无牙周炎和吸烟史。用含10%双抗的PBS缓冲液冲洗牙齿50次后,去除牙龈组织,刀片刮取牙根中1/3的牙周膜,修剪成0.5 mm×0.5 mm×0.5 mm大小的块状,均匀接种于T25培养瓶中,加入4 mL完全培养基(10%FBS、1%双抗和89%DMEM)后,倒置放入细胞孵育箱。4 h后翻瓶,5 d后观察组织块并换液,之后每2 d换液,直至细胞爬满培养瓶80%面积时传代。第3~6代细胞用于后续实验。本研究经本院伦理委员会批准(伦理审批号:202144),患者知情同意。
1.3 倒置显微镜下观察hPDLFs形态表现和免疫组织化学染色鉴定 倒置显微镜下观察原代和第3代hPDLFs的形态表现。取第3代hPDLFs制成单细胞悬液,接种于细胞爬片上,24 h后PBS缓冲液清洗3次后4%多聚甲醛固定。采用免疫显色试剂盒和DAB显色试剂盒对细胞爬片进行免疫组织化学染色后,镜下观察并拍照。
1.4 细胞分组 取第3~6代hPDLFs接种于6孔细胞培养板,密度为2×105/孔。待细胞长至80%时,弃上清,PBS缓冲液清洗,对照组细胞中加入不含 P.g-LPS(即0 mg·L-1P.g-LPS) 的完全培养基,1和10 mg·L-1P.g-LPS组细胞中分别加入含 1和10 mg·L-1P.g-LPS的完全培养基。培养24 h后,进行后续实验。
1.5 RT-qPCR法检测各组细胞中TNF-α、IL-6、IL-1β、SLC7A11和GPX4 mRNA表达水平 Trizol法提取各组细胞的总RNA,测定总RNA浓度后,使用逆转录试剂盒将其逆转录为cDNA,采用RT-qPCR法检测各组细胞中SLC7A11、GPX4、TNF-α、IL-6和 IL-1β mRNA表达水平。以 β-actin为内参,反应条件:95℃预变性5 min;95℃变性10 s,60℃退火/延伸30 s,循环数为40次。采用2-△△Ct法计算目的基因mRNA表达水平。引物序列如下:TNF-α,上游引物 5′-CTGCCTGCTGCACTTTGGAG-3′, 下 游 引 物 5′-ACATGGGCTACAGGCTTGTCACT-3′; IL-6, 上 游 引 物 5′-AAGCCAGAGCTGTGCAGATGAGTA-3′, 下 游 引 物5′-TGTCCTGCAGCCACTGGTTC-3′;IL-1β,上游引物 5′-CAGCAGCATCTCGACAAGAG-3′,下游 引 物 5′-CATCATCCCACGAGTCACAG-3′;SLC7A11, 上 游 引 物 5′-GGTACTGCAATCACAATGCCAGA-3′, 下 游 引 物 5′-GCACATGCATCAAGAGTTTCCATAA-3′; GPX4, 上 游 引 物5′-AAGGACCTGCCCCACTATTTC-3′, 下 游 引物 5′-ACGCTGGATTTTCGGGTCT-3′; β-actin,上 游 引 物 5′-GGAGATTACTGCCCTGGCTCCTA-3′, 下 游 引 物 5′-GACTCATCGTACTCCTGCTTGCTG-3′。
1.6 Western blotting法检测各组细胞中SLC7A11和GPX4蛋白表达水平 弃去各组细胞的上清液,冰上用预冷的PBS缓冲液冲洗1次后加入RIPA裂解液,充分裂解后提取蛋白并用BCA蛋白浓度测定试剂盒测定蛋白浓度。蛋白变性后,尽快进行SDS-PAGE电泳,转膜,封闭,并与SLC7A11、GPX4和 β-actin一抗 (1∶1 000) 4 ℃孵育过夜。第2天,洗膜3次后,室温摇床孵育二抗1 h。洗膜3次后使用ECL化学发光液显影。采用Image J软件分析蛋白条带的灰度值,以β-actin为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针法检测各组细胞中ROS水平 细胞经P.g-LPS刺激24 h后,弃去上清液,PBS缓冲液冲洗,用10 mg·L-1的 DAPI室温染色 10 min。PBS 缓冲液洗净 DAPI染液后, 加入 10 μmol·L-1DCFH-DA 37℃避光孵育40 min。用不含血清的DMEM洗涤3次,去除未进入细胞的DCFH-DA,在荧光显微镜下观察并拍照记录。采用Image J软件对荧光强度进行分析,计算ROS水平。DCFH-DA荧光强度/DAPI荧光强度代表ROS水平,结果以相对于对照组的倍数表示。
1.8 统计学分析 采用GraghPad Prism 8.0统计软件进行统计学分析。各组细胞中炎症因子、SLC7A11和GPX4 mRNA表达水平,各组细胞中SLC7A11和GPX4蛋白表达水平,各组细胞中ROS水平,均符合正态分布,以±s表示。多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 hPDLFs形态表现和鉴定 倒置显微镜下观察,5~8 d有条索状细胞从组织块边缘爬出,12 d可见大量成纤维细胞围绕组织块呈放射状生长(图1A);第3代细胞有较强增殖能力,且呈漩涡状生长(图1B),细胞为长梭形或多边形,单核,核圆形或卵圆形(图1C),符合hPDLFs形态学特征。免疫组织化学染色结果:Vimentin蛋白染色阳性(图2A),胞质呈棕黄色;CK14蛋白染色阴性(图2B),证明其来源于中胚层,而非上皮细胞,提取的细胞为hPDLFs,可用于后续实验。

图1 倒置显微镜下hPDLFs的形态表现Fig.1 Morphological performance of hPDLFs under inverted microscope
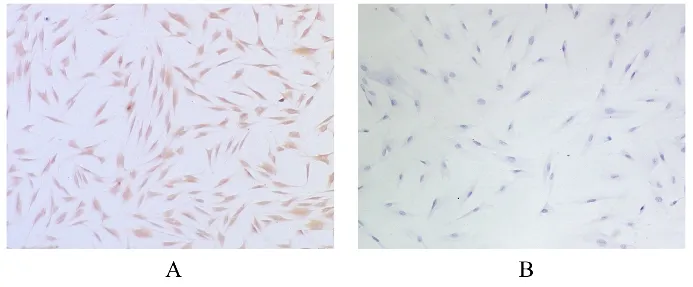
图2 Vimentin和CK14蛋白在hPDLFs中的表达情况(免疫组织化学,×100)Fig.2 Expressions of Vimentin and CK14 proteins in hPDLFs(Immunohistochemistry, ×100)
2.2 各组细胞中TNF-α、IL-6和IL-1β mRNA表达水平 与对照组比较,经P.g-LPS刺激24 h后,1和 10 mg·L-1P.g-LPS 组细胞中 TNF-α、IL-6和IL-1β mRNA表达水平均明显升高(P<0.05);与 1 mg·L-1P.g-LPS组比较,10 mg·L-1P.g-LPS组细胞中上述炎症因子mRNA表达水平明显升高(P <0.05)。见图3。
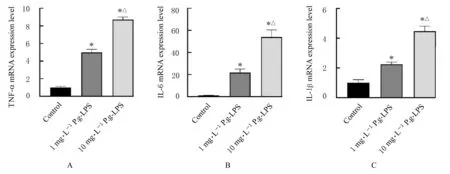
图3 各组hPDLFs中TNF-α、IL-6和IL-1β mRNA表达水平Fig.3 Expression levels of TNF-α,IL-6 and IL-1β mRNA in hPDLFs in various groups
2.3 各组细胞中SLC7A11和GPX4 mRNA表达水平 与对照组比较,1和10 mg·L-1P.g-LPS组细胞中SLC7A11和GPX4 mRNA表达水平明显降低(P<0.05);与 1 mg·L-1P.g-LPS组 比 较,10 mg·L-1P.g-LPS 组细胞中 SLC7A11和 GPX4 mRNA表达水平均明显降低(P<0.05)。见图4。
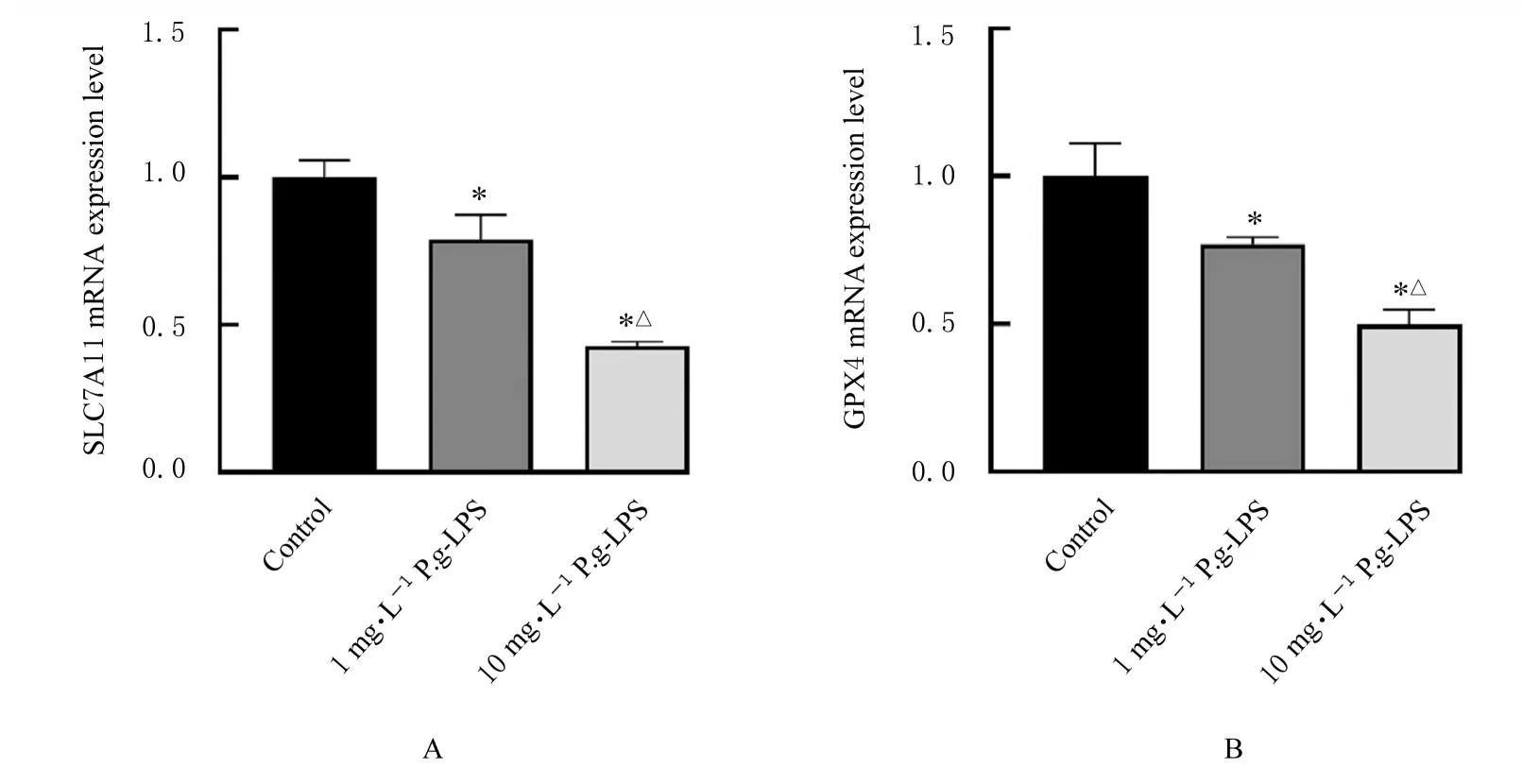
图4 各组hPDLFs中SLC7A11和GPX4 mRNA表达水平Fig.4 Expression levels of SLC7A11 and GPX4 mRNA in hPDLFs in various groups
2.4 各组细胞中SLC7A11和GPX4蛋白表达水平 与对照组比较,1和10 mg·L-1P.g-LPS组细胞中SLC7A11和GPX4蛋白表达水平明显降低(P<0.05); 与 1 mg·L-1P.g-LPS 组 比 较,10 mg·L-1P.g-LPS组细胞中SLC7A11和GPX4蛋白表达水平明显降低(P<0.05)。见图5。

图5 各组hPDLFs中SLC7A11和GPX4蛋白表达电泳图(A)和直条图(B,C)Fig.5 Electrophoregram(A)and histogram(B,C)of expressions of SLC7A11 and GPX4 proteins in hPDLFs in various groups
2.5 各组细胞中ROS水平 不同浓度P.g-LPS分别作用hPDLFs 24 h后,采用DAPI和DCFH-DA荧光探针分别将细胞核和细胞内的ROS染色,DAPI染色为蓝色,DCFH-DA染色为绿色。与对照组比较,1和10 mg·L-1P.g-LPS组细胞中ROS水平明显升高 (P<0.05);与1 mg·L-1P.g-LPS组比较,10 mg·L-1P.g-LPS组细胞中ROS水平明显升高(P<0.05)。见图6。

图6 DAPI和DCFH-DA荧光探针检测各组hPDLFs中ROS水平Fig.6 ROS levels in hPDLFs in various groups detected by DAPI and DCFH-DA fluorescence probe
3 讨 论
本研究通过免疫组织化学染色证明所分离的细胞为hPDLFs。作为体外探索牙周炎发病机制的模型细胞[14-15],hPDLFs在P.g-LPS刺激的炎症状态下SLC7A11和GPX4表达下降,为进一步阐释P.g-LPS对hPDLFs的影响并探讨其在诱导炎症方面的机制提供了实验依据。
SLC7A11和GPX4与炎症的发生发展有密切关联。研究[16]显示:小鼠小胶质细胞BV2处于炎症状态时,SLC7A11和GPX4蛋白表达水平降低。另有研究[12]显示:在大肠杆菌LPS诱导的急性肺损伤小鼠模型中,小鼠肺组织中SLC7A11和GPX4表达水平降低。人支气管上皮细胞和滑膜细胞经大肠杆菌LPS刺激后,SLC7A11和GPX4表达均下调[11-12]。GPX4作为SLC7A11的下游蛋白,不仅可以减少过氧化氢(H2O2)和一般的小氢过氧化物,甚至还可以减少生物膜和脂蛋白中的氢过氧化物[17]。目前关于SLC7A11和GPX4与炎症关系的探索主要集中在大肠杆菌LPS的研究,未见关于P.g-LPS及其在牙周炎中作用的相关报道。P.g-LPS的致病特性由脂质A决定,也正是因为P.g-LPS的脂质A结构与大肠杆菌LPS的不同,使两者的作用效果存在差异,因此P.g-LPS对牙周炎发生发展过程中SLC7A11和GPX4的影响尚未明确[18]。本文作者采用P.g-LPS刺激hPDLFs 24 h后,观察到细胞中炎症因子TNF-α、IL-6和IL-1β表达水平随着P.g-LPS浓度的升高而逐渐升高,但SLC7A11和GPX4表达水平却逐渐降低,在一定程度上证明本研究P.g-LPS诱导的炎症状态与hPDLFs中SLC7A11和GPX4的下调有密切关联。
为了进一步了解SLC7A11和GPX4与牙周炎的关系,本研究检测了hPDLFs中ROS水平,结果显示:随着P.g-LPS浓度升高,hPDLFs中ROS水平逐渐升高,可能是由于GPX4的下调使得毒性脂质过氧化氢被还原成无毒脂醇的能力下降,从而促 进 了 ROS 产 生[17,19]。 研 究[20-21]显 示: 过 量 的ROS一方面可以通过诱导PDLFs中核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体的激活,引发IL-1β成熟;另外还能通过介导磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶标(mammalian target of rapamycin,mTOR) 信号通路使TNF-α和IL-6表达水平升高,从而加重炎症。在本研究中,P.g-LPS可以导致hPDLFs中ROS水平升高,同时TNF-α、IL-6和IL-1β表达水平与ROS水平呈正相关关系,与以往的研究[20-21]结论相符合。因此,本文作者推测:P.g-LPS可能通过下调SLC7A11和GPX4表达,加剧ROS产生,导致炎症因子高表达,从而加重牙周炎。
综上所述,本研究结果证实在P.g-LPS刺激的炎症环境中,hPDLFs中SLC7A11和GPX4表达水平降低,提示SLC7A11和GPX4与牙周炎的发病机制有密切关联。本研究结果为牙周炎发病机制的研究提供了理论依据,为牙周炎治疗和预防提供了一个新的视角。

