兔脱细胞软骨基质颗粒复合SD大鼠脂肪干细胞对软骨内成骨的促进作用
边东潇,包幸福,胡 敏
(1.吉林大学口腔医院正畸科,吉林 长春 130021;2.吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
牙槽骨缺损是常见的牙周疾病之一,可造成牙齿的松动甚至脱落,产生美学和功能上的损害[1]。临床上常采用移植自体骨或骨粉以增加骨量,但自体骨骨移植创伤较大且价格昂贵,患者接受度低[2];利用骨粉可快速增加骨量,但不能有效建立血供进行骨改建且存在术后骨吸收的可能[3]。上述2种方法均存在不足之处,因此开发新的促进骨再生的修复方法具有重要意义。
骨组织工程中支架材料的重要特性是其体内高降解率和高组织替代率,以及促进成骨和血管生成能力[4],常用的支架材料包括羟基磷灰石、生物活性玻璃、水凝胶和金属钛等[5]。越来越多的研究[6-9]显 示: 脱 细 胞 软 骨 基 质 颗 粒 (acellular catilage matrix,ACM)可以作为组织工程的支架材料,ACM通过脱去软骨组织的蛋白和核酸,减少宿主的炎症反应和免疫排斥。常见的种子细胞包括骨髓基质干细胞、脐带间充质干细胞、胚胎干细胞和脂肪干细胞(adipose tissue-derived stem cells,ADSCs)等。常用的骨髓基质干细胞从骨髓中获得,取材过程痛苦,患者接受率低,以上缺点限制了骨髓基质干细胞在牙周再生治疗中的临床应用。ADSCs可通过微创的方式获得,与获取其他干细胞比较更易被患者接受且来源广泛[10]。
以往的研究多集中于将ACM与同种属的干细胞复合进行骨再生[11]。研究[12-13]显示:ACM不仅可以提供三维立体结构以供细胞以及血管生长,还可提供生物信号以决定细胞行为。研究[14]显示:将ACM与同种属来源的骨髓基质干细胞共同植入软骨缺损处获得了软骨再生。将ACM与同种属骨髓基质干细胞植入骨缺损可获得血供良好的新生骨组织[12],通过成软骨诱导对骨髓基质干细胞进行软骨内成骨获得了骨组织再生[15]。将ACM与不同种属来源的干细胞共培养通过软骨内成骨方式获得骨再生的研究目前尚未见报道。本研究创新性地将SD大鼠ADSCs与兔ACM在成软骨诱导条件下进行复合培养,以期得到更好的成软骨诱导分化,为临床上利用异种ACM支架进行骨再生提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器 雄性SD大鼠,体质量约为200 g,购自辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2020-0001;3月龄新西兰白兔,购自长春市隆盛实验动物科技有限公司,动物生产许可证号:SCXK(吉)-2018-0006。75%乙醇购于山东利尔康医疗科技股份有限公司,双抗、L-DMEM和磷酸盐缓冲溶液(phosphate buffered solution,PBS)购于美国Thermo公司,胰蛋白酶和CCK-8细胞增殖检测试剂盒购于苏州新赛美公司,胎牛血清(fetal bovine serum,FBS)购于生工生物工程(上海)股份有限公司,β-甘油磷酸钠、L-抗坏血酸、核酸酶、吲哚美辛、Ⅰ型胶原酶、3-异丁基-1-甲基黄嘌呤 (3-Isobutyl-1-methylxanthine,IBMX) 和甲苯胺蓝染液购于美国Sigma公司,碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒购于日本WAKO公司,转化生长因子β1(transforming growth factor-β1,TGF-β1) 购于中国 PeproTech公司,胰岛素-转铁蛋白-硒添加剂(insulintransferrin-selenium,ITS)购于上海爱必信生物科技有限公司,茜素红染液、油红O染色试剂盒、阿尔辛蓝色试剂盒和Trition-X 100购于北京索莱宝科技有限公司,抗CD9抗体、抗CD54抗体、抗CD90抗体和抗CD45抗体购于北京Biolegend公司,总RNA提取试剂盒购于成都Foregene公司,羟脯氨酸含量检测试剂盒购于南京建成科技有限公司,4%多聚甲醛溶液购于上海源叶生物科技有限公 司, 钙 黄 绿 素/碘 化 丙 啶 (Calcein-AM/propidium iodide,PI)细胞活性与细胞毒性检测试剂盒购于上海碧云天生物技术有限公司,SDS、HiFiScript gDNA Removal RT MasterMix和MagicSYBR Mixture购于北京CWBIO公司。超净工作台购于苏州净化设备公司,恒温二氧化碳培养箱和倒置荧光显微镜购于日本SANYO公司,多功能台式离心机购于上海安亭离心机械厂,流式细胞仪购于美国Beckman公司,电子分析天平购于上海精密仪器仪表有限公司,高压蒸汽灭菌锅购于重庆雅玛拓科技有限公司,电热恒温水浴锅购于上海博讯实业有限公司,场发射扫描电子显微镜购于北京捷欧路科贸有限公司,酶标仪购于美国BioTek公司。
1.2 原代SD大鼠ADSCs的提取 选取体质量约为200 g雄性SD大鼠,脱颈处死后75%酒精浸泡中15 min,取大鼠睾丸周围游离脂肪,用含2%双抗的PBS缓冲液冲洗3次,将筋膜和血管剥离,剪碎后加0.2%Ⅰ型胶原酶,37℃消化30 min。加入完全培养基,200目筛网过滤,1 000 r·min-1离心5 min。去上清,用含 20%FBS和 1% 双抗的L-DMEM重悬细胞,5%CO2、37℃孵箱培养,第3天换液,用含10%FBS和1%双抗的L-DMEM培养,每3 d换液。细胞生长至80%时传代,采用第3代细胞进行实验。
1.3 ADSCs的干性检测 为了检测细胞成骨能力,成骨诱导液(H-DMEM,10%FBS,1%双抗,10 mmol·L-1β-甘油磷酸钠,50 mg·L-1L-抗坏血酸)诱导ADSCs 21 d后进行茜素红染色,成骨诱导液诱导ADSCs 7 d后进行ALP染色。为了检测细胞成脂能力,ADSCs经成脂诱导液A液(H-DMEM,10%FBS,1% 双抗,0.5 mmol·L-1IBMX,10 μmol·L-1胰岛素,200 μmol·L-1吲哚美辛)诱导3 d、成脂维持液B液(H-DMEM,10%FBS,1% 双抗,0.01 U·mL-1胰岛素)诱导2 d,交替诱导共25 d后进行油红O染色。为了检测细胞成软骨能力,成软骨诱导液(H-DMEM,10%FBS,1% 双 抗,37.5 mg·L-1L-抗 坏 血 酸,1 μg·L-1TGF-β1,1∶100 ITS) 诱导 ADSCs 21 d后进行阿尔辛蓝染色和甲苯胺蓝染色。
为了鉴定ADSCs特定的细胞表面分子,ADSCs经胰蛋白酶消化,计数8×106个细胞,PBS缓冲液冲洗2次,用700 μL PBS缓冲液重悬并分成5管,随后除空白组以外各管分别与抗CD9(1∶ 100)、 抗 CD54 (1∶ 100)、 抗 CD90(1∶100)和抗CD45(1∶100)单克隆抗体在4℃下孵育1 h,采用流式细胞术检测细胞表面分子阳性表达率。
1.4 ACM的制备 取3月龄雌性新西兰白兔,耳静脉空气栓塞处死,剪下双耳,去皮毛筋膜血管等组织,剪碎冻干,研磨成粉末状,过40目钢筛,PBS 缓冲液浸泡 30 min,2 000 r·min-1离心 3 min,去上清,换1%SDS浸泡72 h,每24 h换液,Trition-X 100浸泡24 h,核酸酶浸泡12 h。PBS缓冲液清洗过滤3次,将颗粒置于含75%乙醇培养皿中紫外线照射过夜。次日PBS缓冲液清洗3次,冻干,于-20℃条件下保存备用。
1.5 采用羟脯氨酸检测试剂盒检测ACM中羟脯氨酸含量 利用试剂盒中的碱性水解液将未脱细胞的软骨基质颗粒(cartilage matrix particles, CM)和ACM水解,加入酸碱指示液,调pH值至中性,检测在波长550 nm处CM和ACM的吸光度(A)值。通过羟脯氨酸标准液和空白对照组A值定量计算水解液羟脯氨酸含量。计算公式:羟脯氨酸含量=(测定A值-空白A值)/(标准A值-空白A值)×标准含量×水解总体积/组织湿质量。
1.6 扫描电子显微镜观察ACM和ACM上ADSCs的超微形态表现 将冻干的ACM用含10%FBS的L-DMEM浸泡30 min,再将消化下来的ADSCs种植到ACM上即ADSCs与ACM共培养组,1 h后补满完全培养液,ACM组不加细胞。3 d后去培养液,10%戊二醛固定液4℃过夜,梯度酒精脱水,六甲基二硅氮烷(hexamethyldisilazane,HMDS)置换酒精并风干。喷金后于5 kV电压下扫描电子显微镜观察ACM组和ADSCs与ACM共培养组的超微形态表现。
1.7 Calcein-AM/PI荧光染色法观察ADSCs在ACM上的生长情况 将第3代ADSCs与ACM在含8%FBS和1%双抗的L-DMEM培养基共培养,3 d后去培养液并用PBS缓冲液冲洗3次,用Calcein/PI缓冲液避光孵育30 min后在荧光显微镜下观察ADSCs在ACM上的生长情况。Calcein-AM对活细胞进行绿色荧光标记(Ex=490 nm,Em=515 nm),PI对死细胞进行红色荧光标记(Ex=535 nm, Em=617 nm)。
1.8 采用CCK-8法检测2组ADSCs增殖活性 将0.1 g冻干ACM浸泡在5 mL含8%FBS和1%双抗的L-DMEM完全培养基中并置于孵箱,48 h后取上清用0.22 μm滤器过滤,于4℃保存。取第3代ADSCs分为对照组和实验组,以5 000/孔密度铺于96孔细胞培养板,在含8%FBS和1%双抗的L-DMEM培养基中孵箱贴壁过夜,24 h后对照组换液为含8%FBS和1%双抗的L-DMEM完全培养基,实验组换液为ACM浸提液。分别于1、3和7 d将 10 μL CCK-8试剂加入 100 μL 培养基中,37℃孵育4 h,采用酶标仪检测450 nm激发波长处A值,以A值表示细胞增殖活性。实验重复3次。
1.9 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测 2组 ADSCs中成软骨相关基因mRNA表达水平 将ADSCs分为对照组和实验组(ADSCs与ACM共培养),分别与成软骨诱导液体外共培养7和14 d,检测细胞中成软骨相关基因Ⅱ型胶原(type Ⅱ collagen,COL-Ⅱ)、Ⅹ型胶原(type Ⅹ collagen,COL-Ⅹ)、SRY相关HMG盒9(SRY-related high mobility group-box 9,SOX-9)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性磷酸酶(alkaline phosphatase,ALP)和Runt相关转 录 因 子 2(Runt-related transcription factor-2,RUNX-2) mRNA表达水平。所有引物均购自生工生物工程(上海)股份有限公司,引物序列见表1。采用总RNA提取试剂盒从ADSCs中提取RNA, 使 用 HiFiScript gDNA Removal RT MasterMix根据说明书进行cDNA合成,采用MagicSYBR Mixture进行PCR反应。总反应体系为20 μL,在冰上完成。反应程序:95℃、30 s,95 ℃、5 s,60 ℃、30 s,40个循环。采用 2-ΔΔCt法计算各组ADSCs中成软骨相关基因mRNA表达水平,以GAPDH为内参,实验重复3次。

表1 成软骨相关基因引物序列Tab.1 Primer sequences of chondrogenic related genes
1.10 统计学分析 采用GraphPad Prism 8统计软件进行统计学分析。CM和ACM中羟脯氨酸含量,2组 ADSCs增殖活性,2组 ADSCs中 COL-Ⅱ、COL-Ⅹ、SOX-9、VEGF、ALP和RUNX-2 mRNA表达水平均符合正态分布,以±s表示,2组间样本均数比较采用两独立样本t检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 ADSCs的表征 倒置显微镜下观察可见ADSCs呈现典型的干细胞纺锤形态(图1A),约6 d传代1次,达到一定密度后有成团生长的趋势。成骨诱导21 d茜素红S染色,钙化的钙结节呈红色(图1B)。成骨诱导7 d行ALP染色,细胞基质由于ALP的存在呈蓝紫色(图1C)。成脂诱导25 d行油红O染色,细胞内可见被染成橘红色的圆形脂滴(图1D)。成软骨诱导21 d甲苯胺蓝染色,蛋白多糖呈现紫色(图1E);阿利新蓝染色,细胞内的硫酸软骨素呈蓝色(图1F)。
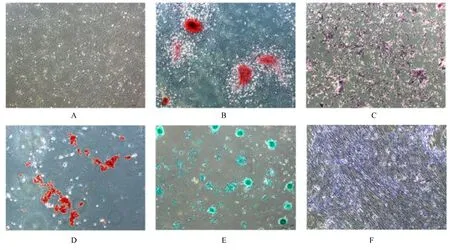
图1 ADSCs的形态表现和分化能力Fig.1 Morphology and differentiation ability of ADSCs
采用流式细胞术检测原代ADSCs表面标记物的表达,CD9(90.02%)、CD54(90.82%)和CD90(93.88%)呈阳性表达,CD45(0.93%)呈阴性表达(图2)。
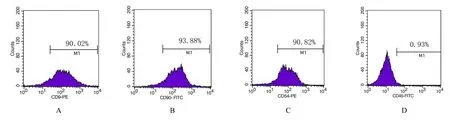
图2 流式细胞术检测ADSCs表面标记物的表达Fig.2 Expressions of surface markers in ADSCs detected by flow cytometry
2.2 ACM的表征 经过脱细胞过程后的ACM呈乳白色(图3A),冻干后呈乳白色颗粒状(图3B)。检测CM和ACM中羟脯氨酸含量,与脱细胞前的CM (2 692.0 mg·g-1±107.9 mg·g-1) 比较,经 过脱细胞处理后ACM中羟脯氨酸含量(2 368.0 mg·g-1±107.7 mg·g-1) 明显降低 (P<0.05)。扫描电子显微镜下观察:ACM组支架呈多孔结构,显示出更大的表面积,孔内没有细胞存在;ADSCs+ACM共培养组中ADSCs可以在ACM上黏附生长,伸出伪足样结构,且ACM表面存在基质样物质。见图4。
图3 湿润的ACM(A)和冻干的ACM(B)Fig.3 Wet ACM(A)and freeze-dried ACM(B)

图4 扫描电子显微镜下观察ACM和ADSCs的超微结构Fig.4 Ultrastructures of ACM and ADSCs observed under scanning electron microscope
2.3 2组ADSCs的增殖活性 在第1、3和7天时,与未加入ACM浸提液的对照组比较,加入ACM浸提液的实验组中ADSCs增殖活性明显升高(P<0.05)。见图5。
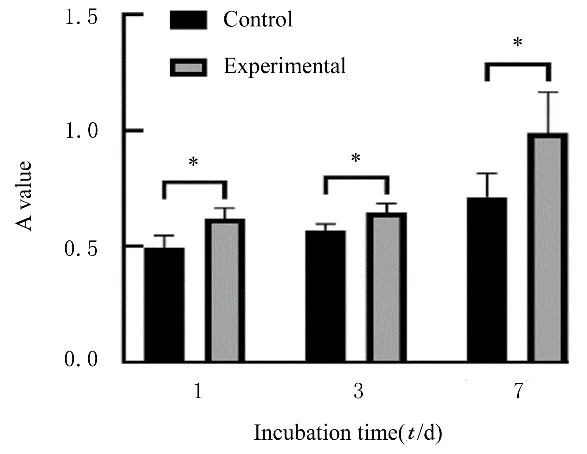
图5 不同时间2组ADSCs的增殖活性Fig.5 Proliferation activities of ADSCs in two groups at different time
2.4 ADSCs与ACM共培养时ADSCs生长情况采用Calcein-AM/PI染色法观察ADSCs与ACM共培养时ADSCs的生长情况,ADSCs在ACM支架上能更好地黏附生长,并且细胞基本存活。见图6。
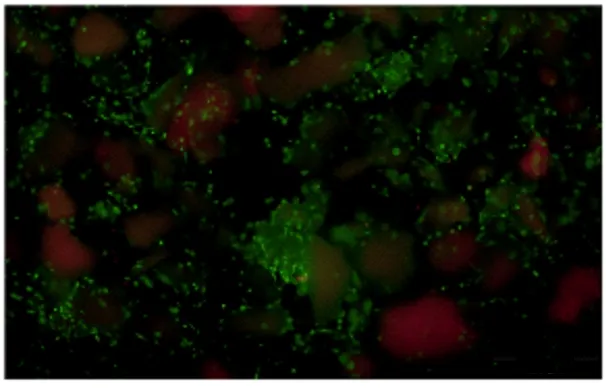
图6 ADSCs与ACM共培养3 d时ADSCs生长情况(Calcein-AM/PI荧光,×40)Fig.6 Growth status of ADSCs at 3 d of ADSCs and ACM co-culture(Calcein-AM/PI fluorescence,×40)
2.5 2组ADSCs中成软骨相关基因mRNA表达水平 成软骨诱导7 d时,与对照组比较,实验组ADSCs中VEGF、ALP和RUNX-2 mRNA表达水平 明 显 升 高 (P<0.05), COL-Ⅱ、 SOX-9和COL-ⅩmRNA表达水平差异无统计学意义(P>0.05);成软骨诱导14 d时,与对照组比较,实验组ADSCs中VEGF、ALP和RUNX-2 mRNA表达水平明显升高(P<0.05),COL-ⅩmRNA表达水平降低(P<0.05)。与成软骨诱导7 d时对照组比较,成软骨诱导14 d时对照组ADSCs中VEGF、ALP和RUNX-2 mRNA表达水平明显降低(P<0.05),COL-Ⅱ和COL-Ⅹ mRNA表达水平明显升高(P<0.05);与成软骨诱导7 d时实验组比较,成软骨诱导14 d时实验组ADSCs中COL-Ⅱ和COL-Ⅹ mRNA表达水平明显升高 (P<0.05),VEGF、ALP和RUNX-2 mRNA表达水平明显降低(P<0.05)。见表2。
表 2 成软骨诱导培养不同时间2组ADSCs中COL--Ⅱ、SOX--9、COL--Ⅹ、VEGF、ALP和RUNX--2 mRNA表达水平Tab.2 Expression levels of COL--Ⅱ,,SOX-- 99,,COL--Ⅹ,,VEGF,,ALP,,and RUNX-- 22 mRNA in ADSCs in two groups at different time of chondrogenic induction culture(n=3,±s)
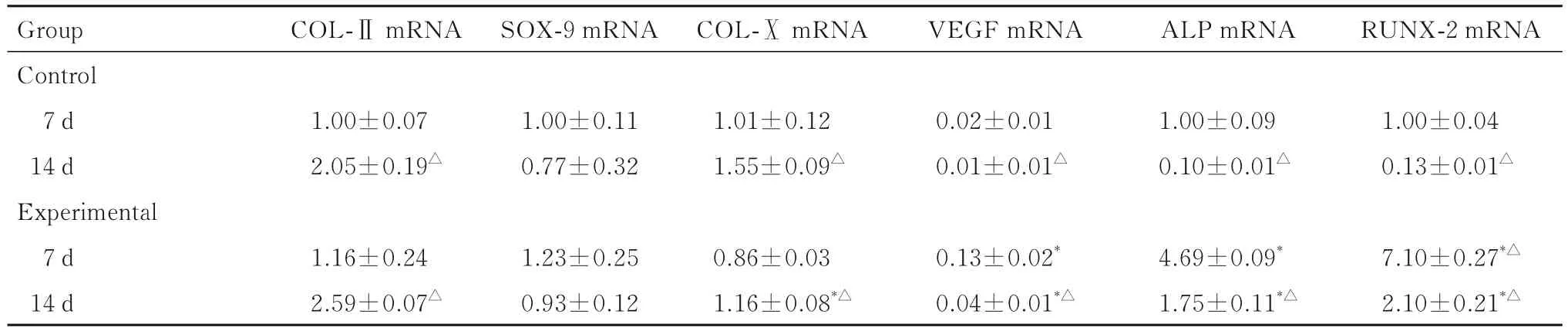
表 2 成软骨诱导培养不同时间2组ADSCs中COL--Ⅱ、SOX--9、COL--Ⅹ、VEGF、ALP和RUNX--2 mRNA表达水平Tab.2 Expression levels of COL--Ⅱ,,SOX-- 99,,COL--Ⅹ,,VEGF,,ALP,,and RUNX-- 22 mRNA in ADSCs in two groups at different time of chondrogenic induction culture(n=3,±s)
*P<0.05 compared with control group at the same time;△P<0.05 compared with 7 d in the same group.
SOX-9 mRNA COL-ⅡmRNA COL-ⅩmRNA VEGF mRNA ALP mRNA RUNX-2 mRNA Group Control 7 d 14 d Experimental 7 d 14 d 1.00±0.07 2.05±0.19△1.00±0.11 0.77±0.32 1.01±0.12 1.55±0.09△0.02±0.01 0.01±0.01△1.00±0.09 0.10±0.01△1.00±0.04 0.13±0.01△7.10±0.27*△2.10±0.21*△1.16±0.24 2.59±0.07△1.23±0.25 0.93±0.12 0.86±0.03 1.16±0.08*△0.13±0.02*0.04±0.01*△4.69±0.09*1.75±0.11*△
3 讨 论
骨组织重建涉及到多个方面,包括炎症反应、原代软骨组织的产生、干细胞募集、血管再生和矿物质沉积及改建等[16-17]。骨组织修复一般有2种方式:①骨膜下成骨,即干细胞分化为成骨细胞进而成骨,由于在缺损部位缺少血管的长入,无法进行营养交换和氧气运输;②软骨内成骨,即间充质干细胞产生肥大软骨基质作为软骨导板,软骨细胞产生VEGF促进血管发生和基质金属蛋白酶13(matrix metalloproteinase-13, MMP-13)分解软骨导板,为血管长入提供空间进行物质交换,矿物质沉积进而成骨[18-19]。软骨内成骨的方式是成人骨缺损时主要的骨修复方式。以往研究主要集中在通过骨膜下成骨的方式进行硬组织重建,本研究以ACM作为软骨导板进行软骨内成骨[20]。同种属的ACM可以促进干细胞的成软骨分化,但异种ACM对干细胞的作用缺乏相关的研究和结论。本研究成功提取了原代SD大鼠ADSCs并进行了细胞鉴定,鉴定脂肪干细胞的方法包括形态学鉴定、诱导分化能力检测和表面分子检测。ADSCs是来自中胚层的间充质干细胞,表面特异性标志物包括CD9、CD54 和 CD90,阴性表达 CD45[21]。ADSCs的成骨分化、成脂分化和成软骨分化能力证明了本实验所用的ADSCs具有干细胞特性,为接下来的实验奠定了基础[22]。本研究通过一系列脱细胞过程制备出了兔ACM[23],采用CCK-8法和Calcein-AM/PI荧光染色法证明ACM不但无细胞毒性,而且有促进细胞增殖和黏附的作用。ACM主要由胶原和糖胺聚糖组成,本研究中羟脯氨酸含量检测结果显示:ACM中羟脯氨酸含量较CM有所降低,提示脱细胞过程将软骨基质颗粒中胶原含量降低。ACM的三维多孔结构有利于细胞的附着、血管的长入和骨质的沉积[24],本研究中扫描电子显微镜下观察到ADSCs可以在ACM上正常黏附生长。COL-Ⅱ是成软骨分化的标志性基因,SOX-9是调节软骨发生的主控基因。本研究结果显示:成软骨诱导14 d时ADSCs中COL-Ⅱ mRNA表达水平高于7 d组,说明14 d时成软骨诱导分化效果比7 d时更充分;在成软骨诱导7和14 d时,与对照组比较,实验组ADSCs中COL-Ⅹ mRNA表达水平降低,COL-Ⅹ表达水平升高说明细胞已经进入肥大化早期,提示ACM可以抑制ADSCs分化为肥大化的软骨细胞;实验组ADSCs中VEGF mRNA表达水平大幅度提高,且在成软骨诱导7 d时较14 d时表达水平更高。ALP和RUNX-2是软骨细胞终末肥大化表达的因子,对后续矿化进行软骨内成骨有指导意义。本研究结果显示:与对照组比较,实验组ADSCs中ALP和RUNX-2 mRNA表达水平升高,提示ACM可以促进软骨内成骨;成软骨诱导7 d时ALP和RUNX-2 mRNA表达水平明显高于14 d,表明ACM可能在早期促软骨内成骨效果更好。
异种ACM具有天然多孔结构、来源广泛和缺乏免疫效应等优点,且不必额外加入价格高昂的细胞因子,因此是拥有广阔发展前景的骨缺损修复材料。ADSCs也是来源广泛的一种具有多向分化能力的间充质干细胞。异种ACM和ADSCs 2种易得的材料复合是潜在的骨再生方法。

