渗透脱水循环处理对糖液及桃片理化特性的影响
张嗣伟, 吕 健, 毕金峰, 钟耀广, 王凤昭, 谢 晋
(1.上海海洋大学 食品学院, 上海 201306;2.中国农业科学院 农产品加工研究所/农业农村部农产品加工重点实验室, 北京 100193)
渗透脱水是利用细胞膜半渗透性及原料与渗透液两相之间渗透压差,诱导渗透液溶质渗入原料组织,同时原料中的水分和水溶性物质(如糖、有机酸等)渗出至渗透液中,致使渗透液脱水能力及理化特性发生改变[1]。目前工业生产更为常用的渗透液使用方法是蔗糖溶液多次单阶段渗透脱水循环利用(即蔗糖溶液经使用后不做任何处理继续使用),至糖液色泽、黏度等显著劣变后丢弃[2],由此常出现产品品质标准度不高、同批次产品品质差异较大等问题。
单阶段循环利用过程中糖液渗透压力差等特性的改变会显著降低原料组织中的活细胞数量,诱导细胞内源性孔隙改变,形成渗透屏障,影响产品品质[3]。随着单阶段渗透脱水循环次数的增加,菠萝中的可滴定酸、矿物质元素损失率呈现出不稳定性[4];在15次单阶段糖液渗透脱水过程中,每阶段雪莲果的水分散失量和固形物获得量显著不同,因原料组织中Na+等阳离子和色素物质渗出至渗透液中,导致渗透液稀化,同时电导率、浊度、色泽等显著改变[5]。真空浓缩[6]、添加高浓度糖液[7]以及渗透液多阶段循环利用[8]是减轻稀化作用的有效途径,其中,糖液多阶段循环利用可以降低产品品质的差异性,提高渗透脱水效率。
目前,果蔬渗透脱水多从原料角度出发,探讨渗透液种类、浓度以及渗透方式对单阶段非循环渗透脱水产品品质的影响[9-10]。糖液循环利用过程中,糖液特性改变会显著影响产品品质,然而糖液特性的变化是如何影响原料品质的相关研究却鲜有报道。基于此,本研究以晚九号白桃为原料,以蔗糖溶液为渗透溶液,分别探究采用单阶段(糖液浓度分别为30°Brix和50°Brix)和多阶段(糖液浓度从30°Brix阶段性增加到50°Brix)2种渗透方式对白桃片进行渗透脱水处理,追踪分析2种糖液循环利用每个阶段渗透液特性及桃片理化特性的变化,明确二者之间的相关性,以期为果蔬渗透脱水、糖液循环利用相关研究和实践提供理论参考。
1 材料与方法
1.1 材料与试剂
晚九号白桃,北京平谷前芮营桃育种和试验示范基地,果实颜色、大小相近,成熟度基本一致,无明显病虫害和机械损伤。原料运回实验室后贮藏于4 ℃冷库。
蔗糖、氢氧化钠(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
CL50型蔬菜水果切片机,法国Robot Couple公司;HH- 4B型恒温水浴锅,常州荣华仪器制造有限公司;LC- DRT- 94B型数显折射仪,上海力辰邦西仪器科技有限公司;2100N型哈希测试仪,美国哈希公司;Nikon D700型数码相机,日本尼康Nikon公司;1.5.5.0型电子眼色彩分析系统,美国Lens Eye-NET公司;MCR301型流变仪,奥地利Anton Paar有限公司;907 Titrando型自动电位滴定仪,瑞士万通中国有限公司;S479- uMix型梅特勒多参数测定仪,梅特勒- 托利多国际贸易(上海)有限公司。
1.3 实验方法
1.3.1渗透脱水处理
桃经清洗、去皮、去核后切分成10 mm厚、形状一致的扇形。分别采用单阶段和多阶段渗透脱水方式对桃片进行渗透脱水处理。单阶段渗透脱水是将桃片分别浸入30°Brix和50°Brix的蔗糖溶液中,渗透处理180 min为1个循环。多阶段渗透脱水是将桃片分阶段置于浓度逐渐增加的糖液中进行渗透脱水处理。其中三阶段渗透脱水是将桃片依次置于浓度为30、40、50°Brix的蔗糖溶液中,每3个阶段构成1个循环;四阶段渗透脱水是将桃片依次置于浓度为30、40、45、50°Brix的蔗糖溶液中,每4个阶段构成1个循环。具体循环利用操作参数见表1。

表1 单阶段和多阶段糖液循环利用操作参数
糖液连续重复使用5个循环,每个循环开始时放入新鲜桃片,渗透期间糖液不做任何处理。所有渗透处理设定温度为40 ℃,料液比(g/g)为1∶5,每个循环渗透总时间均为180 min。每个循环结束后,将桃片取出,用蒸馏水清洗桃片表面糖液2~3次,并用吸水纸除去表面多余水分后用于指标测定。
1.3.2糖液理化特性测定
1.3.2.1 可溶性固形物含量测定
采用折射仪测定渗透糖液中可溶性固形物(total soluble solid, TSS)含量,结果以°Brix表示。
1.3.2.2 pH值和电导率测定
采用多功能参数测定仪测定糖液的pH值和电导率,其中电导率结果以μS/cm表示。
1.3.2.3 色泽测定
采用电子眼色彩分析系统测定糖液的色泽。记录糖液L*值(明暗度)、a*值(红绿度)和b*值(黄蓝度),其中总色差值ΔE通过式(1)计算。
(1)
式(1)中,L、a和b为初始糖液的色泽值;L*、a*和b*为渗透循环后的糖液色泽值。
1.3.2.4 黏度测定
采用流变仪测定糖液黏度。探头型号为CP50- 1- SN12929,设定温度为40 ℃,固定剪切速率为50 s-1、测定时间为2 min,共计20个测试点, 取平均值作为糖液黏度[11]。
1.3.2.5 可滴定酸含量测定
糖液中可滴定酸含量采用GB/T 12456—2021《食品安全国家标准 食品中总酸的测定》中pH电位滴定法测定,结果以苹果酸(malic acid,MA)计,单位为g/100 mL。
1.3.2.6 浊度测定
根据Oszmianski等[12]的方法稍做修改。取约30 mL的糖液于浊度仪的样品池中,摇匀测定浊度,结果以NTU表示。
1.3.3桃片理化特性测定
1.3.3.1 桃片渗透脱水传质参数测定
采用水分损失率(water loss, WL)和固形物增加率(solid gain, SG)评价桃片渗透脱水传质效果,计算见式(2)、式(3)[13]。
(2)
(3)
式(2)、式(3)中,M0是原料初始质量,g;M是原料单阶段或多阶段渗透脱水每个循环结束后样品质量,g;m0是原料初始干质量,g;m是原料单阶段或多阶段渗透脱水每个循环结束后样品干质量,g。
1.3.3.2 可溶性固形物含量测定
渗透处理后的桃片经切碎、混匀后,用组织捣碎机制成匀浆并过滤,滤液用折射仪测定TSS含量。
1.3.3.3 可滴定酸含量测定
桃片中可滴定酸含量采用pH电位滴定法测定(GB/T 12456—2021),结果以苹果酸(malic acid,MA)计,%。
1.3.3.4 色泽测定
采用电子眼法[14]测定桃片色泽,通过总色差值ΔE评价桃片色泽的变化。
1.4 数据处理
采用SPSS 25.0进行数据统计和方差分析,采用Origin 2021绘图。数据以平均值±标准差表示。
2 结果与分析
2.1 渗透脱水循环利用中糖液特性变化分析
2.1.1糖液TSS含量的变化
不同渗透脱水循环利用中糖液TSS的变化见表2。随着渗透脱水循环次数增加,单30和单50渗透脱水处理使糖液TSS含量分别由30.0、50.0°Brix降低至22.1、35.5°Brix,分别降低了26%和29%。在单阶段循环渗透脱水过程中,由于糖液与桃片细胞组织间压力差的存在,糖液中蔗糖分子不断渗入至桃片组织中,同时桃片中的水分扩散至糖液中,致使TSS含量显著降低[15]。单50渗透处理表现出更大的TSS降低量,可能是相较于低浓度糖液(30.0°Brix),高浓度糖液在渗透脱水循环利用中维持了较高的渗透压力差,进而诱导糖液和桃片组织更多传质现象的发生[16]。

表2 不同渗透脱水循环中糖液可溶性固形物的变化
在多阶段渗透脱水循环中,三阶段和四阶段渗透脱水处理中第一阶段初始糖液TSS含量在5个循环后分别降低了16%和13%,显著高于其他后续阶段,可能是由于第一阶段渗透脱水处理过程中糖液分子渗入至桃片组织中,形成了渗透屏障,导致最后阶段的糖液稀化作用减轻。同时,多阶段渗透脱水处理使糖液TSS含量在5个循环后的变化程度均显著低于单阶段渗透处理,这可能是由于多阶段渗透脱水循环处理能够显著降低糖液与桃片细胞组织之间的传质时间,更大程度地保证糖液浓度的最小化稀释。渗透脱水过程中渗透处理阶段数的增加有利于减缓糖液在循环使用中的稀释现象,更好地保持糖液TSS含量。
2.1.2糖液黏度的变化
渗透脱水循环利用中糖液黏度变化如图1。初始糖液黏度存在显著差异,主要是由于溶质含量不同引起的,糖液浓度越高,黏度越大[17]。单阶段渗透脱水循环处理中,单30渗透脱水处理的糖液黏度无显著变化,表现出稳定状态;单50渗透脱水处理的糖液黏度在循环1中下降迅速,随后呈现缓慢下降趋势。而在多阶段渗透脱水循环利用中,糖液黏度变化随浓度的增加而增大,最后阶段糖液黏度的变化最为显著。在渗透脱水过程中,高浓度糖液(50°Brix)与桃片组织间表现出更大的渗透压力差,有助于桃片中水分的快速逸出,同时能够促进更多的糖液溶质分子渗入至桃片组织中,破坏细胞膜的通透性,进而可能诱导桃片果肉组织破坏,使组织中的可溶性糖、果胶多糖类物质渗出至糖液中[15,18],进而减缓了糖液黏度的降低。
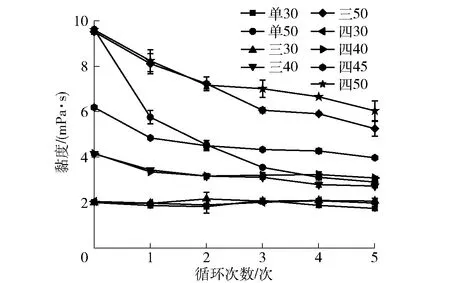
图1 不同渗透脱水循环中糖液黏度的变化
2.1.3糖液浊度的变化
渗透脱水循环利用中糖液浊度变化见图2。由图2可知,随着糖液循环利用次数的增加,不同渗透脱水处理糖液的浊度均呈现显著增大趋势。在单阶段渗透脱水循环处理中,单30渗透脱水处理在5个循环结束后,糖液浊度表现出最大值,为71.36 NTU;而单50渗透脱水处理的糖液浊度仅为7.39 NTU。单30渗透脱水处理中糖液黏度小,使桃片渗透脱水过程中传质的阻力减小,有利于桃片中更多的有机酸类、多酚类、色素类物质的溶出聚集,形成悬浮颗粒,使糖液浊度增加[19]。相比于单阶段渗透脱水处理,三阶段和四阶段渗透脱水处理中除第一阶段糖液浊度在不同循环中变化相对较大外,其余阶段糖液浊度变化均较小,可能与第一阶段中的渗透脱水前期具有较快的传质速率有关[20]。
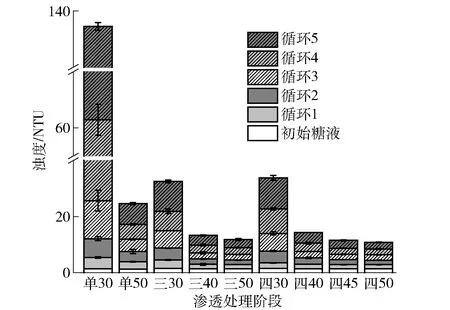
图2 不同渗透脱水循环中糖液浊度的变化
2.1.4糖液可滴定酸含量和pH值的变化
渗透脱水循环利用中糖液可滴定酸含量和pH值变化见图3。由图3(a)可知,糖液中可滴定酸含量随着其渗透脱水循环利用次数的增加而增加,表明桃片中有机酸类物质不断渗出至糖液中。单阶段渗透脱水循环处理中,单30渗透脱水处理不同循环中糖液可滴定酸含量均高于单50渗透脱水处理,5个循环结束后糖液中可滴定酸含量分别为0.197、0.126 g/100 mL,这可能是由于单50渗透脱水处理中较高的渗透压诱导了更多的蔗糖分子渗入桃片组织中,一部分糖分子渗入细胞质中与原料中的组分相互作用形成氢键或分子间作用力,另有糖分子吸附在细胞壁表面形成硬化层,一定程度上阻碍了有机酸等组分的渗出[21-22]。与单阶段渗透脱水处理相比,多阶段渗透脱水处理的糖液可滴定酸含量显著变化发生在第一阶段处理的糖液中,与Fernandez等[8]的研究结果一致。
由图3(b)可知,单阶段和多阶段渗透脱水处理中糖液pH值均在第一个循环中发生了显著变化,而在后续的循环利用中,未呈现显著性变化,Kucner等[7]的研究中也出现了类似的结果。首个循环利用中,糖液与桃片组织之间存在较大的化学式差和渗透压力差,诱导桃片中有机酸类物质转移至糖液中,使糖液pH值迅速下降至与桃果肉pH值(4.67±0.39)相近,此时体系pH值处于几乎平衡的状态,不会发生明显的变化[8,23];此外,白桃中的有机酸类物质主要为苹果酸等弱酸[24],在渗透脱水循环中的累积并不会显著影响糖液的pH值。
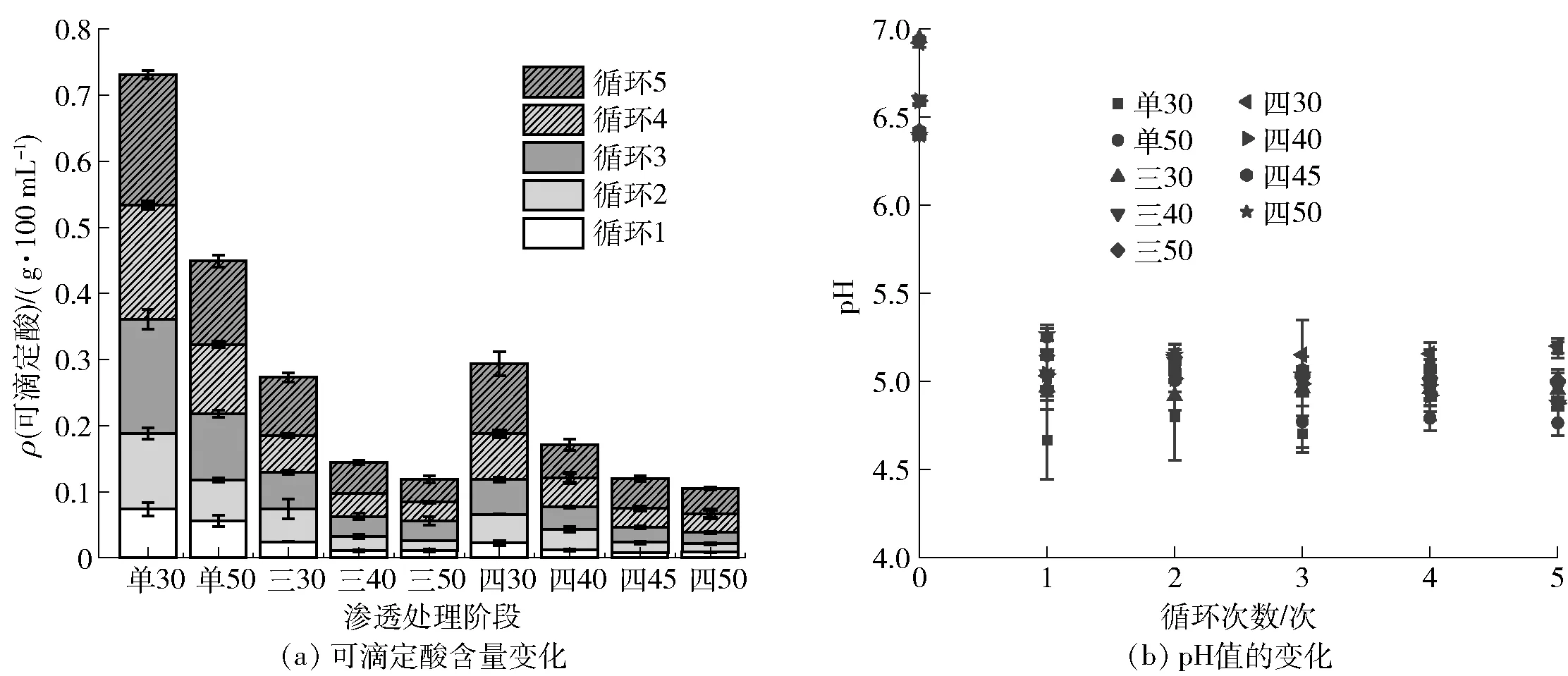
图3 不同渗透脱水循环中糖液可滴定酸含量和pH值的变化
2.1.5糖液电导率的变化
不同渗透脱水循环利用中糖液电导率变化见表3。糖液电导率随循环利用次数的增加而不断增大,单阶段和多阶段处理的糖液电导率均在第五个渗透循环后达到最大值。糖液电导率主要取决于渗透脱水过程中从原料组织中转移至糖液中的可溶性物质的种类和浓度[15]。随着糖液的循环利用,桃片中的有机酸、矿物质、Na+等渗出富集,使糖液电导率增加[25]。单阶段渗透脱水处理中,单30渗透脱水处理的糖液电导率在不同循环中均高于单50渗透脱水处理;多阶段渗透脱水处理中,第一阶段糖液电导率变化显著,其他阶段糖液电导率较第一阶段增加缓慢,这与糖液浊度和可滴定酸含量的变化规律一致。

表3 不同渗透脱水循环中糖液电导率的变化
2.1.6糖液色泽的变化
不同渗透脱水循环处理中糖液色泽参数的变化如图4。随着循环次数的增加,糖液亮度值(L*)和红绿值(a*)呈显著下降趋势,黄蓝值(b*)呈现显著增加趋势,糖液出现黄化现象,这与浊度的变化一致。总色差ΔE值[图5(d)]可以反映糖液在渗透脱水循环过程中与初始糖液之间的色泽偏差,ΔE越小,表明糖液色泽变化越小。不同渗透脱水循环处理的糖液ΔE值均逐渐增大,并在5个循环结束后达到最大。比较不同渗透脱水循环利用方式,单阶段渗透脱水处理使糖液色泽参数的变化程度显著高于多阶段处理组,其中单30渗透脱水处理改变最为显著。渗透脱水循环利用过程中,桃片组织中叶绿素、叶黄素等色素类物质的渗出以及酶促和非酶促诱导的褐变反应产物在糖液中生成与富集,均会导致糖液色泽发生显著性改变[26-27]。
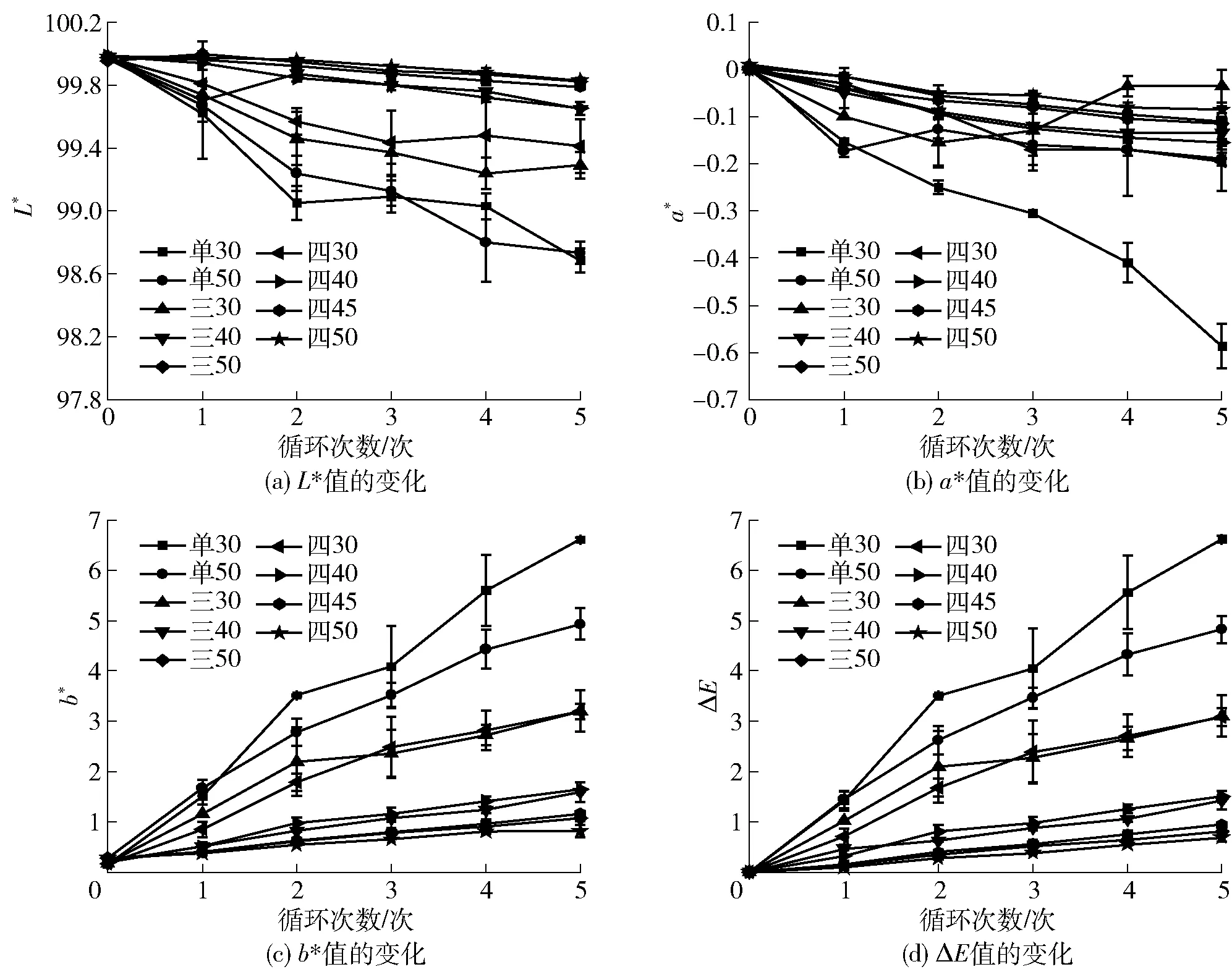
图4 不同渗透循环中糖液色泽的变化
2.2 桃片特性在渗透脱水循环利用中的变化分析
2.2.1桃片水分损失率及固形物增加率的变化
单阶段和多阶段2种渗透循环处理中桃片WL和SG变化如图5。单阶段渗透脱水处理中,随着循环数的增加,桃片WL和SG均呈降低趋势。单30渗透脱水处理WL由0.172 g/g降低为0.121 g/g;SG由0.079 g/g降低为0.057 g/g。单50渗透脱水处理桃片WL由0.285 g/g逐渐降低至0.211 g/g;SG由0.157 g/g降低为0.092 g/g。渗透脱水前期,桃片组织细胞内部和外部糖液之间呈现出较高的水化学势差异诱导桃片与糖液中水分和溶质的相互扩散,且糖液浓度越高,扩散速率越快,即桃片WL和SG越大;随着糖液的循环利用,桃片中水分渗出对蔗糖溶液产生稀释作用,致使渗透体系的水化学势差减小,渗透驱动力下降,使桃片传质效果逐渐减弱[2]。

图5 不同渗透脱水循环中桃片水分损失率和固形物增加率的变化
多阶段渗透处理中,三阶段渗透脱水处理5个循环均表现出较高的WL,且5个循环处理之间无显著差异;SG在前4个循环中未表现出显著差异,仅在第5循环处理中显著降低。四阶段渗透脱水处理桃片WL呈现先升高后降低的趋势,不同循环的SG无显著差异。多阶段渗透脱水处理SG均高于单30渗透脱水处理;多阶段渗透脱水处理桃片WL和SG在糖液第3次循环利用后显著高于单50渗透脱水处理,研究结果表明,多浓度糖液多阶段渗透脱水循环利用有助于提高传质效率,减缓糖液稀化现象。
2.2.2桃片TSS和可滴定酸含量的变化
桃片TSS和可滴定酸含量变化见图6。渗透脱水处理中,基于渗透液与原料组织渗透压力差的存在,蔗糖分子穿过细胞壁被细胞膜选择性透过,使桃片TSS含量显著升高[图6(a)];同时渗透压力差会诱导桃片组织中的小分子物质(如有机酸类、小分子糖等)透过细胞膜进入糖液中,进而使桃片可滴定酸含量显著下降[图6(b)][28]。随着渗透脱水循环次数增加,桃片TSS增加减缓,可能是由于蔗糖溶液在循环利用中的稀化现象导致的渗透压力差减小使蔗糖分子的扩散动力减弱[29]。多阶段渗透脱水处理的多浓度组合有效减缓了糖液稀化,维持了较大的渗透压力差,进而在循环利用后期仍然使桃片保持较高的SG。多阶段渗透处理的桃片TSS含量在不同循环中均高于单阶段处理组,这与多阶段渗透处理的高SG值结果一致。
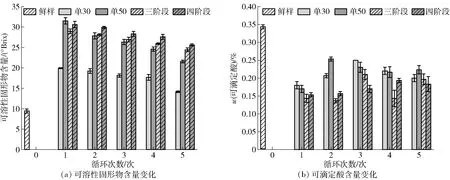
图6 不同渗透脱水循环中桃片可溶性固形物和可滴定酸含量的变化
桃片中可滴定酸含量随着糖液循环利用次数的增加,呈现先升高后降低的趋势,这与糖液中可滴定酸含量的变化趋势正好相反;相比于单阶段渗透脱水处理,多阶段渗透脱水处理使更多的蔗糖分子渗入桃片细胞组织,对细胞膜的通透性造成了一定的破坏,有利于有机酸等小分子物质扩散至糖液中[30],这与糖液电导率的变化行为一致。
2.2.3桃片色泽的变化
以总色差(ΔE值)表征桃片在渗透脱水循环利用过程中色泽变化情况(表4)。单30渗透脱水处理中,桃片ΔE值在前3个循环未呈现显著性差异,第4、5个循环后桃片ΔE值显著降低;单50和四阶段渗透脱水处理的桃片色泽则未呈现显著性改变。三阶段渗透脱水处理桃片ΔE值随循环数的增加逐渐减小,其中循环1、3、5中桃片ΔE值无显著差异。结果表明,在渗透脱水循环利用过程中,桃片色泽未呈现规律性变化。但是,单50渗透脱水处理的桃片表现出更小的色泽变化,可能是由于糖液浓度增加,溶氧量降低,有利于桃片色泽的保持。与单阶段渗透脱水处理相比,桃片经多阶段渗透处理,色差值变大,可能是因为桃片在不同阶段糖液之间转移使其短暂暴露在空气中,增加了桃片与空气的接触,诱发褐变反应,色差值增加。

表4 不同渗透脱水循环中桃片总色差值的变化
蔗糖渗透脱水过程中,原料中的部分单糖(如果糖、葡萄糖等)渗透至渗透液中[31],在一定程度上能减少美拉德反应的发生;高浓度蔗糖溶液的利用,促使部分蔗糖分子附着于桃片表面,形成保护层,一方面可以有效减少桃片与空气接触,减缓氧化褐变反应,另一方面能够有效抑制色素类物质从原料逸出,这可能是单50处理组桃片在不同渗透脱水循环中色泽保持较好的主要原因。同时也需要注意的是,糖液渗入原料组织,会导致原料细胞膜通透性改变、细胞结构发生一定程度的坍塌,进而导致色素类物质降解、流失,这与美拉德反应等都是导致脱水桃片色泽改变的重要原因[6,27]。
2.3 糖液特性与桃片品质特性的相关性分析
糖液特性与桃片品质特性的相关性分析如图7。渗透脱水循环利用过程中,桃片WL、SG和TSS均与糖液的浊度、电导率、可滴定酸含量呈显著负相关,与糖液的TSS和pH值呈显著正相关。此外,桃片WL与糖液L*值和a*值呈现出显著正相关;桃片TSS与糖液黏度、L*值和a*值呈现显著正相关,与糖液b*值呈现显著负相关;桃片可滴定酸含量与糖液浊度、电导率、可滴定酸含量和b*值呈现显著正相关,与糖液pH值、L*值和a*值呈显著负相关。原料的物化、机械特性与渗透液物化特性之间的相关性会显著影响渗透脱水过程中质传效率;渗透溶质的物化特性能够决定其在原料组织中的转移方式,如极性分子蔗糖更易于通过生物吸附作用浸渗于原料细胞壁表面;此外随着蔗糖分子的进一步浸渗,可能与原料中的组分通过表面电化学作用、静电作用力发生交互作用,进而使原料品质和糖液特性均发生变化。
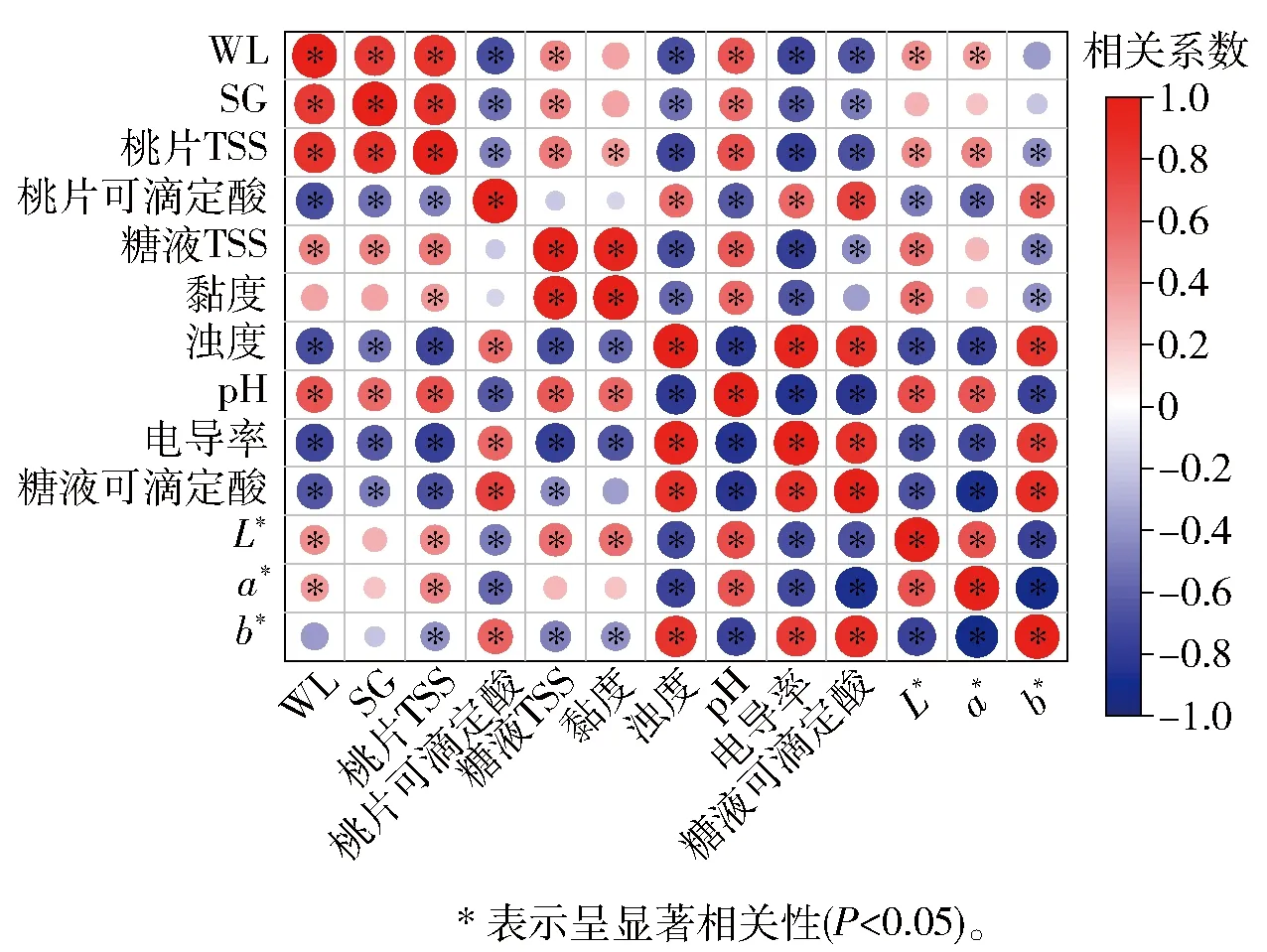
图7 糖液特性与桃片品质间相关性分析
3 结 论
本研究探究了单阶段和多阶段渗透脱水循环利用中糖液理化特性及桃片理化品质的变化。结果表明:渗透脱水过程中,桃片与糖液之间的传质作用修饰了糖液的理化特性,单阶段处理组和多阶段处理组表现出显著不同的糖液特性以及传质结果。单阶段处理组糖液稀化现象严重,且高浓度糖液表现出更为显著的稀化现象;多阶段处理能够有效减缓糖液稀化,有利于桃片水分散失和固形物增加,但并不利于脱水桃片可滴定酸和色泽的保持。随着糖液循环利用次数的增加,桃片中的水分以及可溶性物质(如有机酸类、多酚类、果胶多糖类、色素类等)发生降解或渗出至糖液中,表现为糖液黏度降低,电导率、可滴定酸含量、浊度和总色差不断增加。多阶段渗透脱水循环利用技术基于多浓度糖液组合,能够在一定程度上减缓渗透用糖液的理化特性改变,具有一定的可操作性,但其操作和相关设备的智能化、连续化仍需进一步的探讨与研究。糖液循环利用是提升渗透脱水操作经济有效性,实现渗透脱水过程节能环保的有效措施,具有良好的应用前景。

