果胶酶酶解预处理对马铃薯泥干燥特性及生粉加工特性的影响
李志洪, 申光辉, 宋春怡, 刘颖清, 鲁家璇, 李小萌,陈安均, 张志清
(四川农业大学 食品学院, 四川 雅安 625014)
马铃薯营养丰富,是世界第四大粮食作物[1]。中国是马铃薯栽培和消费大国,其产量位居世界首位[2]。为了保障国家粮食安全,改善居民膳食营养结构,中国政府2015年开始实施马铃薯主食化战略,马铃薯主食化产品开发和应用取得了较大的进展。马铃薯全粉作为一种脱水马铃薯加工制品,包括雪花全粉和颗粒全粉,相对鲜薯具有品质稳定,方便储运等优势,是全球马铃薯产品深加工的重要原料[3-4]。中国马铃薯全粉的加工生产起步较晚,技术相对落后,且以熟全粉为主。马铃薯熟全粉不仅加工能耗高,市场价格远高于小麦面粉等传统谷物粉,且其中主要为高糊化度淀粉,在面包、馒头、面条主食加工中的适用性较差[5],限制了高品质马铃薯主食产品的开发和市场销售。为了降低马铃薯全粉生产成本,改善全粉加工特性,研究者主要关注于不同干燥技术方法和设备开发,如微波干燥、低温冷冻干燥、低压过热蒸汽干燥、闪蒸干燥、射频干燥等[6-7],但这些技术相关设备较传统热风干燥复杂,投资成本高,生产中的应用普及率并不高。目前对缩短马铃薯等原料干燥时间的前处理技术研究相对较少。
马铃薯生全粉是将护色后的新鲜马铃薯在淀粉糊化温度以下经脱水干燥而成。相较于马铃薯熟全粉,生全粉省去了蒸煮熟化工艺环节,加工能耗较低,同时生全粉中淀粉结构完整性好,糊化度低,营养物质破坏程度低,更适宜用作面条、馒头等传统中式主食的加工原料。研究表明,使用马铃薯生全粉制作的面条蒸煮品质(蒸煮时间和断条率等)优于马铃薯熟全粉,高达50%的添加量对面条的蒸煮性质、质构及感官评价影响均较小[8]。果胶是植物细胞中主要的非淀粉多糖成分,对果蔬等农产品干燥过程中水分的扩散迁移具有限制效应。马铃薯细胞壁果胶占细胞壁多糖物质的50%[9]。果胶酶是食品饮料工业等领域广泛使用的加工酶助剂,可通过水解果胶提高果蔬出汁率[10]。近年来,国内外不少研究发现,通过果胶酶酶解预处理可降低植物组织中果胶含量,减弱水分子与果胶的亲和力,提高组织内部水分在干燥过程中的迁移速率,有效提高果蔬制品及其加工副产物的干燥速率和干燥效率[11-13]。因此,水解马铃薯薄壁细胞果胶质分子,可能有助于提高生粉干燥过程中水分的扩散速率,缩短干燥时间,降低干燥能耗。目前国内外尚未见采用果胶酶酶解预处理改善马铃薯生粉加工干燥特性的报道,果胶酶酶解预处理对制备的生全粉主要物质组成及其加工特性的影响尚不清楚。
本研究利用果胶酶对生马铃薯泥进行酶解预处理,结合离心脱水工艺,考察不同酶解预处理时间对生马铃薯泥热风干燥特性的影响,同时分析酶解预处理对制备的马铃薯生粉(pectinase-treated native potato flour, PNPF)基本理化特性和加工特性的影响,希望为开发新的马铃薯生粉干燥前预处理技术提供理论依据。
1 材料与方法
1.1 材料与试剂
马铃薯,希森6号品种,采购自雅安市雨城区农贸市场。食品级液体果胶酶(5万U/mL),河北沧州夏盛酶生物技术有限公司。柠檬酸、抗坏血酸、亚硫酸钠、咔唑等,分析纯,成都科隆试剂有限公司。
1.2 仪器与设备
Satorius CP225D型电子天平,英国赛多利斯公司;SS300型三足式上部卸料离心机,张家港市永泰离心机制造有限公司;DK- 8D型电热恒温水浴锅,上海齐欣科学仪器有限公司;FW400A型超微粉碎机,北京中兴伟业仪器有限公司;UV- 3100型紫外可见分光光度计,上海美普达仪器有限公司;Zeiss EVO- 18型电子扫描显微镜,德国卡尔蔡司公司;DHR- 1型流变仪,美国TA仪器公司。
1.3 实验方法
1.3.1果胶酶酶解预处理及生粉的制备
将马铃薯去皮,切成2 mm厚薄片,浸入护色液(质量分数0.08%的亚硫酸、质量分数0.5%的柠檬酸和质量分数0.05%的抗坏血酸)护色10 min。将护色马铃薯片稍沥干,放入料理机破碎20 s,收集薯泥,用0.5 mol/L柠檬酸调节pH值至3.5,按100 g/袋分装至塑封袋,添加5 mL酶活单位为2万U/mL果胶酶溶液,密封后置于45 ℃水浴锅内酶解60、120、180 min。酶解结束后立即冷却,将样品转入200目尼龙纤维滤袋,用三足式上部卸料离心机离心脱水2 min,滤袋内的马铃薯泥均匀铺于搪瓷盘内,50 ℃热风干燥至干基水分质量分数为10%,粉碎过100目检验筛,分别制得60 min酶解预处理生粉(PNPF60)、120 min酶解预处理生粉(PNPF120)和180 min酶解预处理生粉(PNPF180)。将相同条件下制备的薯泥直接离心脱水2 min,50 ℃热风干燥至水分质量分数10%(干基),并粉碎过100目检验筛,制备获得马铃薯生粉(native potato flour, NPF)。将干燥至干基水分质量分数10%的不同马铃薯生粉保存于干燥器内备用。
1.3.2生粉中果胶的定性与定量分析
采用刚果红染色法[14],结合光学显微镜对生粉中的果胶多糖进行观察拍照。取0.1 g马铃薯生粉样品溶解在2 mL蒸馏水中,加入2 mL 10 mg/mL的刚果红染料,混匀,静置5 min,4 000 r/min离心5 min。用蒸馏水反复洗涤沉淀至上清液无色透明,向沉淀物加入2 mL蒸馏水混匀,滴于载玻片,加盖玻片于40×物镜观察细胞壁(刚果红染色)的残留情况。将干燥生粉粉末粘于导电双面胶表面,真空喷金处理后,使用扫描电镜观察生粉淀粉颗粒结构及细胞壁残片。
采用碱提取法制备果胶提取液,咔唑硫酸比色法[15]测定生粉中果胶质量分数。
1.3.3薯泥干燥特性分析
参照文献[16]方法测定薯泥干燥过程中水分变化并绘制曲线:将薯泥装入滤布,三足式上部卸料离心机离心2 min,离心分离后的薯泥铺开于50 ℃热风干燥,每20 min称重一次,干燥结束后,测定各样品含水量,并按式(1)和式(2)计算干燥过程中不同干燥时间的干基水分质量分数和水分比。以干基水分质量分数对干燥时间做干燥过程曲线,并采用Page干燥模型[式(3)]进行拟合处理。根据拟合数据,代入Ct=10%及k、n值,按式(4)计算样品干基水分质量分数至10%时所用干燥时间。
(1)
式(1)中:Ct为t时刻样品的干基水分质量分数,%;mt为t时刻样品的质量,g;m为样品干燥后的质量,g。
(2)
式(2)中:MR为水分比;Ct为t时刻样品的干基水分质量分数,%;C0为初始时刻样品的干基水分质量分数,%;Ce为干燥平衡时样品的干基水分质量分数,%。
MR=exp(-k·tn)。
(3)
式(3)中:k为干燥速率常数,1/h;n为待定常数;t为干燥时间,h。
(4)
式(4)中:T为干基水分质量分数降低至10%时所用干燥时间,h。
1.3.4生粉基本理化特性测定
参考GB 5009.3—2016[17]测定水分含量,参考GB 5009.5—2016[18]中凯氏定氮法测定蛋白质含量,参考GB 5009.4—2016[19]中淀粉类食品灰分测量方法测定灰分,参考双波长比色法[20]测定直链淀粉和支链淀粉含量,并计算总淀粉质量分数。参照文献[21]方法测定生粉碘蓝值。采用X-射线衍射(X-ray diffraction patterns,XRD)分析样品相对结晶度变化,测试条件和相对结晶度计算参考Chen等[22]的方法。
1.3.5生粉加工特性分析
1)溶解度和溶胀度测定。参考Kim等[14]的方法,分别测定50、60、70、80、90 ℃下生粉样品溶解度和溶胀度。
2)持水性和持油性测定。参考文献[23]测定生粉样品持水性和持油性。
3)冻融稳定性测定。参考张艳荣等[23]的方法,以析水率(%)表示冻融稳定性。
4)糊化特性的测定。采用DHR- 1流变仪测定样品糊化性质。准确配制质量分数8%的生粉水溶液,测定前使用磁力搅拌器使样液充分混合均匀。采用40 mm平板夹具,平板间隙1 000 μm,添加样品后边缘涂抹甲基硅油防止测试过程水分蒸发。测试角速度1.0 rad/s,采点间隔10.0 s。采用Leivas等[24]设定的升温程序。
1.4 数据处理
所有实验处理均重复3次,结果以平均值±标准偏差表示;数据采用SPSS 26.0软件进行方差分析(ANOVA),Duncan法进行多重比较(P<0.05)。
2 结果与分析
2.1 果胶酶酶解预处理对薯泥干燥特性的影响
图1是果胶酶酶解预处理不同时间的马铃薯泥50 ℃热风干燥曲线。由图1可知,整个干燥过程水分比MR呈下降趋势,未酶解处理薯泥样品(NPF)水分比下降较缓慢,而果胶酶酶解预处理薯泥(PNPF)相对较快。
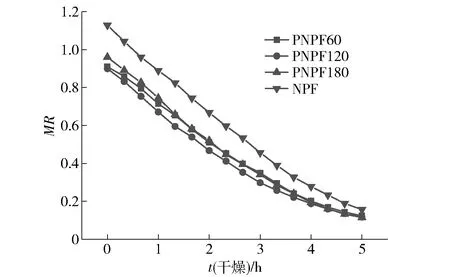
图1 果胶酶酶解预处理生马铃薯泥热风干燥曲线
果胶酶酶解预处理对薯泥干燥Page模型方程参数和干燥时间的影响,分析结果见表1。由表1可知,不同样品干燥曲线模型的决定系数R2>0.98,表明Page模型适合描述马铃薯泥热风干燥过程。干燥速率常数k是Page干燥模型中用于描述干燥快慢的参数,k值越大,干燥速率越快。与未酶解处理相比,3个酶解预处理马铃薯泥样品的Page模型参数k值均显著提高,表明果胶酶酶解预处理可显著提高生马铃薯泥干燥速率。薯泥干燥速率的提高可能与马铃薯薄壁细胞壁及细胞间隙的果胶被水解,使细胞间隙增大,水分向外迁移速率提高有关。由表1可知,与未酶解处理相比,酶解预处理薯泥样品初始水分质量分数显著降低。较低的水分质量分数是由于果胶酶分解了薄壁细胞间的果胶,使细胞间隙增大,在薯泥离心时水分更易分离。因此当薯泥干基水分质量分数为10%时,PNPF干燥所用时间较NPF减少了6.32%~7.81%。

表1 果胶酶酶解预处理对生马铃薯泥干燥Page模型参数及干燥时间的影响
2.2 果胶酶酶解预处理对马铃薯生粉基本理化特性的影响
2.2.1果胶酶酶解预处理对生粉微观形貌和果胶含量的影响
植物细胞壁果胶等大分子具有较强的吸水和持水能力,为观察果胶酶酶解预处理后马铃薯薄壁细胞的细胞壁中果胶分子分布的变化,采用刚果红进行染色观察,结果见图2。图2中PC为残留的马铃薯薄壁细胞的细胞壁,ST为淀粉颗粒。
图2中红色为刚果红染色后的果胶等细胞壁成分,其中NPF细胞壁果胶物质量最多[图2(a)],而PNPF[图2(b)、图2(c)、图2(d)]细胞壁果胶等非淀粉多糖物质明显减少;且随着酶解时间增加,细胞壁果胶质越来越少。
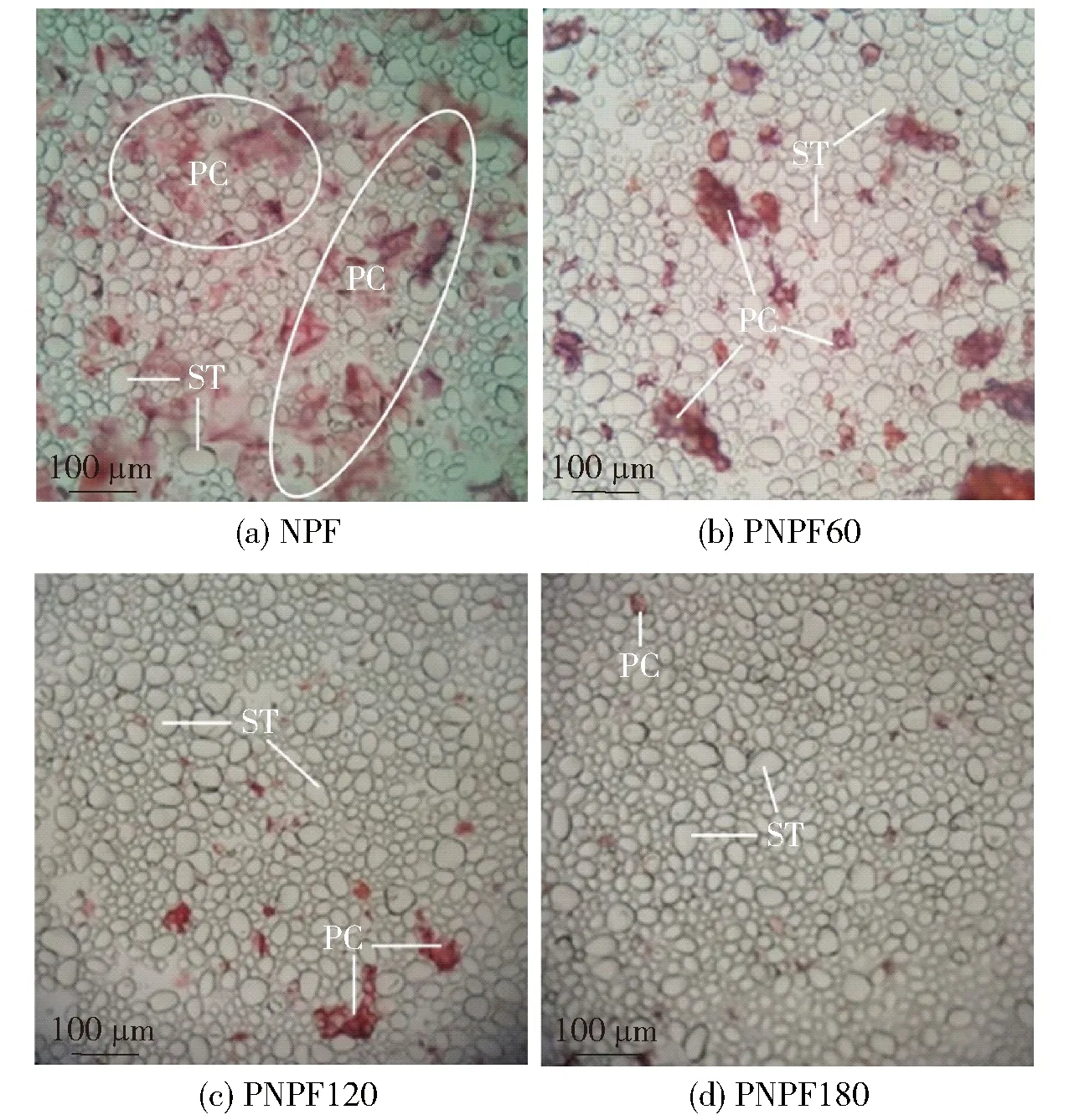
红色物质PC为残留的马铃薯薄壁细胞的细胞壁,ST为淀粉颗粒。
不同酶解时间预处理制备的马铃薯生粉扫描电镜下微观结构见图3。图3中PC为残留的马铃薯薄壁细胞的细胞壁,ST为淀粉颗粒。由图3可见,不同预处理条件下制备的生马铃薯粉中的淀粉颗粒呈规则的椭球形,结构完整,表面光滑,与天然马铃薯淀粉颗粒相似[25]。生粉制备过程存在机械破碎处理,因此生粉中淀粉绝大部分以游离淀粉颗粒形式存在,同时可见薄壁细胞的细胞壁残留物,部分黏结在淀粉颗粒表面[图3(a)],经果胶酶酶解预处理制备的生粉中细胞壁残留物明显减少,且酶解时间越长,细胞壁残留越少[图3(b)、图3(c)、图3(d)]。对不同酶解时间预处理制备的生粉中的果胶定量分析结果见图4。由图4可知,马铃薯生粉的果胶质量分数随果胶酶酶解预处理时间增加而显著降低。

PC为残留的马铃薯薄壁细胞的细胞壁,ST为淀粉颗粒。
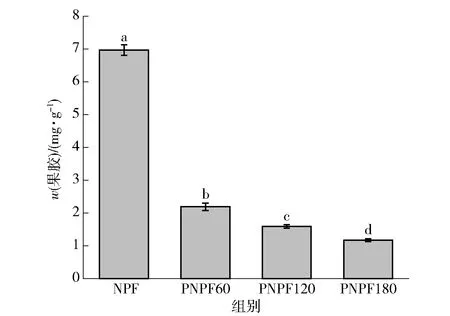
不同小写字母表示组间差异显著(P<0.05)。
2.2.2果胶酶酶解预处理对生粉水分、蛋白质和灰分质量分数的影响
不同酶解时间预处理制备的马铃薯生粉水分、蛋白和灰分等成分的影响结果见表2。由表2可知,未酶解处理马铃薯生粉NPF与3个不同酶解时间预处理制备的马铃薯生粉PNPF水分质量分数无显著性差异(P>0.05);经过果胶酶酶解处理,生粉中蛋白质质量分数为0.95%~1.56%,减少了24.64%~54.11%。生粉中蛋白质的减少可能是薯泥离心过程中可溶性蛋白质流失至离心汁液导致的。PNPF在酶解后完整的薄壁细胞结构受到不同程度的破坏,导致蛋白质更容易从细胞内流出,且随着酶解时间的增长,薄壁细胞破损程度越大,蛋白质损失越多。灰分是无机盐类及其氧化物,由表2可知,酶解预处理降低了马铃薯生粉的灰分质量分数,表明酶解预处理使薯泥中无机盐类成分更多地进入了离心汁液中。酶解预处理结合离心虽然能降低物料初始含水量,缩短干燥时间,但损失了部分游离淀粉、蛋白质、氨基酸及矿物质离子等成分,导致加工得率降低。因此,如何采取有效措施(如膜分离等)降低马铃薯生粉制作过程中离心环节导致的干物质损失,尽量减小对制备得率带来的不利影响,是该工艺应用于生产实际需要进一步解决的问题。此外,研究离心环节产生的富含各类营养物质成分汁液的再次转化利用技术,将其作为生粉加工的配套技术,也将促进该工艺的推广应用。
2.2.3果胶酶酶解预处理对生粉淀粉及其组成的影响
不同酶解时间预处理制备的马铃薯生粉淀粉及其组成分析结果见表2。由表2可知,果胶酶酶解处理制备的马铃薯生粉(PNPF)直链淀粉、支链淀粉和总淀粉质量分数均高于未酶解处理生粉(NPF)。随着酶解预处理时间增加,PNPF直链淀粉质量分数呈上升趋势,可能是因为在酶解的酸性环境(pH值=3.5)中,在柠檬酸的作用下,支链淀粉的A链脱离结晶区,成为游离的直连淀粉,同时B链也可能发生脱离C链或者断裂,形成了更多的直连淀粉[26];酶解和离心预脱水处理使水溶性蛋白和果胶等物质损失,导致制备的生粉总淀粉质量分数测定结果略有升高。

表2 果胶酶酶解预处理制备的马铃薯生粉理化特性
2.2.4果胶酶酶解预处理对生粉晶体结构的影响
图5是不同酶解时间预处理制备的马铃薯生粉XRD图谱。由图5可知,与未酶解处理马铃薯生粉(PNPF)相比较,酶解预处理制备的马铃薯生粉(NPF)的吸收峰宽和峰型发生明显改变,与传统马铃薯全粉相比差异明显。由于马铃薯熟全粉(cooked potato flour, CPF)在加工过程中经高温蒸汽熟化处理,淀粉糊化程度高,结晶结构被严重破坏,其XRD图谱呈馒头状[27]。生粉样品均呈现典型的B型淀粉特征,在5.6°、17.0°、23.0°和24.0°有较强的衍射峰出现。随着酶解时间增加,5.6°的衍射峰减弱,这可能是由于酶解过程中长时间的较高温度和酸性环境使淀粉发生酸改性,导致淀粉结晶区被破坏[28-29]。
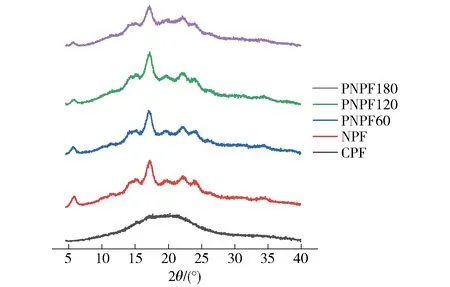
图5 果胶酶酶解预处理对马铃薯生粉晶体结构的影响
不同酶解时间预处理制备的马铃薯生粉相对结晶度分析结果见表2。由表2可见,未酶解处理马铃薯生粉的相对结晶度最高,为26.29%,经果胶酶酶解预处理后生粉的结晶度随着酶解时间的增加呈现先降低后升高的趋势。酶解过程中淀粉分子结晶区缓慢解体,相对结晶度在120 min降低至20.89%,随后淀粉分子重结晶,结晶度上升至24.45%。
2.2.5果胶酶酶解预处理对生粉碘蓝值的影响
碘蓝值是衡量马铃薯生粉中游离淀粉多少的指标,反映了马铃薯细胞的破损程度[30]。不同酶解时间预处理制备的马铃薯生粉碘蓝值分析结果见表2。由表2可知,所有样品碘蓝值处于5.07~12.17,均符合马铃薯生粉国标限量(小于50),其中PNPF样品的碘蓝值为5.07~5.60,显著低于NPF的12.17,这是因为酶解破坏薄壁细胞细胞壁,游离淀粉更多地进入离心汁液中。
2.3 果胶酶酶解预处理对马铃薯生粉加工特性的影响
2.3.1果胶酶酶解预处理对生粉溶解度和溶胀度的影响
不同酶解时间预处理制备的马铃薯生粉溶解度和溶胀度分析结果见图6。由图6(a)可知,生粉溶解度随温度的上升而逐渐提高,这与Lu等[31]的研究结果一致。升温至70 ℃时,溶解度达到峰值,且此温度下PNPF180样品溶解度为30.00%,显著高于NPF(溶解度22.00%)。不同PNPF溶解度均高于NPF,这与酶解预处理破坏薄壁细胞细胞壁,使淀粉等成分更易溶于热水有关。此外,在pH值3.0、45 ℃水浴酶解预处理时,淀粉颗粒与水接触,在此期间淀粉可能发生柠檬酸酸改性。淀粉分子与柠檬酸发生酯化,淀粉的交叉链接增加,从而提高淀粉分子在水中的溶解度[28-29]。随着酶解时间延长,淀粉酸改性程度增强,溶解度逐渐提高。
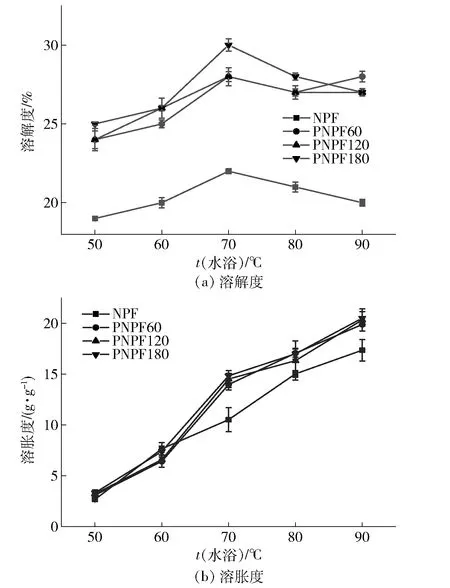
图6 果胶酶酶解预处理对马铃薯生粉溶解度和溶胀度的影响
由图6 (b)可见,马铃薯生粉溶胀度随着温度升高而增大,这与Gunaratne等[32]研究结果一致。PNPF样品的溶胀度在70~90℃范围内高于NPF,这可能与PNPF样品中的支链淀粉含量较高有关。Tester等[33]研究发现,导致淀粉膨胀的主要原因之一是淀粉颗粒中的支链淀粉含量。此外,Shi等[34]发现,果胶等阴离子多糖的阴离子基团和马铃薯支链淀粉分子上的磷酸基团相互排斥能抑制马铃薯淀粉颗粒的膨胀。因此,酶解预处理导致生粉溶胀度的增大还与果胶分子被水解,解除了其对淀粉膨胀的抑制效应有关。
2.3.2果胶酶酶解预处理对生粉持水性和持油性的影响
持水力的差异主要是由淀粉分子内部羟基与分子链或水形成氢键和共价结合所致,羟基与淀粉分子结合的作用大于与水分子的结合,表示持水力低,反之则表示持水力高[23]。马铃薯生粉的持水能力对其在食品配料中的应用有一定的参考意义,应用较强持水特性的原料加工的产品能够保持良好的质地特性,延长货架期。不同酶解时间预处理制备的马铃薯生粉持水力分析结果见表3。由表3可知,PNPF的持水性为16.55~17.62 g/g,较NPF(持水性11.78 g/g)提高了40.49%~49.58%,这是因为酶解处理使薄壁细胞内容物流出,大量淀粉暴露出来,增加了比表面积,使得在淀粉分子内部羟基和水的亲和力不变的情况下,更多的游离淀粉使得PNPF持水能力大大增加。
生粉的持油性在其加工应用中发挥着非常重要的作用,生粉的吸油性高可帮助减少脂肪渗出,可增强产品风味,改善口感,延长保质期,特别是在焙烤食品和肉制品中。不同酶解时间预处理制备的马铃薯生粉持油性结果见表3。由表3可知,PNPF的持油性为1.09~1.26 g/g,均低于NPF(持油性1.33 g/g),其中PNPF60持油性相对较高,且随酶解时间增加持油性呈下降趋势,这与酶解破坏薄壁细胞细胞壁有关。这是因为酶解时间越长,薄壁细胞破坏程度越大,含非极性尾端的蛋白质等大分子随水分在离心时损失越多,持油能力降低。
2.3.3果胶酶酶解预处理对生粉冻融稳定性的影响
冻融处理后生粉析水率可反映其冻融稳定性。不同酶解时间预处理制备的马铃薯生粉冻融析水率见表3。由表3可知,PNPF冻融析水率均低于NPF,较NPF(析水率53.76%)降低了26.23%~62.11%,表明PNPF的冻融稳定性优于NPF,其中PNPF180的析水率为20.37%,冻融稳定性能最佳。淀粉质原料良好的冻融稳定性对低温加工淀粉制品品质的保持具有积极作用,本实验结果表明,通过果胶酶酶解预处理制备的马铃薯生粉冻融稳定性显著改善,更适用于速冻水饺、汤圆等速冻米面制品的加工,可显著降低此类产品的冻裂率,改善产品食用品质。

表3 马铃薯生粉持水性、持油性及冻融稳定性
2.3.4果胶酶酶解预处理对生粉糊化特性的影响
不同酶解时间预处理制备的马铃薯生粉糊化特性参数测定结果见表4。由表4可知,所有样品糊化温度均在64.6~64.9 ℃,样品间无显著性差异。PNPF的峰值黏度随着酶解时间呈现先降低再升高,最后下降的趋势,其中酶解PNPF120峰值黏度最大(5.72 Pa·s)。马铃薯生粉黏度的变化不仅与淀粉的吸水膨胀有关,还与其中非淀粉类的果胶、蛋白质等分子含量有关。PNPF60黏度的降低,可能主要与其中蛋白质和果胶分子含量的降低有关;随着酶解时间的增加,PNPF120黏度的增加可能是由于果胶分子大量水解而导致淀粉颗粒更易吸水膨胀;随着酶解处理时间的延长至180 min,部分淀粉分子与柠檬酸可能发生一定程度的酯化反应而发生酸改性,峰值黏度略有降低[28-29]。此外,酶解预处理显著降低了生粉峰值温度,缩短了峰值时间,所制备的生粉谷值黏度、最终黏度和回生值显著降低。黏度是评价馒头、面包等产品感官优劣的重要指标之一。研究表明,在马铃薯生全粉添加量超过20%后,馒头黏度上升,比容下降,综合感官评分呈现下降趋势[2]。与传统方法制备的马铃薯全粉相比,通过酶解预处理制备的马铃薯生粉(PNPF)因其最终黏度和回生值低,有较强的加工性能优势,可用于加工低黏度,不易回生的马铃薯主食产品。崩解值反映淀粉糊的热稳定性, 崩解值越大, 则淀粉糊稳定性越差。酶解预处理制备的生粉崩解值均显著高于未酶解处理样品,表明酶解预处理降低了马铃薯粉糊的热稳定性。
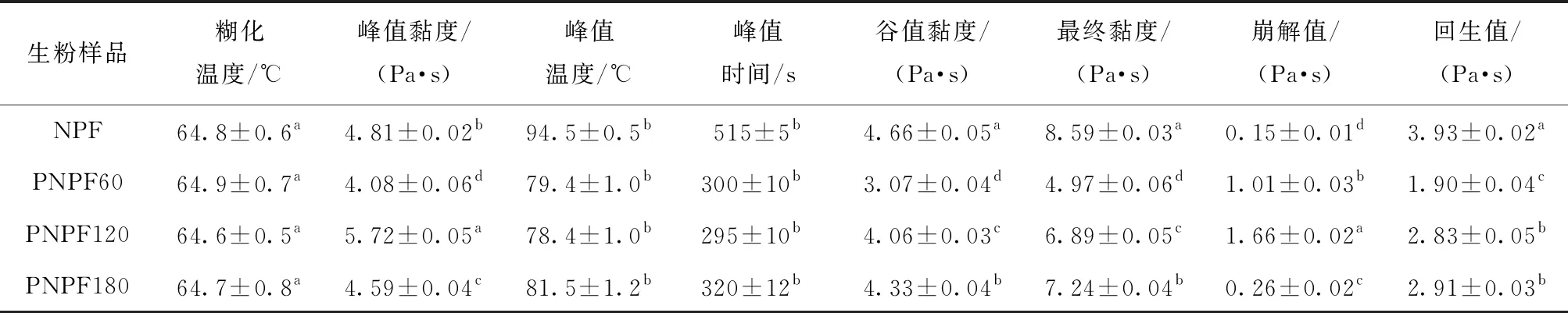
表4 马铃薯生粉糊化特性参数
3 结 论
本实验结果表明,果胶酶酶解预处理60~180 min减少了生马铃薯泥果胶含量,提高薯泥低温(55 ℃)热风干燥速率,干燥时间缩短了6.32%~7.81%,果胶酶酶解预处理有助于进一步降低马铃薯粉生产成本。果胶酶酶解预处理制备的马铃薯生粉相对结晶度、蛋白质含量、溶胀度、碘蓝值和持油性降低,持水性提高,冻融析水率降低,说明果胶酶酶解预处理制备的马铃薯生粉持水能力增强,冻融稳定性能提高,在速冻食品生产中具有潜在加工优势,有助于改善速冻淀粉类食品持水能力,降低产品流通中的开裂现象。糊化特性研究结果表明,果胶酶酶解预处理制备的马铃薯生粉峰值温度下降,峰值时间缩短,崩解值上升,最终黏度降低,回生值下降,在改善中式马铃薯主食产品口感,提高产品品质方面具有潜在的应用价值。果胶酶酶解预处理可作为一种前处理技术改善马铃薯泥的干燥特性及所制备的生全粉加工特性。

