解淀粉芽孢杆菌GSBa- 1凝乳酶对羊奶干酪成熟特性的影响
赵 华, 郑 喆, 张 曼, 王艺会, 张 敏, 杨贞耐
(北京工商大学 食品营养与人类健康北京高精尖创新中心/北京市食品添加剂工程技术研究中心, 北京 100048)
在欧美等发达国家,羊奶干酪由于其独特的风味和营养价值受到越来越多的关注,目前约70%的羊奶被用于制作干酪[1]。以羊奶为原料加工制得的干酪组织结构细腻,风味独特,在很多方面优于牛奶干酪[2]。干酪在成熟过程中会发生一系列复杂的反应,原料乳成分[3]、凝乳剂[4]、发酵剂[5]和非发酵剂细菌[6]等因素对干酪特有香气、风味和质地的形成具有重要影响。干酪成熟期间风味和质地的变化主要与蛋白质、脂肪降解及糖酵解有关[7]。微生物凝乳酶因其具有相对较高的蛋白质水解活性,对干酪的成熟和风味形成具有一定的促进作用[8]。因此,选用合适的微生物凝乳酶对于提升羊奶干酪的品质具有重要的应用价值。
解淀粉芽孢杆菌GSBa- 1为芽孢杆菌属革兰氏阳性菌,其发酵产生的蛋白酶具有较高的凝乳活性和一定程度的蛋白质水解活性[9]。本研究团队前期已成功地将解淀粉芽孢杆菌GSBa- 1凝乳酶应用于牛奶干酪加工中[10-11],但对干酪,特别是羊奶干酪成熟期间理化特性变化的研究仍有所欠缺。本研究将GSBa- 1凝乳酶用于加工羊奶干酪,旨在评估此微生物凝乳酶产生的生化作用对羊奶干酪成熟的促进作用。通过与商业凝乳酶制备的羊奶干酪进行比较,探究以GSBa- 1凝乳酶制得的干酪在60 d成熟过程中干酪成分、乳酸乳球菌活菌数、干酪质构和挥发性风味物质的变化规律,以期为进一步掌握新型微生物凝乳酶在干酪中的应用技术奠定基础。
1 材料与方法
1.1 材料与试剂
解淀粉芽孢杆菌GSBa- 1凝乳酶:北京工商大学食品与健康学院实验室提取制备,并于-80 ℃冷冻保藏。
氯化钠、氯化钙(食品级),国药集团有限公司;鲜羊奶(脂肪质量分数3.1%,蛋白质质量分数3.06%,乳糖质量分数4.33%),北京三胖牧场;乳酸乳球菌发酵剂XZ3303、QH27- 1,北京工商大学食品与健康学院乳品实验室,菌株源自内蒙古农业大学;商业凝乳酶,丹麦科汉森有限公司。
1.2 仪器与设备
PL203型电子天平、FE20型数显pH计,上海梅特利- 托利多仪器有限公司;HWS12型恒温水浴锅,上海一恒科学仪器有限公司;干酪槽,北京工商大学食品与健康学院乳品实验室自制;CT3型质构仪,美国Brookfield公司;7090A- 7000型气相色谱- 质谱(gas chromatography-mass spectrometry, GC- MS)联用分析仪,美国Aglient公司;Kjeltec8100型凯氏定氮仪,美国FOSS公司;T25型Ultra- Turrax匀浆器,德国IKA公司;Tissuelyser- 48高通量组织破碎仪,上海净信公司;XH- T漩涡混合器,江苏新宝仪器有限公司;Q exactive高分辨质谱仪[配有电喷雾(ESI)离子源和Xcalibur工作站],美国Thermo公司。
1.3 实验方法
1.3.1羊奶硬质干酪的制备
参照赵笑等[11]的方法,采用不同品种凝乳酶(A组:商业凝乳酶;B组:GSBa- 1凝乳酶)和同批次羊奶进行羊奶硬质干酪的制备,每组3个平行样品。制作过程:将发酵剂X23303、QH27- 1按3%接种量活化3代后,以体积分数1.5%接种量添加至经过巴氏杀菌(65 ℃,30 min)的鲜羊奶中, 搅拌5 min,32 ℃发酵30 min,至pH值为6.5左右,然后加入CaCl2(0.005 g/mL)和凝乳酶(1 500 SU/mL),搅拌5 min,32 ℃保温静置45 min至凝固。将凝块切成2 cm3的立方体,32 ℃静置15 min后,升温至35 ℃,直至pH值降至6.1左右,此时完全排出乳清。将凝块切碎搅拌至pH值为5.4左右,加入质量分数为2.7%NaCl,搅拌均匀,装入磨具,以30 g/cm3的压力压模过夜,压好的干酪进行真空包装。干酪在4 ℃成熟60 d,分别取干酪成熟过程中1、7、14、21、42、60 d的样品测定相关指标。
1.3.2培养基的配置
M17培养基(用于乳酸乳球菌,g/L):大豆蛋白胨5.0、蛋白胨2.5、酪蛋白胨2.5、酵母浸粉2.5、牛肉浸粉5.0、乳糖5.0、抗坏血酸钠0.5、β-甘油硫酸钠19.0、硫酸镁0.25。pH值7.2±0.2,25 ℃。
1.3.3干酪得率及主要组分含量测定
在干酪制作过程中,准确称取并记录NaCl、发酵剂、原料乳和干酪成品的质量,干酪得率计算见式(1)。

(1)
依据GB 5009.003—2016《食品中水分的测定》测定干酪中的水分含量;依据GB 5009.005—2016《食品中蛋白质的测定》中的凯氏定氮法测定干酪中的蛋白质含量;根据GB 5009.6—2016《食品中脂肪的测定》的方法测定干酪中的脂肪含量。
1.3.4干酪游离氨基酸含量测定
参照文献[12]测定。样品前处理:精确称取50 mg样品于离心管中,加入适当体积0.1 mol/L盐酸提取液,涡旋混匀并振荡,12 000 r/min离心10 min,取上清液备用。标准品和样品经柱前衍生化,取氨基酸标准液和样品上清液过0.22 μm滤膜,采用超高效液相色谱- 高分辨率质谱法进行检测。根据氨基酸标准曲线,计算出干酪中各游离氨基酸的含量。色谱条件:ACCQ- TAG TMULTRA C18(100 mm×2.1 mm,1.8 μm)液相色谱柱,流速0.5 mL/min,柱温65 ℃,进样量1 μL,流动相A为AccQ·TagtmUltra Eluent A,流动相B为AccQ·TagtmUltra Eluent B,梯度洗脱。质谱条件:正离子灵敏度模式检测,喷雾电压3 kV,辅助气温度320 ℃,辅助气流量10 L/min,鞘气温度 350 ℃,鞘气流量40 L/min。
1.3.5干酪质构分析
将干酪样品切成1 cm3的立方体在室温下放置0.5 h后进行质构分析。质构分析仪参数设定为:测试前速度2.0 mm/s,测试中速度0.5 mm/s,返回速度0.5 mm/s,循环2次,数据点频率50点/s,触发点负载0.007 N,探头型号为TA 3/100。每个样品做3次平行实验,取平均值。
1.3.6干酪微生物指标测定
在干酪成熟1、7、14、21、42、60 d时,采用腾军伟等[9]的方法测定干酪中的活菌数。准确称取5 g干酪,加入54 mL、40 ℃温浴的质量分数2%柠檬酸钠溶液,充分匀浆2 min。处理好的样品加入质量分数0.9%的生理盐水逐级稀释至适当倍数,涂布于M17固体平板,培养3 d后对乳酸乳球菌进行计数。
1.3.7干酪风味物质的测定
参照腾军伟等[10]的方法,准确称取6 g干酪样品,切碎后放置于30 mL萃取瓶中,加入标准品后加盖用封口膜密封,置于60 ℃水浴锅中平衡30 min。固相微萃取吸附30 min(60 ℃),插入气相色谱的进样口,240 ℃解析5 min,进行GC- MS分析鉴定。
GC条件:升温程序为初始温度40 ℃,保持3 min,溶剂延迟3 min,然后以5 ℃/min的速度升温至200 ℃后,以10 ℃/min的速度升温至240 ℃,保持1 min。载气He,恒定流速为1.2 mL/min,进样口温度240 ℃,采用不分流模式。
MS条件:电子轰击离子源,电子能量70 eV,传输线温度230 ℃,离子源温度为230 ℃,四极杆温度150 ℃,质量扫描范围m/z35~400。
1.4 数据处理
实验测定至少重复3次,结果以平均值±标准差表示。实验数据采用SPASS 18.0软件处理。
2 结果与分析
2.1 羊奶干酪得率及成熟过程干酪组分变化分析
2.1.1干酪得率分析
羊奶干酪得率见表1。由表1可知,以商业凝乳酶制备的干酪 A 与以解淀粉芽孢杆菌GSBa- 1凝乳酶制备的干酪 B比较,二者干酪得率相差不大,干酪B略低于干酪A,这可能是由于GSBa- 1凝乳酶水解蛋白质,造成乳清析出。

表1 羊奶干酪得率
2.1.2干酪成熟过程中主要组分含量变化分析
不同凝乳酶制得的干酪的组成成分会有所差异[13],羊奶干酪成熟过程中不同组分含量的变化见图1。

不同小写字母表示组间数据差异显著(P<0.05)。
干酪水分含量是影响干酪品质的重要因素。由图1(a)可知,成熟期间(1 d后),干酪B的水分质量分数始终高于干酪A;两组干酪在成熟期间水分质量分数呈现先升高后降低的趋势,这与祝敏[14]的结果相似。这是由于干酪B中的残糖与赖氨酸反应生成水分而成熟后期,干酪游离水的蒸发造成质量损失[15-16]。
羊奶干酪成熟期间脂肪质量分数的变化见图1(b)。干酪B在成熟前14 d,脂肪质量分数逐渐上升,最高值达到31.77%,这与lvarez等[17]对山羊奶干酪的研究结果一致;而干酪A在成熟第7天时脂肪质量分数达到最高值28.96%。在成熟后期,两组干酪脂肪质量分数均呈现降低趋势,这可能是因为成熟后期,在微生物和酶的作用下,干酪内部的脂肪被降解为脂肪酸等物质[18]。
残留于干酪基质的凝乳酶对干酪成熟过程中游离氨基酸的形成具有一定的影响,同时干酪中的氨基酸质量分数反映了干酪蛋白质的降解程度。羊奶干酪在成熟期间蛋白质质量分数和总游离氨基酸质量比变化见图1(c)和图1(d)。在成熟过程中,干酪B的蛋白质质量分数始终高于干酪A。干酪B在成熟第14天,蛋白质质量分数达到最大值,为45.95%;而干酪A在成熟第7天时,蛋白质质量分数最高,为37.26%。两组干酪在成熟后期蛋白质质量分数缓慢降低,总游离氨基酸质量比逐渐增加,这可能是随着成熟时间的增加,干酪内部蛋白质被凝乳酶或发酵剂降解为小分子肽,并进一步降解为游离氨基酸[19]。尤其在成熟14 d后,干酪B中蛋白质质量分数明显下降,总游离氨基酸质量比明显增加,可能是GSBa- 1凝乳酶水解和乳酸菌释放的各种酶共同作用的结果。在成熟前期,干酪的游离氨基酸质量比降低,推测造成该现象的原因为游离氨基酸经转氨酶作用降解生成风味物质[20]。在成熟后期,干酪A游离氨基酸的质量比高于干酪B,这可能与两组干酪中蛋白酶的活性不同有关;随着干酪成熟时间的延长,乳酸菌可能发生自溶而释放肽酶,进而促进游离氨基酸的产生[21]。
由干酪基质中凝乳酶降解蛋白质产生的小分子肽可进一步转化成风味前体物质,促进干酪良好风味的形成,对干酪的最终味道产生显著影响[4]。干酪成熟期间各游离氨基酸质量分数的变化见表2。表2显示随着成熟时间延长,游离氨基酸质量分数显著增加(P<0.05)。芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)、支链氨基酸(异亮氨酸、亮氨酸、缬氨酸)和含硫氨基酸(半胱氨酸、蛋氨酸)是风味化合物的前体物质,对干酪风味形成产生重要影响。干酪A中存在少量的半胱氨酸,而干酪B中质量分数更低,且在7 d和21 d时未检出。两组干酪中质量分数较高的氨基酸皆为亮氨酸、苯丙氨酸、天冬氨酸、谷氨酸、脯氨酸、酪氨酸、缬氨酸,且干酪B中苯丙氨酸、天冬氨酸、异亮氨酸、甲硫氨酸和丝氨酸质量分数更高。

表2 羊奶干酪成熟期间游离氨基酸质量分数的变化
2.2 干酪成熟过程中活菌数变化分析
羊奶干酪成熟期间乳酸乳球菌活菌数变化见图2。两组干酪的活菌数在成熟过程中均呈现先增高后下降的趋势。在干酪成熟前21 d活菌数明显上升,这可能是由于成熟早期干酪中乳酸菌可利用乳糖生长繁殖[22]。随着干酪中残留的乳糖被完全分解,乳酸菌因无营养物质的补充而降低或丧失活力。

不同小写字母表示组间数据差异显著(P<0.05)。
2.3 干酪成熟期间质构变化分析
干酪的质构是影响干酪品质特性的重要参数之一,羊奶干酪成熟期间质构的变化见图3。图3显示随着成熟时间的增加,两组干酪的质构变化趋势大体相似。在干酪成熟第14天,弹性、咀嚼性达到最低值,主要是因为部分αS1酪蛋白被凝乳酶水解成肽而导致酪蛋白质网络变弱,干酪结构变得松散[23];而硬度达到最高值,可能是蛋白质水解产生新的离子基团与干酪中的游离水形成结合和解结合的平衡态,导致干酪成熟过程游离水含量及硬度的变化[24]。在干酪成熟第21天,黏度达到最高值,这可能与干酪成熟过程中pH值变化导致蛋白质分子间的疏水作用变化有关[17]。随着成熟时间延长,内聚性不断降低,这与干酪中蛋白质的降解有关,部分酪蛋白被降解为小分子的氨基酸和肽段,使得干酪的内聚性降低[21]。在成熟前期,干酪B质构特性较佳。
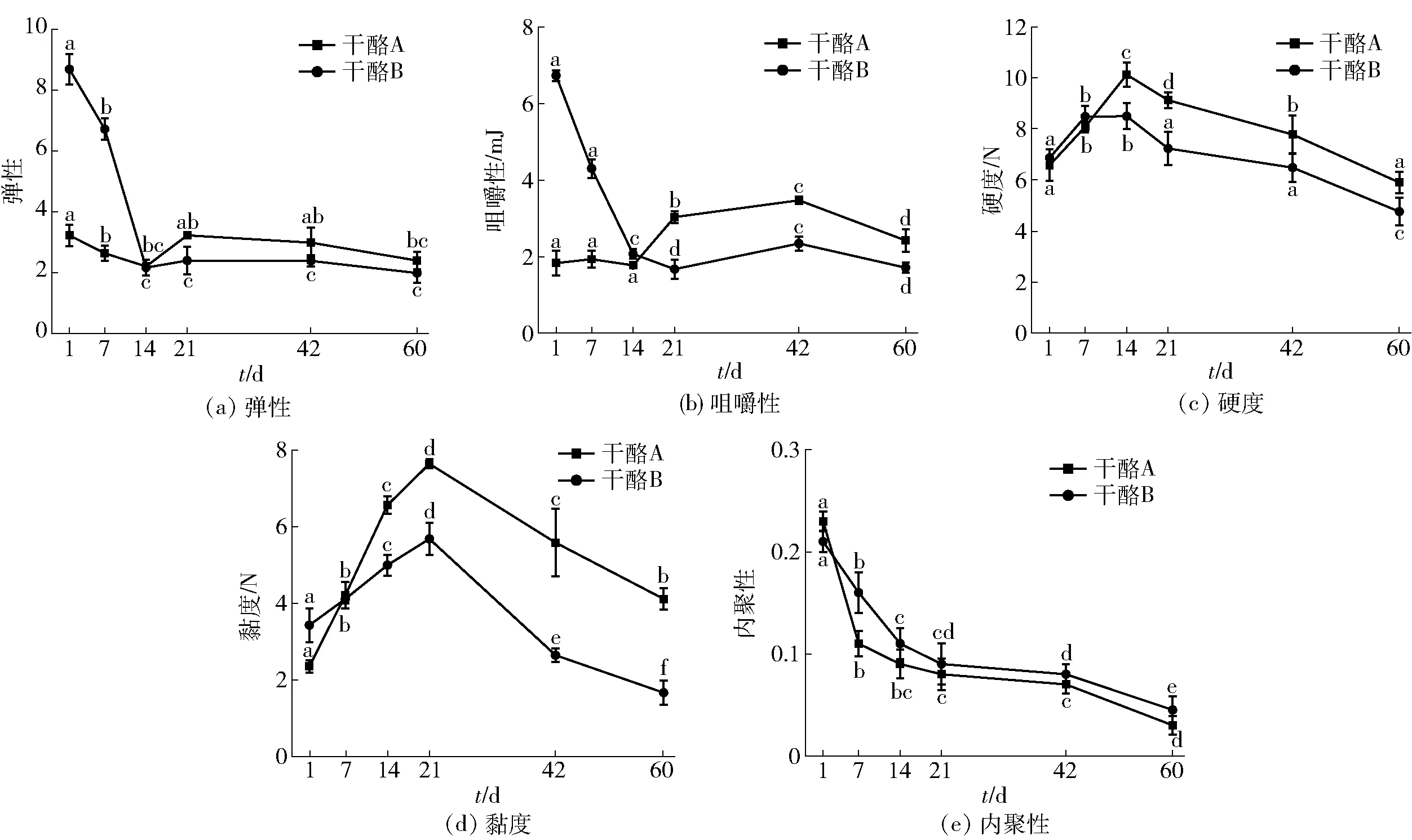
不同小写字母表示组间数据差异显著(P<0.05)。
2.4 干酪成熟过程中挥发性风味物质变化分析
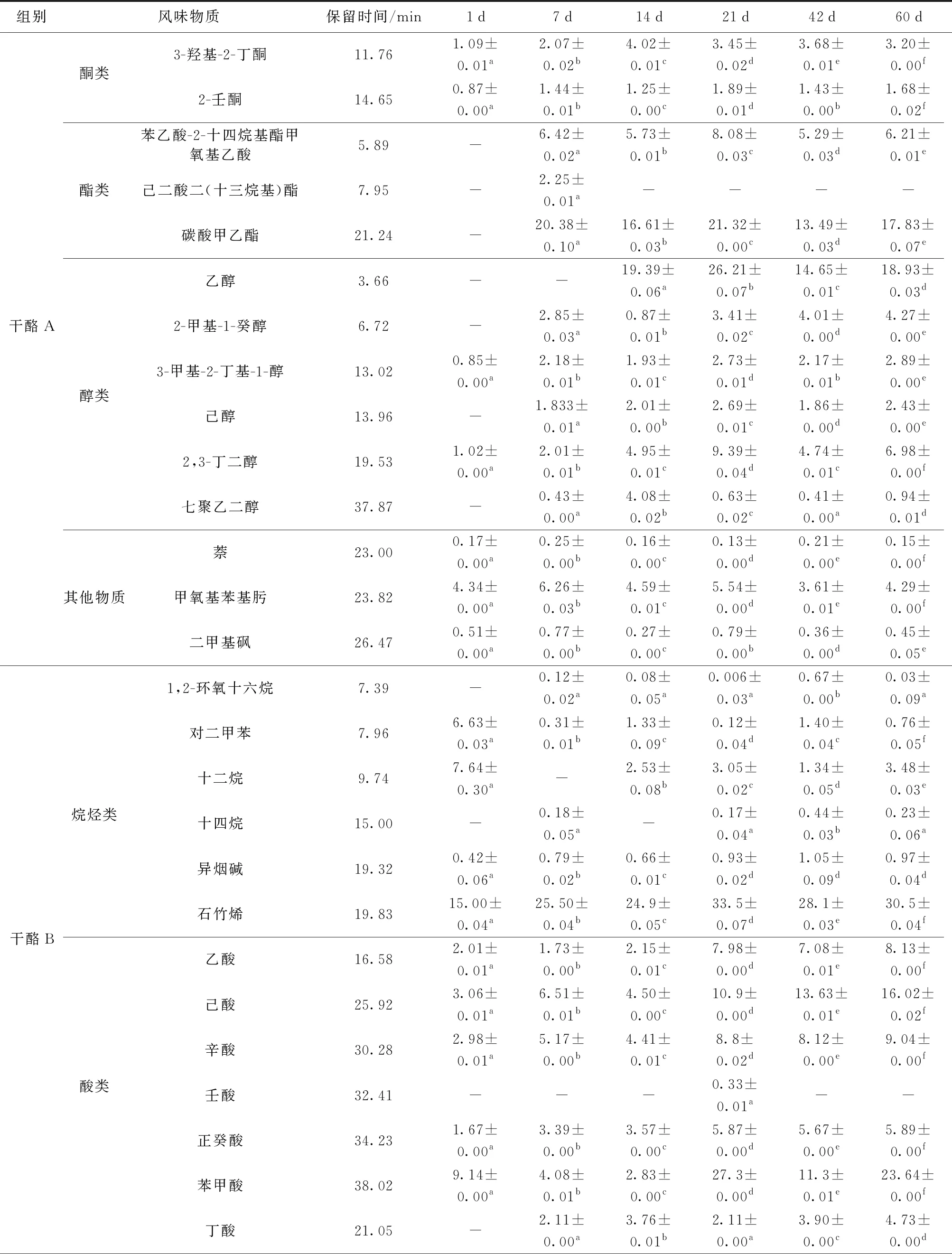
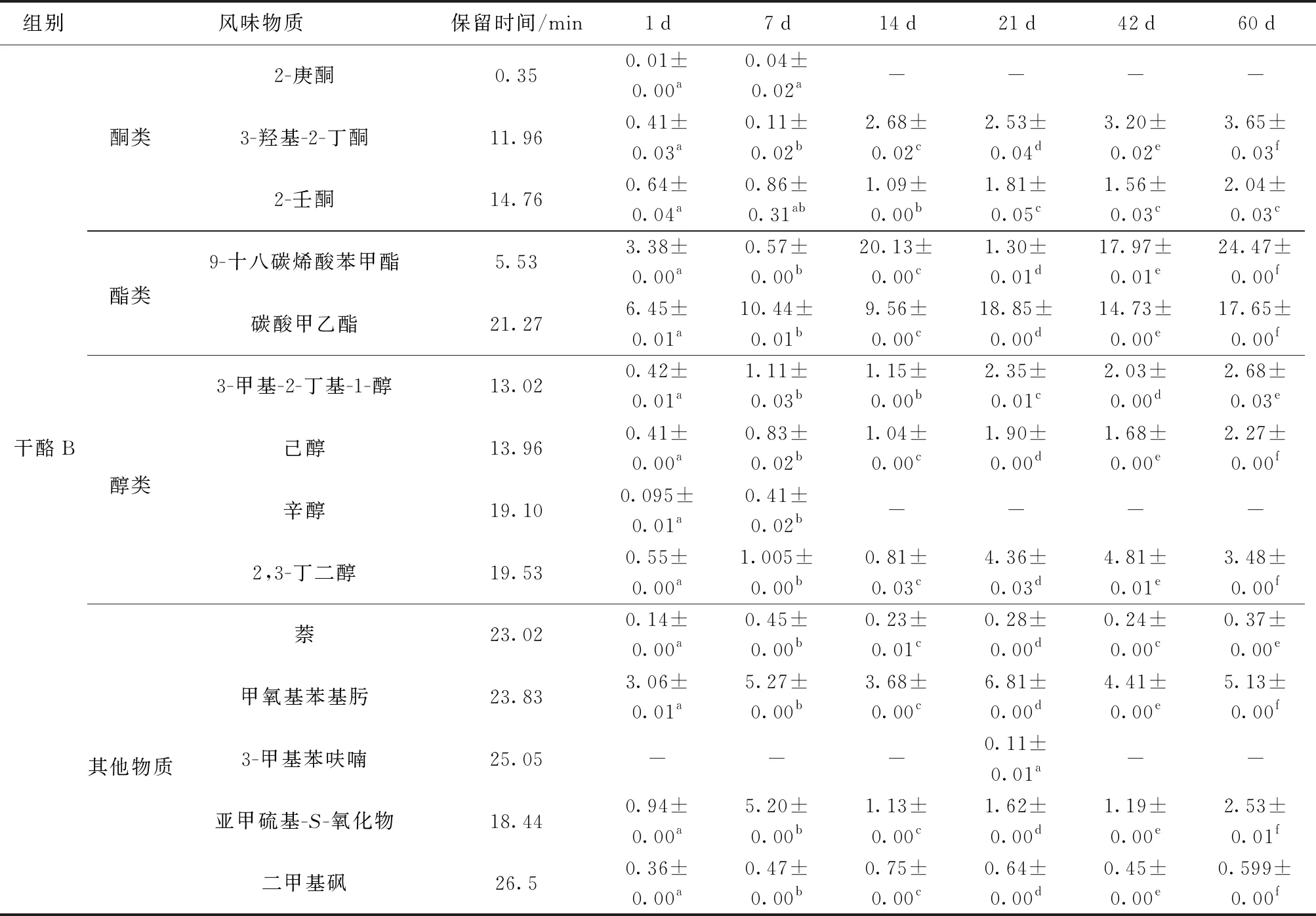
干酪的风味是干酪基质中存在的多种挥发性化合物相互作用的结果,如醇类、酯类、酸类、酮类。本研究采用GC- MS结合NIST Library数据库比对,对羊奶干酪中挥发性风味物质进行了系统分析。表3显示了2种羊奶干酪在1、7、14、21、42、60 d时挥发性风味物质质量比的变化。羊奶干酪一般风味物质的形成主要是通过发酵剂中乳球菌发生自溶现象而产生的胞内酶和胞外酶以及GSBa- 1凝乳酶对乳蛋白的水解作用,其中GSBa- 1凝乳酶的水解产物可能会进一步促进干酪风味前体物质的生成[25-27]。
续表3
续表3
醇类化合物作为干酪重要的风味化合物,主要通过乳糖、柠檬酸盐、甲基酮、氨基酸代谢等生化反应生成[26]。两组干酪中均检出3-甲基丁醇、2,3-丁二醇和己醇,干酪B中还检出辛醇。3-甲基丁醇由亮氨酸转氨酶生物合成及Strucker降解生成,赋予干酪麦芽味和坚果味[25];2,3-丁二醇的形成主要通过柠檬酸代谢途径将乙偶姻还原,赋予干酪水果香气[27]。
酸类化合物是影响干酪风味的主要成分之一,由碳水化合物分解代谢、脂类降解和蛋白质水解形成,也是甲基酮、仲醇、酯类等风味物质的前体化合物[26]。两组干酪中均有乙酸、丁酸、己酸、辛酸、正癸酸、苯甲酸检出,干酪B还生成了壬酸。其中,己酸和辛酸阈值较低,在高浓度下使干酪产生令人不悦的风味。苯甲酸由苯丙氨酸经转氨酶生物合成及Strucker降解生成,赋予干酪坚果味[25]。
酮类化合物也是干酪风味物质的重要组分,主要来源于脂肪酸的β-氧化和柠檬酸盐代谢[26]。两组干酪均检出3-羟基-2-丁酮和2-壬酮,干酪B还生成了2-庚酮。3-羟基-2-丁酮主要通过柠檬酸盐代谢途径将双乙酰还原生成[27],赋予干酪奶油味,且随着成熟时间的延长,3-羟基-2-丁酮质量比不断增加。由于乳酸菌的代谢[28],2-壬酮赋予干酪花香味、水果味和桃子味;2-庚酮由亚油酸氧化后生成,赋予干酪奶油香味。在成熟过程中,2-壬酮质量比呈不同程度的增加。在成熟期较长的干酪中,2-庚酮带有的霉味和油漆味,对干酪风味产生不良影响。
此外,酯类对干酪风味形成有重要影响,主要通过醇(主要为乙醇)和酸的酯化反应生成。两组干酪中均检出碳酸甲乙酯,在不同成熟时间,碳酸甲乙酯质量比差异显著(P<0.05)。两组干酪均检出二甲基砜,其主要由乳蛋白中甲硫氨酸、天冬氨酸降解生成,使干酪带有奶油味和椰子味[25]。
图4为干酪A、B的主成分分析结果。图4(a)显示了干酪A中,PC1的贡献率为60.9%,PC2的贡献率为17.5%;图4(b)显示了干酪B中,PC1的贡献率为63.2%,PC2的贡献率为18.9%。不同样品之间距离都相对较远,比较分散,表明样品之间的挥发性成分存在一定的差异,可以很好地解释不同成熟度干酪挥发性风味物质的变化[29]。干酪A中42 d和60 d样品距离较近,干酪B中21 d、42 d和60 d样品距离较近,表明干酪A和干酪B分别在42、21 d基本成熟,可能是由于解淀粉芽孢杆菌GSBa- 1凝乳酶和乳酸菌代谢对干酪的促熟作用,因此GSBa- 1凝乳酶可缩短干酪成熟时间,进而降低制造成本。对不同成熟期羊奶干酪风味化合物的 OAV (香气活度值)进行主成分分析,从而对干酪的差异进行表征,并进一步得到对奶酪差异贡献度较大的挥发性风味物质[29]。在成熟期60 d时,己醇、乙酸、2,3-丁二醇、3-羟基-2-丁酮是两组干酪共同的风味物质,此外干酪A产生了丁酸,干酪B产生了2-壬酮、苯甲酸。

图4 不同成熟时期羊奶干酪的主成分分析
3 结 论
本研究分析了解淀粉芽孢杆菌GSBa- 1凝乳酶对羊奶干酪成熟特性的影响。解淀粉芽孢杆菌GSBa- 1凝乳酶对羊奶干酪的得率、理化指标、组分无不良影响,提升了干酪持水力和成熟前期的弹性、咀嚼性和内聚性,促进了苯丙氨酸、天冬氨酸、异亮氨酸、甲硫氨酸、丝氨酸和风味物质的生成,缩短了羊奶干酪的成熟期,对羊奶干酪的品质提升起到了促进作用。研究旨在为微生物凝乳酶在羊奶干酪中的应用提供技术依据,希望有助于提升我国食品行业对羊奶干酪的研究和开发,为消费者提供新颖的乳制品。

