Cav-1表达对非小细胞肺癌患者吉非替尼治疗敏感性的影响
高冬梅,宋雪晶,安 杰,王永欣,范 婧,刘静普
2021年国家癌症中心发布最新全国癌症统计数据结果表明,2020年肺癌的发病率及病死率均占第一位,其中非小细胞肺癌(NSCLC)占80%左右。近年来随着分子靶向治疗逐步应用于临床,使得具有敏感基因突变的晚期NSCLC生存期有了明显改善。分子靶向治疗已经成为具有敏感基因突变NSCLC患者的主要治疗手段。目前研究表明,针对表皮生长因子受体(EGFR)突变阳性的NSCLC,应用分子靶向药物表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)治疗均较传统化疗显著延长了无进展生存期(PFS)和总生存期[1-6],EGFR-TKIs已经成为国际上公认的EGFR敏感突变阳性NSCLC一线治疗方案。EGFR-TKIs耐药问题已成为目前分子靶向治疗过程中亟待解决的问题,其耐药机制仍未完全明确。小凹蛋白-1(Cav-1)是细胞膜上Caveolae的重要组成蛋白,其通过与EGFR结合参与细胞增殖、分化过程[7-9]。已有研究表明,肿瘤细胞对EGFR-TKIs治疗的敏感性不同,其Cav-1的表达也不同[10]。因此,推测Cav-1表达与肿瘤细胞对EGFR-TKIs耐药相关。本研究通过免疫组织化学法检测具有EGFR敏感突变的NSCLC患者吉非替尼耐药前后肺癌组织中Cav-1表达情况,利用具有EGFR敏感突变NSCLC细胞株PC-9,采用Western blot法验证Cav-1过表达的稳定转染细胞株,采用划痕修复实验检测吉非替尼对稳定转染细胞株迁移的影响,并采用Western blot法检测不同Cav-1表达情况下EGFR、ERK及AKT激酶磷酸化水平,从而探讨Cav-1表达与NSCLC对吉非替尼耐药机制之间的关系。
1 材料与方法
1.1实验材料及试剂 所有标本为我院病理科2012—2019年组织穿刺标本(肺组织或转移淋巴结组织),经基因检测证明具有EGFR敏感突变确诊为ⅢB期或Ⅳ期肺腺癌21例。均应用吉非替尼治疗获益,其中男9例,女12例;中位发病年龄66岁;疗效评价稳定7例,部分缓解14例。中位耐药时间10.3个月,无疾病进展时间:最短为4个月,最长为23个月;同时收集耐药后肿瘤组织穿刺标本。所有组织切片均经两名有经验的病理医师双盲重新阅片,确诊为肺腺癌,应用免疫组织化学法进行Cav-1表达水平检测。EGFR敏感突变的NSCLC细胞株PC-9(哥伦比亚大学),PC-9/Cav-1细胞和PC-9/pcDNA3.1细胞(本实验室培养),胎牛血清(Hyclone),吉非替尼(AstraZeneca);兔抗EGF Receptor单克隆抗体,兔抗p-ERK 1/2多克隆抗体、兔抗p-AKT多克隆抗体(Cell Signaling);兔抗Cav-1抗体、鼠抗Cav-1单克隆抗体、鼠抗β-actin抗体(Santa Cruz);鼠抗磷酸化酪氨酸单克隆抗体(Millipore);酶标仪、低温离心机(Thermo公司)。
1.2方法
1.2.1资料收集:收集应用吉非替尼耐药病例,记录其用药时间与疾病进展时间,计算PFS,统计PFS>9.5个月和≤9.5个月病例数。
1.2.2免疫组织化学法检测:将NSCLC患者吉非替尼治疗耐药前后的组织切片,厚度3~5 μm;脱蜡至水;3%H2O2灭活内源性过氧化物酶(10 min);EDTA高温、高压抗原修复;滴加鼠抗人Cav-1单克隆抗体(1∶200);放入4 ℃冰箱过夜;滴加二抗,DAB显色,苏木素显色,盖玻片封片。用已知Cav-1表达阴性的正常肺组织作为阴性对照,用已知Cav-1表达阳性的肺癌组织作为阳性对照。光镜下可见Cav-1在间质和细胞膜着色。着色阳性表现为棕黄色或棕色,随机选取观察视野,计算阳性肿瘤细胞比例。阳性细胞数>25%定义为阳性,反之为阴性。
1.2.3细胞培养:将细胞冻存管从液氮中取出复苏,放入恒温培养箱中继续培养。
1.2.4Western blot检测Cav-1蛋白水平:处于对数生长期的PC-9、PC-9/Cav-1和PC-9/pcDNA3.1细胞消化后,提取蛋白,酶标仪检测蛋白水平。将30 μg蛋白样本等体积上样,电泳、转膜、封闭,分别置于兔抗Cav-1抗体(1∶4000)、鼠抗β-actin抗体(1∶5000)中,孵育过夜。洗涤,ECL显色,在暗室曝光。用扫描仪扫描胶片,实验重复3次。
1.2.5MTT法检测细胞增殖能力:将对数生长期的PC-9/Cav-1及PC-9/pcDNA3.1稳定转染细胞株,等浓度接种于96孔板,空白液为调0孔,均设3个复孔。培养24 h,加入含有不同浓度吉非替尼(0~2.56 μmol/L)的培养液继续培养48 h。每孔加入MTS溶液20 μl,培养30 min。检测吸光度值(波长490 nm)。计算细胞生长抑制率,观察吉非替尼半数抑制浓度(IC50)。实验重复3次。
1.2.6划痕修复实验检测细胞迁移能力:稳定转染细胞株PC-9/Cav-1和PC-9/pcDNA3.1接种于24孔板,均设复孔。培养24 h后,垂直于孔底划直线,用含或不含0.015 μmol/L吉非替尼的完全1640培养液继续培养18 h,每6小时拍照1次,计算迁移率。实验重复3次。
1.2.7Transwell法检测细胞侵袭能力:基质胶铺在小室底部,PC-9/Cav-1和PC-9/pcDNA3.1细胞饥饿4 h。上室加入无胎牛血清、下室加入含10%胎牛血清的1640培养基。分别用2 ml无胎牛血清1640培养基及含0.015 μmol/L吉非替尼的1640培养基重悬细胞,将等量的细胞加入上室,培养24 h。取出小室,常规HE染色,在200倍光镜下拍照,选取5个视野,计算穿膜细胞数。实验重复3次。
1.2.8Western blot检测信号通路蛋白磷酸化水平:将PC-9/Cav-1和PC-9/pcDNA3.1细胞消化分为两组接种在35 mm培养皿,培养24 h后,PBS洗涤,加入浓度为0.04 μmol/L吉非替尼培养液,一组直接收集细胞,另一组培养4 h收集细胞,Western blot检测相应蛋白的表达情况。实验重复3次。

2 结果
2.1不同PFS患者癌组织Cav-1阳性率比较 本组PFS≤9.5个月9例,>9.5个月12例。PFS≤9.5个月患者癌组织Cav-1表达均为阳性;而>9.5个月患者Cav-1表达阳性7例(58.3%);PFS≤9.5个月患者癌组织Cav-1表达阳性率高于>9.5个月患者(P<0.05)。
2.2不同PC-9细胞Cav-1蛋白表达水平比较 通过Western blot检测,PC-9/Cav-1细胞Cav-1蛋白相对表达水平较PC-9/pcDNA3.1细胞明显增高(P<0.05)。见图1。
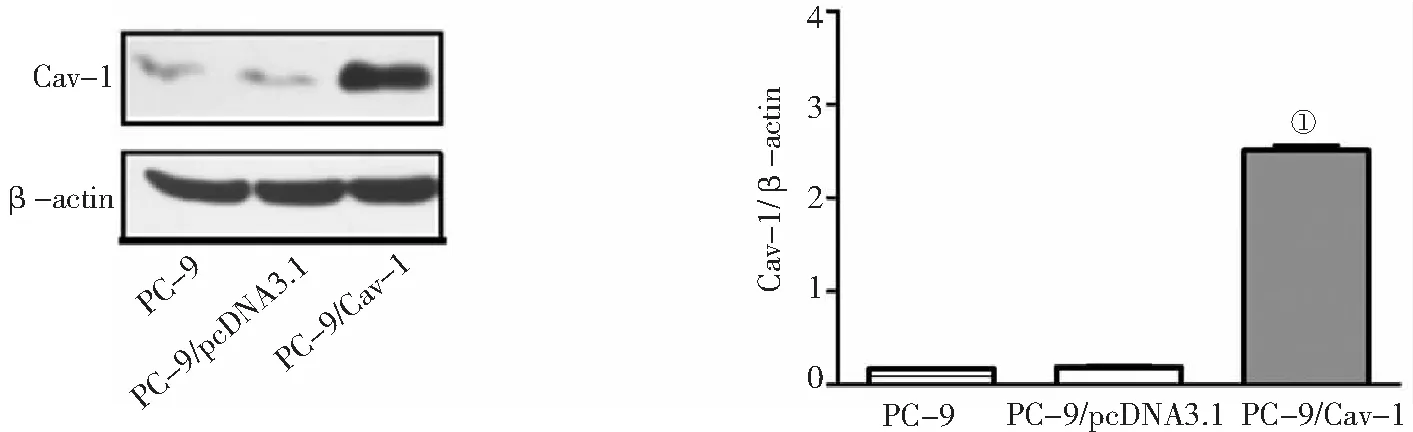
图1 不同PC-9细胞Cav-1蛋白表达情况Cav-1为小凹蛋白-1;与PC-9/pcDNA3.1细胞比较,①P<0.05
2.3Cav-1对不同浓度吉非替尼处理PC-9细胞增殖能力的影响 PC-9/Cav-1细胞的生长抑制率较PC-9/pcDNA3.1细胞降低,PC-9/Cav-1细胞吉非替尼的IC50值为0.04±0.01明显高于PC-9/pcDNA3.1细胞的0.015±0.01(P<0.05)。见图2。

图2 Cav-1对不同浓度吉非替尼处理PC-9/Cav-1和PC-9/pcDNA3.1细胞抑制率的影响Cav-1为小凹蛋白-1
2.4Cav-1对PC-9细胞迁移能力的影响 无吉非替尼培养基培养6、12、18 h,PC-9/Cav-1细胞迁移率分别为(20.10±0.01)%、(26.64±0.01)%、(50.00±0.00)%,PC-9/pcDNA3.1细胞迁移率分别为(14.89±0.02)%、(22.44±0.01)%、(25.08±0.02)%,PC-9/Cav-1细胞迁移率分别高于PC-9/pcDNA3.1细胞(P<0.05)。含0.015 μmol/L吉非替尼培养基培养6、12、18 h,PC-9/Cav-1细胞迁移率分别为(15.25±0.00)%、(20.44±0.02)%、(22.47±0.01)%,PC-9/pcDNA3.1细胞迁移率分别为(5.61±0.01)%、(9.90±0.02)%、(12.10±0.00)%,PC-9/Cav-1细胞迁移率分别高于PC-9/pcDNA3.1细胞(P<0.05)。见图3。

图3 Cav-1对PC-9/Cav-1和PC-9/pcDNA3.1细胞迁移能力的影响(10×)Cav-1为小凹蛋白-1
2.5Cav-1对PC-9细胞侵袭能力的影响 Transwell法检测显示,PC-9/Cav-1细胞在无吉非替尼作用下穿膜细胞数为(93.00±11.68)个,多于PC-9/pcDNA3.1细胞的(66.40±6.02)个(P<0.01);PC-9/Cav-1细胞在0.015 μmol/L吉非替尼作用下穿膜细胞数为(56.20±4.87)个,多于PC-9/pcDNA3.1细胞的(23.20±3.19)个(P<0.01)。见图4。

图4 Cav-1对PC-9/Cav-1和PC-9/pcDNA3.1细胞侵袭能力的影响(HE×200)Cav-1为小凹蛋白-1
2.6吉非替尼对PC-9细胞信号通路蛋白磷酸化水平的影响 无或有吉非替尼培养基培养的PC-9/Cav-1细胞pY-EGFR、p-ERK、p-AKT表达水平均明显高于PC-9/pcDNA3.1细胞(P<0.01)。见图5。

图5 有或无吉非替尼培养基培养的PC-9/Cav-1和PC-9/pcDNA3.1细胞信号通路蛋白磷酸化水平的影响EGFR为表皮生长因子受体,Cav-1为小凹蛋白-1
3 讨论
针对晚期NSCLC,化疗已进入瓶颈期,虽然化疗药物不断更新,在疗效上也有所改善,但是中位PFS为6个月左右,1、2年生存率分别为30%、10%左右[10-11]。随着对肺癌发病机制研究的逐步深入,针对基因敏感突变晚期NSCLC的靶向药物逐步应用于临床,取得了良好疗效。IPASS研究发现,EGFR突变作为目前已知肺癌驱动基因,其突变率为19%~48%[12]。有研究证实,EGFR-TKIs客观缓解率为60%~85%,PFS为8~13个月[13-16],奠定了EGFR-TKIs在EGFR敏感突变阳性晚期NSCLC一线治疗中的地位。FLAURA与ADAURA试验分别奠定了三代EGFR-TKIs在EGFR敏感突变阳性晚期NSCLC一线治疗及术后辅助治疗中的地位。然而,部分具有EGFR敏感突变患者仍存在EGFR-TKIs效果不佳、治疗敏感性不一的情况,本研究认为与患者同时存在其他蛋白间相互作用信号通路激活,导致肿瘤细胞增殖有关。
Cav-1为膜整合蛋白,N端氨基酸残基为Cav-1的功能区,该区域与EGFR结合参与细胞代谢过程[7,9]。70%以上NSCLC患者的肿瘤细胞均有Cav-1表达,Cav-1高表达NSCLC患者的肿瘤细胞增殖及潜在转移能力增强[17]。MEIER等[18]通过破坏caveolae从而成功阻止PI3K的活化,并证明Cav-1通过影响EGFR信号通路蛋白磷酸化或去磷酸化等途径调控信号传导改变肿瘤细胞的多种生物学行为[8],参与PI3K/AKT信号通路激酶系统的信号传导,促进肿瘤细胞增殖,抑制凋亡,导致肿瘤发生[17]。作为细胞膜的重要组成蛋白,在肺癌化疗、放疗耐药后均存在Cav-1表达增加[19],在紫杉醇耐药的肺腺癌A549细胞中,敲低Cav-1能够抑制AKT的磷酸化,而降低细胞增殖能力[8]。将肺癌H292细胞暴露于NO中会引起Cav-1、p-AKT过表达,导致肺癌H292细胞对阿霉素和依托泊苷耐药,促进细胞存活[20]。另有研究表明,Cav-1过表达导致A549和PC-9细胞对铂类耐药,抑制Cav-1/AKT/Bad信号通路,恢复耐药A549和PC-9细胞株对顺铂的敏感性[21]。PHILIPS等[22]通过雷公藤甲素处理A549和H460 NSCLC细胞,发现其能够降低Cav-1表达,并通过AKT/Bax通路影响肺癌细胞。上述研究均说明Cav-1参与肿瘤信号传导通路的激活,并与肿瘤的放化疗耐药相关。本研究结果发现,在EGFR敏感突变NSCLC患者癌组织中Cav-1表达水平与疗效相关,在吉非替尼治疗过程中,疾病进展较快的EGFR敏感突变NSCLC患者,Cav-1表达水平高于PFS较长患者。同时本研究还发现,Cav-1过表达的EGFR敏感突变PC-9细胞在吉非替尼作用下较Cav-1正常表达PC-9细胞的迁移能力增强。Cav-1过表达导致EGFR敏感突变PC-9细胞EGFR和AKT磷酸化程度增强,EGFR下游PI3K/AKT信号传导增强,促进细胞生长迁移,减弱了吉非替尼对下游PI3K/AKT信号传导通路的抑制作用,导致EGFR敏感突变PC-9细胞对吉非替尼的敏感性降低,由此表明Cav-1高表达与具有EGFR敏感突变NSCLC患者EGFR-TKIs治疗耐药相关。
综上所述,对于EGFR敏感突变NSCLC患者,若同时存在Cav-1高表达,则应用吉非替尼治疗的PFS较Cav-1低表达患者短。Cav-1过表达使EGFR敏感突变PC-9细胞对吉非替尼耐受性增加,细胞的迁移能力增强。Cav-1参与了EGFR磷酸化过程,同时也促进了下游PI3K/AKT、MAPK/ERK信号传导通路蛋白磷酸化过程,促进信号传导。在Cav-1过表达的PC-9细胞中,吉非替尼对上述信号传导过程的抑制作用减弱,进而导致肿瘤细胞对吉非替尼治疗敏感性下降。但由于本研究样本量较小,该结论有待大样本研究结果进一步证实。

