EGFR突变阳性非小细胞肺癌中上皮间质转化对EGCG逆转吉非替尼耐药的作用
侯 磊,安改丽,孙晶莹,冯阳蒙,霍雪萍,赵永丽
(1陕西省人民医院肿瘤内科,西安 710068;2陕西省人民医院中心实验室;3陕西省康复医院手术室;*通讯作者,E-mail:wrhouyijia2008@163.com)
肺癌死亡率在恶性肿瘤中位居第一,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)占所有肺癌类型85%。吉非替尼(gefitinib,易瑞沙)、厄洛替尼片或阿法替尼等为代表的上皮生长因子受体酪氨酸激酶抑制剂(epithelial growth factor receptor tyrosine kinase inhibitors,EGFR-TKI)在具有EGFR突变的NSCLC中展现出了较高疗效,因此,这些EGFR-TKI成为存在EGFR突变晚期NSCLC患者一线用药选择。然而,这些患者通常在服药10个月左右都会产生耐药,因此,克服或推迟耐药能够明显促进该类患者预后。
目前普遍认为,耐药由多种因素导致,包括T790M继发突变、转化成小细胞肺癌、癌细胞干性获得、上皮间质转化(epithelia-mesenchymal transition,EMT)等[1]。其中EMT在许多生理或病理过程中都会发生,主要表现为上皮细胞获得间质细胞特性,上皮特性蛋白E-cadherin表达下降,间质特性蛋白N-cadherin表达上升。EMT发生与多种肿瘤药物耐药相关,因此,是克服耐药一个关键靶点[2,3]。
表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是茶酚主要成分,占总量50%-75%,具有抗炎症、预防肿瘤、预防心脑血管疾病等多种生物活性[4-6]。此外,EGCG也被发现具有抑制EMT发生的作用,因此,EGCG是否具有逆转或推迟EGFR-TKI耐药作用需要被进一步研究。本研究检测了EGCG与吉非替尼作用于吉非替尼耐药细胞株后,细胞周期、凋亡及凋亡相关蛋白以及EMT相关蛋白表达变化情况,旨在探讨EGCG能否逆转吉非替尼在EGFR突变阳性非小细胞肺癌中的耐药,及EMT是否发生了改变。
1 材料与方法
1.1 细胞株及主要试剂
人肺腺癌细胞株PC9购自中国科学院上海生科院细胞资源中心。吉非替尼购于英国AstraZeneca公司。甲基偶氮唑盐(MTT)、表没食子儿茶素没食子酸酯(EGCG)购买于美国Sigma公司。PRMI1640培养液、小牛血清购于美国HyClone公司。兔抗人Caspase-3、Bcl-2、E-cadherin、N-cadherin抗体购于武汉三鹰公司。Annexin Ⅴ/PI双染凋亡试剂盒购买于上海七海复泰生物科技有限公司。SDS-PAGE胶制备试剂盒与RNA酶(RNase)购于陕西先锋生物科技有限公司。
1.2 细胞培养与吉非替尼耐药株构建
PC9细胞采用RPMI1640培养液(10%小牛血清+双抗)在5% CO2、饱和湿度、37 ℃培养箱内培养。每2-3 d传代1次。使用半数致死剂量浓度吉非替尼持续培养PC9细胞至不再出现明显死亡,逐渐增加吉非替尼浓度至1 μmol/L(吉非替尼有效血药浓度为1 μmol/L),通过有限稀释法单细胞种植于96孔板,继续使用1 μmol/L吉非替尼培养,将生长状态良好的1孔细胞进行扩增培养,挑选生长良好的细胞转至24孔板继续生长,将其命名为PC9耐药组,为实验所需耐药株(吉非替尼溶解于DMSO中)。
1.3 MTT法检测细胞毒性
细胞以2×104/ml浓度接种于96孔板培养24 h,PC9细胞分别使用0.01,0.02,0.04,0.08,0.16 μmol/L吉非替尼处理,计算IC50。PC9耐药细胞分别使用0.8,1,2,4,8,16 μmol/L吉非替尼处理,计算耐药组IC50。为筛选对PC9耐药细胞生长无明显影响的EGCG剂量,PC9耐药细胞分别使用5,10,20,40,100,200 μmol/L的EGCG处理。各组培养44 h,毎孔中加入MTT 20μl(5 mg/ml)继续培养4 h,弃掉培养液后加入200 μl DMSO,酶标仪读取490 nm吸光值,计算细胞增殖率,计算半数抑制率(IC50,GraphpadPrism 5.0)。
1.4 细胞分组及处理
PC9耐药组细胞分别用吉非替尼(1 μmol/L)、EGGC(5 μmol/L)、1 μmol/L吉非替尼+5 μmol/LEGGC孵育48 h后,分别命名为吉非替尼组、EGCG组和吉非替尼+EGCG组。
1.5 流式细胞仪检测细胞周期
细胞使用胰酶制成悬液,使用70%的冰乙醇4 ℃固定24 h,细胞离心弃除乙醇,加入RnaseA,37 ℃水浴30 min,加入PI 50 μl,4 ℃避光30 min,选择488 nm波长检测DNA含量,使用细胞周期拟合软件分析各周期细胞百分比。
1.6 流式细胞仪检测细胞凋亡
使用胰酶消化制成细胞悬液,PBS重新悬浮离心细胞2次,加入500 μl 1×Binding Buffer、5 μl Annexin Ⅴ-FITC、10 μl PI,混匀室温下避光15 min,上机检测,以不加Annexin Ⅴ-FITC及PI细胞悬液作为阴性对照。
1.7 Western blot检测Caspase-3、Bcl-2、E-cadherin和N-cadherin表达
细胞使用蛋白裂解液提取细胞蛋白,BCA法测定浓度。同剂量蛋白上样后进行SDS-PAGE凝胶电泳分离,PVDF膜转膜,TBST(5%脱脂奶粉)封闭2 h,一抗4 ℃孵育过夜凋亡相关蛋白Caspase-3(1 ∶1 000)和Bcl-2(1 ∶1 000)与EMT相关蛋白E-cadherin(1 ∶800)和N-cadherin(1 ∶800),二抗室温孵育1 h,加入ECL显色底物,使用Image-ProPlus软件分析灰度值。
1.8 统计学分析

2 结果
2.1 细胞毒性检测与耐药株构建
MTT法检测结果提示吉非替尼针对PC9细胞生长抑制为剂量依赖性(见图1),IC50为0.031 μmol/L。吉非替尼对PC9耐药细胞生长抑制也呈剂量依赖性(见图1),IC50为5.93 μmol/L,表明PC9耐药细胞较PC9细胞针对吉非替尼具有明显抵抗性。EGCG在浓度大于20 μmol/L时,对PC9耐药细胞生长开始出现抑制现象(见图1),而后续实验需要一个对细胞生长无明显影响的条件,因此选择了5 μmol/L作为后续研究EGCG浓度。随后在该条件基础上再次对PC9耐药组细胞进行吉非替尼细胞毒性实验。结果发现吉非替尼针对PC9耐药细胞生长抑制能力明显增强,IC50降至3.86 μmol/L(见图1)。

与吉非替尼组比较,*P<0.05图1 MTT检测吉非替尼和EGCG作用48 h对细胞生长的影响Figure 1 Effect of gefitinib and EGCG on cell growth at 48 h by MTT
2.2 EGCG增加了吉非替尼对耐药细胞周期阻滞
流式细胞仪检测细胞周期,结果显示:PC9耐药组、吉非替尼组、EGCG组及吉非替尼+EGCG组G2/M期细胞比例分别为(10.8±1.2)%,(9.5±2.0)%,(12.3±2.1)%和(38.0±3.0)%(见图2)。PC9耐药组、吉非替尼组和EGCG组间G2/M期细胞比例差异无统计学意义(P>0.05),吉非替尼+EGCG组相比于其他三组,G2/M期细胞比例增多,差异具有统计学意义(P<0.05)。结果表明,EGCG联合吉非替尼能够将耐药细胞周期阻滞于G2/M期。
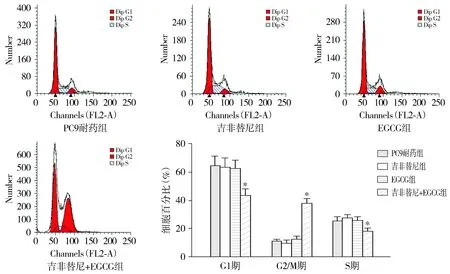
与其他三组比较,*P<0.05图2 流式细胞仪检测吉非替尼与EGCG对PC9耐药细胞周期影响 (n=3)Figure 2 Effect of gefitinib and EGCG on the cell cycle of gefitinib-resistant PC9 cells by flow cytometry (n=3)
2.3 EGCG促进了吉非替尼对耐药细胞凋亡的诱导
通过流式细胞仪分析细胞凋亡变化,结果显示:PC9耐药组、吉非替尼组、EGCG组及吉非替尼+EGCG组细胞凋亡率分别为(8.2%±1.3)%,(10.0±1.3)%,(8.1±0.9)%,(21.6±2.7)%(见图3)。相较于PC9耐药组、吉非替尼组、EGCG组,吉非替尼+EGCG组细胞凋亡率明显增多,差异具有统计学意义(P<0.05)。PC9耐药组、吉非替尼组和EGCG组之间细胞凋亡率并无明显差异(P>0.05)。结果表明,EGCG的使用提高了吉非替尼对于耐药细胞诱导凋亡的能力。
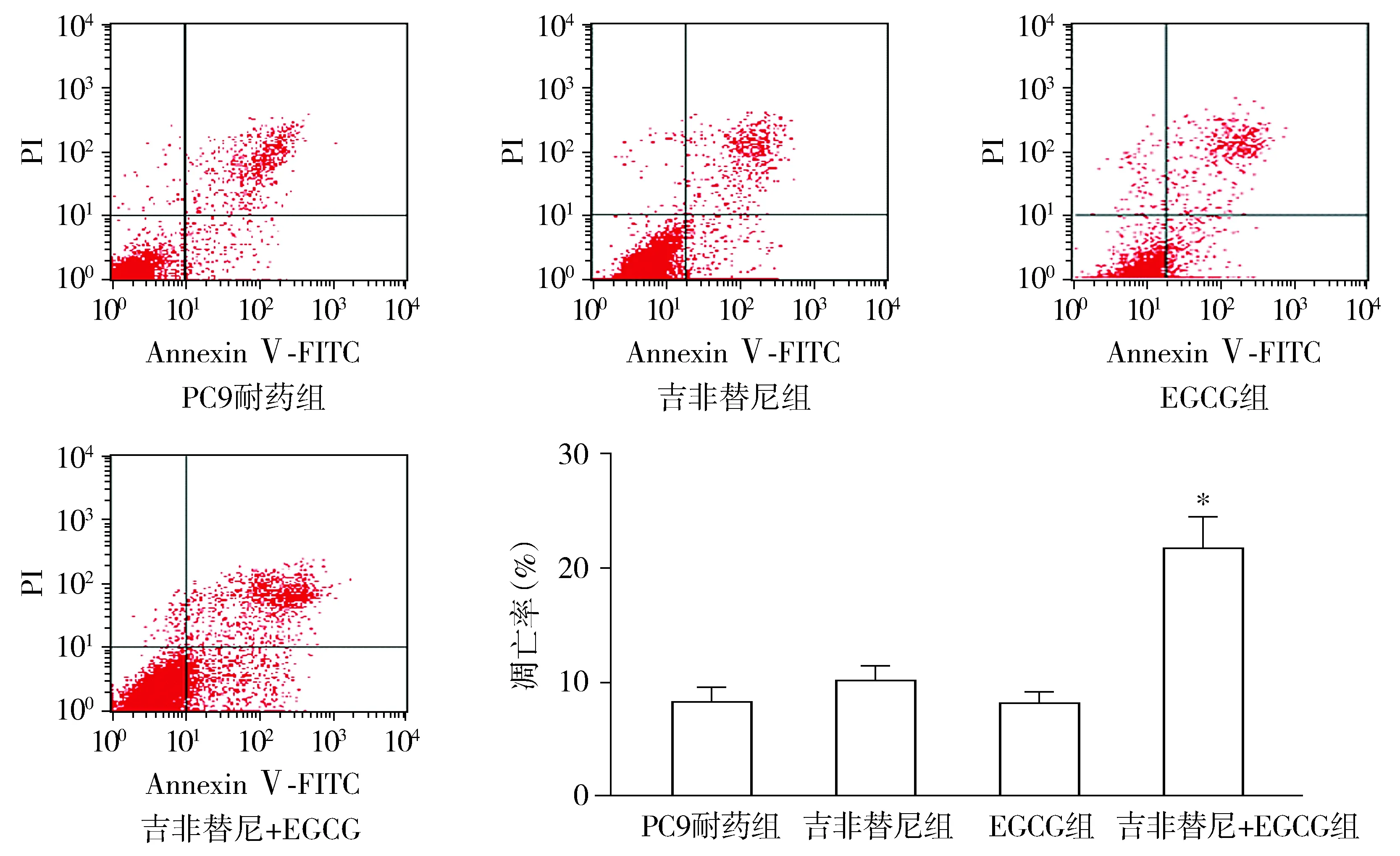
与其他三组比较,*P<0.05图3 流式细胞仪检测吉非替尼与EGCG对PC9耐药细胞凋亡的影响 (n=3)Figure 3 Effect of gefitinib and EGCG on the apoptosis of gefitinib-resistant PC9 cells by flow cytometry (n=3)
2.4 EGCG提高了吉非替尼对耐药细胞凋亡相关蛋白的影响
使用Wester blot检测凋亡相关蛋白Caspase-3和Bcl-2表达变化,结果提示:相较于PC9耐药组、吉非替尼组和EGCG组,吉非替尼+EGCG组细胞Caspase-3表达量明显增多,Bcl-2表达明显减少,差异具有统计学意义(P<0.05,见图4)。PC9耐药组、吉非替尼组、EGCG组间Caspase-3和Bcl-2表达差异无统计学意义(P>0.05)。表明EGCG使用能够明显促进吉非替尼对耐药细胞内Caspase-3表达的诱导和Bcl-2表达的抑制。

与其他三组比较,*P<0.05图4 Western blot检测吉非替尼与EGCG对PC9耐药细胞Caspase-3与Bcl-2表达的影响 (n=3)Figure 4 Effect of gefitinib and EGCG on expression of Caspase-3 and Bcl-2 in gefitinib-resistant PC9 cells by Western blot (n=3)
2.5 EGCG逆转吉非替尼诱导的EMT相关蛋白改变
使用Western-blot检测PC9组、PC9耐药组、EGCG组细胞EMT相关蛋白E-cadherin与N-cadherin表达变化,结果显示,与PC9组比较,PC9耐药组E-cadherin蛋白表达明显减少,N-cadherin蛋白表达明显增多,差异具有统计学意义(P<0.05)。与PC9耐药组相比,EGCG组E-cadherin蛋白表达增多,N-cadherin蛋白表达减少,差异具有统计学意义(P<0.05,见图5)。结果表明,吉非替尼的耐药与其上皮间质转化有关,而EGCG能够抑制这种转化。
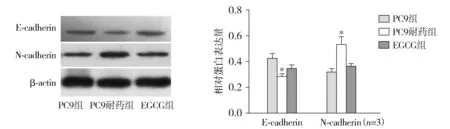
与PC9组和EGCG组比较,*P<0.05图5 Western blot检测吉非替尼与EGCG对PC9细胞EMT相关蛋白影响 (n=3)Figure 5 Effect of gefitinib and EGCG on expression of EMT-related proteins in PC9 cells by Western blot (n=3)
3 讨论
EGFR常见突变的NSCLC对于EGFR-TKI具有较好反应,但随时间延长,耐药变为不可避免。因此,必须寻找一种方法来延缓或克服耐药发生。一种思路是联合一种药物去克服或推迟耐药。有研究使用NAC联合吉非替尼,发现能够有效克服耐药[7]。还有使用Decitabine,一种DNA甲基转移酶抑制剂,逆转吉非替尼耐药[8]。本研究挑选了EGCG,结果表明同样具有克服吉非替尼耐药作用。
EGCG是绿茶中多酚的主要成分,拥有抗氧化、抗炎症、抗凋亡等特性,并对肿瘤病人相对安全[9,10]。本研究使用PC9细胞株,EGFR19外显子缺失突变的肺腺癌细胞株。构建了针对吉非替尼耐药细胞株,通过MTT法分析吉非替尼IC50,结果表明PC9耐药组的IC50较PC9组的IC50提高了100多倍,表明构建耐药细胞的确对吉非替尼产生了耐药。为了研究EGCG是否能够逆转吉非替尼耐药,挑选了一个针对PC9耐药细胞生长无明显影响的条件,在此基础上,通过MTT实验再次检测吉非替尼对PC9耐药细胞影响,结果表明IC50下降。同时,通过流式细胞仪检测了EGCG的使用是否改变了吉非替尼对PC9耐药细胞细胞周期和凋亡的影响,结果表明,EGCG的联合能够将细胞周期阻滞于G2/M期,同时EGCG的联合能够明显提高吉非替尼对凋亡的诱导。Western blot结果也表明,EGCG能够提高吉非替尼诱导细胞凋亡相关蛋白表达。这些研究进一步表明EGCG能够逆转吉非替尼耐药,使得吉非替尼耐药细胞再次对吉非替尼发生反应。这与Meng等[11]研究结果相似,但他们研究主要集中在ERK信号通路上。EGCG是一个泛靶点药物,除了该条通路是否还存在其他机制来逆转耐药。
目前吉非替尼耐药机制主要包括:1.经典耐药机制,EGFR基因二次突变和c-MET扩增;2.代偿信号通路的建立和调节因子基因表达的改变,如IL-6/JAK1/STAT3信号通路激活、IGF1R介导的信号通路激活、Kras基因突变等;3.EMT发生转换[12,13]。研究表明,EGCG在肿瘤细胞和非肿瘤细胞都具有较强的EMT抑制作用。在甲状腺癌细胞中,EGCG能够通过抑制TGF-β1/Smad通路抑制EMT发生[14],在干细胞中,EGCG也能够抑制EMT发生[15]。因此,考虑EGCG对于吉非替尼耐药逆转,是否可能通过对EMT影响而实现。结果发现,PC9细胞和PC9耐药细胞相比,E-cadherin蛋白表达下降,N-cadherin蛋白表达上升,表明吉非替尼耐药的确与肿瘤细胞EMT发生相关。而EGCG下调PC9耐药细胞N-cadherin蛋白表达,上调E-cadherin蛋白表达。表明EGCG能够逆转耐药PC9细胞EMT。因此,EGCG对EMT影响是其逆转PC9对吉非替尼耐药机制之一。虽然研究结果显示,EGCG只是将吉非替尼IC50降到了3.86 μmol/L,并没有降至1 μmol/L之下,但由于使用的EGCG只是一个最低剂量,且EGCG对PC9耐药细胞也呈现一个剂量依赖性细胞毒性,因此,理论上能够通过提高EGCG剂量来增加协同效果,这需进一步研究。
综上所述,EGCG能够逆转存在EGFR突变肺腺癌细胞对EGFR-TKI耐药,抑制EMT发生是逆转耐药机制之一。吉非替尼耐药机制较多,本实验诱导的耐药细胞除EMT机制外,是否还存在其他耐药机制,且EGCG为多靶点药物,是否还存在其他逆转耐药机制需要我们进一步研究。

