局部晚期宫颈癌新辅助化疗后腔内后装放疗时机选择的研究
陈秋秋,黄辉*,刘美莲,蔡锐
(1.桂林市人民医院肿瘤科,广西 桂林 541002;2.桂林医学院附属医院放疗科,广西 桂林 541001)
0 引言
在世界广大区域范围内,宫颈癌是育龄女性第4 位常见的恶性肿瘤[1,2]。2012 年,全球女性全年发生宫颈癌527 600 例,年死亡数为265 700 例。接近85%宫颈癌发生于发展中国家,并且在这些发展中国家宫颈癌居癌症死因的首位[3,4]。2015 年我国癌症调查报告显示,宫颈癌发病率在全国妇科恶性肿瘤中高居首位[5-7]。局部晚期宫颈癌( local advanced cervical cancer LACC) 指一组具有不良预后因素的高危宫颈癌,广义的局部晚期宫颈癌范围包括宫颈癌ⅠB2~ⅣA 期,放化疗综合治疗为其主要治疗手段之一。新辅助化疗( neoadjuvant chemotheraPy,NACT)则是指在局部实施手术或放疗前应用的全身或局部化学治疗,其目的在于缩小恶性肿瘤局部生理病灶、减轻恶性肿瘤局部病理转移负荷、控制亚临床恶性肿瘤病理转移、改善恶性肿瘤转移患者病理整体性和全身病理健康状况、改善生活力和工作环境质量等[8,9]。宫颈癌是一种化疗敏感性肿瘤,因此新辅助化疗对其有效[10]。外照射放疗结合腔内后装放疗是中晚期宫颈癌的根治性放疗手段,多数情况下腔内后装放疗在外照射放疗后期,这时肿瘤体积已明显缩小,近距离放疗器械容易到达合适的位置[11]。本文研究新辅助化疗肿瘤体积明显缩小后,腔内后装放疗在调强外照射放疗的早期进行的可行性。
1 资料与方法
1.1 一般资料
选择2013 年9 月至2017 年8 月住院桂林医学院附属医院放疗科诊治的宫颈癌患者110 例,研究通过医院伦理审查,患者签署知情同意书,患者随机分为观察组和对照组。入选标准:宫颈病理检查确诊,国际妇科联盟(FIGO)临床分期ⅡB-ⅣA期110 例,初诊患者,临床实验开始前未行任何抗肿瘤治疗;存在按实体瘤的疗效评价标准(RECIST)标准可直接测量的恶性病灶;患者的血常规为WBC>4×109/L,PLT>100×109/L;经检查患者的心电图以及肾、肝功能均正常。排除标准:发生任何远处转移的患者;以前或现在患任何其他恶性肿瘤的患者;任何其它疾病或状况为放化疗禁忌证;妊娠、哺乳期妇女,或有生育能力但未采取避孕措施的女性患者;严重骨髓细胞发育功能障碍者;有出血感染倾向者。其中随机分配为观察组55 例,对照组55 例, 2 组患者的年龄及病情差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者病历资料
1.2 治疗方法
观察组采用新辅助化疗+( 调强外照射放疗+同时腔内后装放疗)+ 同期化疗,对照组采用( 调强外照射放疗+ 后期腔内后装放疗:外照射第周后进行后装)+ 同期化疗。①新一代化疗药物用于新辅助化疗:多西他赛75mg/m2,d1,静滴;顺铂30mg/m2,d1~3,静滴,21d 重复1 次,共2 次化疗。②同期化疗:顺铂每周30mg/m2,于放疗后第1 周开始用药,并继续反复用药,至少完成5w。③调强外照射放疗:热塑成形体膜固定患者体位,螺旋CT 扫描定位,5mm 层厚;图像经数字化传输,进入放疗计划系统设计IMRT 放疗计划,由放疗科主管医师根据影像学检查勾画靶区,并经过全科讨论通过。其中大体肿瘤区(GTV) 为CT、MRI 和妇科体检可及原发肿瘤、GTV-nd 为符合诊断标准阳性淋巴结。临床靶区(CTV) 包括GTV、子宫旁组织、盆腔的淋巴引流区,即宫颈、子宫、左右宫旁、闭孔、髂总血管、髂内、髂外及骶1-3 水平的骶前淋巴结区域,如无腹主动脉旁淋巴结转移,则上界到L4 下缘,下界到闭孔下缘;病理证实有淋巴结转移或影像学上有可疑髂总或腹主动脉淋巴结转移者,需包含腹主动脉淋巴结区域,即上至T10上缘。计划靶区(PTV) 根据本院的摆位误差及器官运动和器官充盈度在CTV 的前后方向外放8mm,其余方向外放1cm,以PTV 几何中心为射野中心,设5~7 个共面照射野,肿瘤剂量45Gy/25f,符合诊断标准阳性淋巴结GTV-nd 需要追加高度适形放疗,追加剂量为10~15Gy,为应用计划系统计算剂量分布,要求95% 等剂量线包绕靶区,使用设野影像系统进行位置验证。④腔内后装放疗:采用北京科霖众192Ir 后装治疗机,每次根据患者的宫腔深度、两侧阴道深度及宫颈口外肿瘤的情况设计个性化的施源器大小配置,所有患者采用纱布条填塞前后阴道,X 线模拟定位机摄取正交X 线定位,使其剂量分布成以宫颈原发病灶为中心的“鸭梨型”,腔内后装治疗每周1 次,治疗当日不进行外照射,2 组总剂量A 点剂量30Gy/5 次。⑤调强外照射放疗和腔内后装放疗时机,观察组新辅助化疗后肿瘤退缩明显患者(CR+PR),近距离放疗器械容易到达合适的位置,腔内后装放疗在调强外照射放疗前期进行;对照组及新辅助化疗后肿瘤缓解不明显患者(SD+PD),因原发肿瘤的遮挡,近距离放疗器械不能到达合适的位置,在调强外照射放疗后期进行腔内后装放疗。⑥新辅助化疗前后、放疗前中后采用盆腔MRI 和/ 或CT检查作为肿瘤客观缓解率(ORR) 评价手段。
1.3 观察指标
①接受新辅助化疗患者通过妇科检查及影像学检查可测量客观病灶最大相对径线,以RECIST 1.1(Response evaluation criteria in solid tumors)[12,13]疗效评价诊断方法评价临床疗效:完全缓解(Complete Response CR):所有靶肿瘤病灶全部消失;部分缓解(Partial Response PR):所有靶肿瘤病灶的最大相对长径之和平均减少30%以上; 疾病稳定(Stable Disease SD):靶病灶减小的程度没达到原有PR,增加的程度也没达到原有PD 水平;疾病进展(Progressive Disesse PD):靶肿瘤病灶最大直径和相对长度增加至少20%或以上出现一个或多个新的靶病灶。以CR+PR 为疗效明显,计算客观缓解率(ORR)=(CR+PR) 例数/ 总例数×100%。②观察组(大部分为腔内后装放疗在调强外照射放疗前期进行)的放疗天数和对照组(腔内后装放疗在调强外照射放疗后期进行)的放疗天数。③急性放射性膀胱粘膜损伤、直肠粘膜损伤、血液化学毒性等疾病参照国际放射线与肿瘤医学协作医疗组织(RTOG)的急性放射膀胱损伤疾病分级评定标准均可分为1~4 级。
1.4 统计学方法
统计分析软件应用基本软件程序SPSS 17.0 统计学数据方法分析软件主要可以用于进行各类统计数据资料生存差异统计计量差异数据分析。生存分析采用KaPlan-Meirer 法;计量资料以均数±标准差(±s)表示,采用生存均数法和t 值差值法进行检验;计量数据资料以生存误差率(%)生存系数差值表示,采用生存均数差值χ2检验。P<0.05表示差异具有统计学意义。
1.5 随访
随访截至于2020 年4 月15 日,采用电话及定期复查模式随访。观察组随访9.8-79.1 个月,中位60.1 个月;对照组随访8.2-78.8 个月,中位44.3个月。
2 结果
2.1 观察组新辅助化疗疗效评价
患者客观缓解率(ORR) 为81.8%(45/55),其中CR 为27.3%(15/55),PR 为54.5%(30/55),SD 为16.4%(9/55),PD 为1.8%(1/55)。观察组患者化疗前后肿瘤最大生长直径变化情况:观察组患者新辅助化疗前的肿瘤最大径为(5.15±1.55)cm,化疗后肿瘤最大径为(2.03±1.72)cm。化疗前后肿瘤最大径比较,差异有统计学意义(t=7.8573,P<0.01)。见表2。

表2 观察组新辅助化疗后肿瘤最大径变化(cm,±s)
2.2 两组放射治疗时间的比较
根治性放射治疗包括调强外照射放疗和腔内后装放疗两部分。观察组55 例患者中45例(CR+PR)新辅助化疗后肿瘤明显缩小,腔内后装放疗在调强外照射放疗的前期进行,9 例(SD)、1 例(PD)疗效不佳,腔内后装放疗在调强外照射放疗的后期进行;观察组45 例患者进行放射治疗时间为(44.61±2.63) 天( 外 照 射45Gy/25f+ 内照射A 点剂量30Gy/5f)。对照组腔内后装放疗在调强外照射放疗的后期进行,放射治疗时间为(53.59±2.78) 天( 外照射45Gy/25f + 内照射A点剂量30Gy/5f)。两组放疗时间比较有统计学差异(t=13.5743,P<0.01)。见表3。

表3 两组放疗时间的比较(天,±s)
2.3 两组患者生存及无进展生存
观 察 组1、2、3、5 年总生存率分别为90.9%、83.6%、83.6%、74.7%,对 照 组1、2、3、5 年 生 存 率分 别 为92.7%、87.3%、81.3%、69.3%,观 察组1、2、3、5 年无进展生存率分别为89.1%、83.6%、76.4%、71.8%;对照组1、2、3、5 年无进展生存率分别为90.9%、81.8%、79.7%、64.5%。其中两组间生存曲线及无进展生存曲线差异均无统计学意义,P 值分别为0.563、0.777,χ2值分别为0.335、0.08,见图1、2。
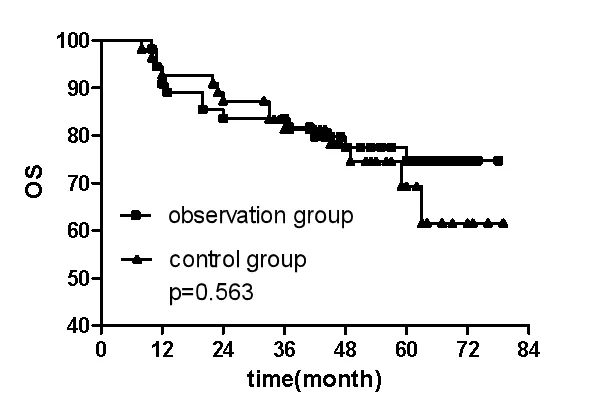
图1 两组患者生存曲线
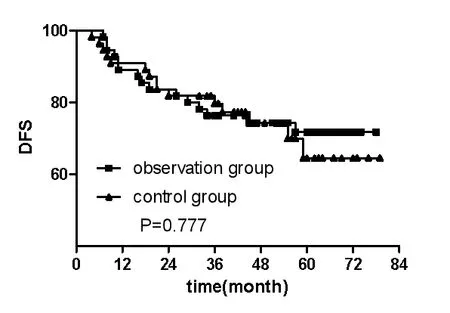
图2 两组患者无进展生存曲线
2.4 两组放疗期间不良反应
观察组发生白细胞总数下降1~2 级者26 例,白细胞总数下降3~4 级者21 例,急性放射性膀胱粘膜损伤1~2 级25 例,急性放射性直肠粘膜损伤1~2 级32 例,对照组依次为28、18、23、28 例,观察组白细胞总数下降、急性放射膀胱粘膜损伤及急性放射性直肠粘膜损伤发生率与对照组相当,两组对比差异无统计学意义(P>0.05),但3~4 级白细胞总数下降观察组有增高的趋势,见表4。

表4 两组患者放疗中的不良反应(例,%)
3 讨论
根治性放疗是中晚期宫颈癌的重要治疗手段之一,包括根治性外照射放疗(external-beam radiation theraPy,EBRT) 联合使用近距离腔内后装放疗[14]。根治性EBRT 的总放疗剂量多数为45Gy(40~50Gy)。联合使用近距离放疗,原发宫颈病灶接受到的剂量将增加,增加的剂量为A 点 30~40Gy。对于明显增大且未切除的淋巴结,需要使用高度适形EBRT 追加放疗,额外给予10~15Gy[15,16]。由于局部晚期原发肿瘤巨大,患者阴道穹隆及宫腔等自然通道被肿瘤占据阻塞,无法放置腔内后装放疗的阴道穹隆管和宫腔管。现行的治疗模式为患者先接受外照射放疗(EBRT),在外照射后期(一般为EBRT 治疗第四周)或外照射结束后[17]进行近距离放射治疗,这时恶性肿瘤体积已明显缩小,近距离放疗器械容易到达合适的位置。宫颈癌放疗的剂量学及放射生物学机制较复杂:(1)盆腔器官的放疗耐受性差,如小肠、膀胱和直肠对放疗敏感,易发生放射性损伤;(2)放疗时子宫、膀胱、直肠、小肠等的器官运动要求放疗靶区较大;(3)放疗时不能准确重复膀胱和直肠的充盈度,这些限制了外照射放疗对宫旁及淋巴引流区的剂量提升。
对于局部晚期宫颈癌,新辅助化疗联合放疗的近期有效性可以肯定,但远期疗效尚不明确。新辅助化疗可明显减少局部晚期恶性肿瘤病灶体积,增加恶性肿瘤的放射治疗敏感性,可有效抑制肿瘤浸润累及健康组织与淋巴结,以提高治愈效果,有效控制阳性淋巴结、宫旁粘膜肿瘤阳性累及、脉管内壁粘膜阳性浸润、阴道血管粘膜阳性浸润,,虽然化疗会增加患者不良反应,但这并不直接地影响最终治疗效果,是一种近期疗效效果较为理想的晚期肿瘤辅助化疗放射肿瘤治疗技术方法选择手段[18,19]。新辅助化疗可以提高外照射放疗对宫旁和淋巴引流区的放疗敏感性及治愈率。
目前对于新辅助化疗后的根治性放疗的大多数研究,仍采用的仍然是首先行外照射放疗,外照射放疗后期行腔内后装放疗。新辅助化疗能提高肿瘤局部控制率及控制远处潜在转移可能,但临床研究未发现近期疗效的优势未转化为生存期方面的临床获益[20-22],我们设想在患者近期疗效良好的情况下,利用肿瘤被充分控制的优势,改变放射治疗方式,缩短放射治疗时间,研究能否达到生存获益。本研究创新性的在2 程新辅助化疗后,积极评价化疗的客观疗效,在肿瘤退缩良好的情况下,近距离放疗器械能到达治疗的合适位置,安排腔内后装放疗在外照射放疗的前期进行。新辅助化疗能提高肿瘤局部控制率及控制远处潜在转移可能。
本研究显示,观察组新辅助化疗前后客观缓解率(ORR)为81.8%(45/55),化疗前后肿瘤最大径分别为(5.15±1.55)cm、(2.03±1.72)cm,肿瘤明显缩小,在缓解的45 例患者中,患者的阴道及宫腔均恢复通畅,在新辅助化疗后能较好的放置阴道穹隆管和宫腔管行腔内后装放疗。观察组中有9 例患者SD 及1 例患者PD,在外照射放疗3 周后亦能顺利完成后装治疗。
放射治疗持续时间和肿瘤控制率呈负相关。本研究观察组放射治疗总时间为(44.61±2.63)天,对照组治疗时间(53.59±2.78) 天,放疗时间明显缩短。因为近距离放疗剂量呈平方反比定律,腔内后装放疗理论上对膀胱、直肠、造血器官等所受到剂量影响不大,我们研究也显示缩短放疗时间后白细胞下降率、膀胱急性放射损伤和直肠急性放射损伤等不良反应没有明显增加。
综上所述,新辅助化疗后局部晚期宫颈癌的近期疗效好,化疗后腔内后装放疗在外照射放疗前期进行能明显缩短放射治疗时间。值得进一步研究,我们后期研究会继续积累病例及统计患者的10 年生存率、总生存期及无疾病生存期等。

