虫草菌丝通过抑制TLR4/NF-κB信号通路与血管生成素样蛋白4对肝纤维化小鼠模型的保护作用
张霖璋, 张定棋, 徐 莹,2b, 杨海琳, 戚胜兰, 张聪聪, 陈佳美, 刘 平, 刘 伟
1 上海中医药大学附属曙光医院, 肝病研究所, 肝肾疾病病证教育部重点实验室, 上海市中医临床重点实验室,上海 201203; 2 上海中医药大学 a.交叉科学研究院, b.教学实验中心, 上海 201203
肝纤维化是慢性病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病与自身免疫性肝病等多种慢性肝病后期共有的病理变化[1]。肝纤维化是一种可逆的创伤修复反应,其特征是肝脏受到损伤后活化的肝星状细胞(HSC)分泌大量的细胞外基质[2],但临床上尚缺乏有效逆转肝纤维化的生物或化学药物[3]。近年来有学者[4-7]研究发现中药及复方在肝纤维化治疗方面显示了良好的临床效果,如扶正化瘀胶囊/片、复方鳖甲软肝片、安络化纤丸以及下瘀血汤等。
现代药理学研究[8]表明虫草菌丝具有调节免疫功能、抗癌、保护肝肾等广泛的药理活性。课题组前期研究[9]发现虫草菌丝对肝纤维化小鼠具有显著改善作用,主要表现在能够抑制HSC的活化、逆转肝窦内皮细胞去分化等方面。Toll样受体4(TLR4)/核转录因子-κB(NF-κB)信号主要介导炎症反应,近年成为探究肝脏炎症反应机制的研究热点[10-11]。已知血管生成素样蛋白4(ANGPTL4)参与了人体多种的病理生理过程,如脂代谢、糖代谢、肿瘤发生及血管生成等[12]。课题组前期试验发现虫草菌丝显著下调肝纤维化小鼠肝组织中ANGPTL4的表达,但是否调控TLR4/NF-κB信号通路尚不清楚。因此,本研究拟通过探究虫草菌丝对CCl4肝纤维化小鼠模型肝组织ANGPTL4表达及TLR4/NF-κB信号通路的影响,探讨虫草菌丝抗肝纤维化的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 雄性C57/BL6J小鼠60只,SPF级,购自上海吉辉实验动物有限公司,体质量(20±2)g,动物生产许可证编号:SCXK(沪)2012—0014,实验动物使用许可证编号:SYXK(沪)2021—0005。小鼠饲养于上海中医药大学实验动物中心,环境温度(22±2)℃,日照时长和黑暗时长各12 h,所有小鼠均自由饮水进食。
1.1.2 药物与试剂 虫草菌丝(江西国药中药饮片有限公司,批号17040268);扶正化瘀方(上海现代制药股份有限公司,批号190608);苏木素-伊红(HE)染色试剂盒、羟脯氨酸(HYP)试剂盒(南京建成生物工程研究所,批号分别为20200716、A030-1);α-平滑肌肌动蛋白(α-SMA)、ANGPTL4抗体(Abcam公司,货号ab32575、ab196746);TLR4、CD163(Proteintech公司,货号19811-1-AP、16646-1-AP);NF-κB、P-NF-κB(Cell Signaling Technology公司,货号8242、3033);PCR引物由上海生工生物工程股份有限公司合成,引物序列见表1。

表1 PCR引物序列
1.1.3 主要仪器 CR21G型冷冻高速离心机(日本日立公司),Eclipse TS100-F型荧光显微镜(日本Nikon公司),JK-6型生物组织摊烤片机(武汉俊杰电子有限公司),Step One PlusTM型实时荧光定量PCR仪(美国Thermo公司),1-15K型高速冷冻离心机(美国Sigma公司),Odyssey扫描仪及双色红外激光成像系统(美国LI-COR公司)。
1.2 动物分组造模与药物干预 60只C57/BL6J雄性小鼠适应性饲养1周后,随机分为正常组10只和模型组50只。模型组小鼠按2 mL/kg体质量腹腔注射15% CCl4-橄榄油,每周一、三、五造模,造模6周;正常组小鼠按2 mL/kg体质量腹腔注射空白橄榄油。在第4周首日,将模型组小鼠随机分为模型对照组,虫草菌丝低、中、高剂量组,扶正化瘀方组;每组10只。造模第4周首日开始给药,虫草菌丝低、中、高剂量组分别口服给予400、800、1600 mg/kg虫草菌丝溶液,扶正化瘀方组口服给予2000 mg/kg扶正化瘀方溶液,以上药物均以0.3%羧甲基纤维素钠配制;正常组和模型组小鼠灌胃给予等体积0.3%羧甲基纤维素钠。各组药物干预均为1次/d,灌胃体积为10 mL/kg,连续3周。取材前禁食不禁水12 h,小鼠麻醉后取血和肝脏,处理后用于后续实验。
1.3 检测指标与方法
1.3.1 血清转氨酶和TBil检测 将血清样本各取150 μL送至上海中医药大学附属曙光医院检验科处协助检测,检测ALT、AST活性和TBil水平。
1.3.2 肝脏病理染色 选取肝大叶最厚一块,切取0.5cm×0.5cm×0.5cm肝组织1块,置于10%中性甲醛缓冲溶液固定72h,常规脱水、包埋、切片,HE和SR染液染色,将封好的片子使用数据扫描切片机自动扫描,并采用Image Analysis对SR染色阳性面积进行定量分析处理。
1.3.3 肝组织HYP含量 称取(50±2)mg肝组织,使用碱水解法作肝组织中的HYP含量检测,实验操作步骤参照试剂盒说明书操作。
1.3.4 实时荧光定量聚合酶链式反应(Real-time PCR) 称取肝组织50 mg,加trizol 1 mL提取总RNA,具体操作步骤按说明书进行,应用NanoVue浓度检测仪,检测RNA浓度。使用逆转录试剂盒对总RNA进行逆转录,得cDNA。取384 孔PCR板加样,Real-time PCR法检测对应指标,采用2-ΔΔCt法计算各mRNA表达量。
1.3.5 免疫组化检测α-SMA、Col-Ⅰ、ANGPTL4蛋白表达 免疫组化操作参照试剂盒说明书进行检测,α-SMA,1∶1000;Col-1,1∶800;ANGPTL4,1∶150,二抗1∶10 000,并采用Image Analysis对组织染色阳性面积进行定量分析。
1.3.6 蛋白免疫印迹法(Western Blot) 称取肝组织40~60 mg,加1 mL蛋白裂解液,4 ℃、65 Hz高速匀浆180 s,4 ℃ 12 000 r/min离心30 min,抽取上清液800 μL置1.5 mL离心管,再次离心30 min,抽取上清液600 μL置1.5 mL离心管,按BCA蛋白浓度测定试剂盒说明书操作进行蛋白浓度测定并加上样缓冲液。制胶,电泳,转膜,封闭,一抗孵育过夜、二抗室温孵育1 h,α-SMA(1∶1000),ANGPTL4(1∶1000),NF-κB(1∶1000),P-NF-κB(1∶1000)、TLR4(1∶1000),CD163(1∶1000),GAPDH(1∶5000),二抗(1∶10 000)。扫描目的条带,并与GAPDH条带对比分析进行统计。

2 结果
2.1 对CCl4肝纤维化小鼠血清肝功能的影响 与正常组比较,模型组小鼠血清ALT、AST、TBil均显著升高(P值均<0.01);与模型组比较,虫草菌丝低剂量组血清AST下降明显(P<0.05),中剂量组血清AST和高剂量组血清ALT、AST均下降明显(P值均<0.01),高剂量组血清TBil下降明显(P<0.05),扶正化瘀方组血清ALT、AST下降明显(P值均<0.01)(表2)。
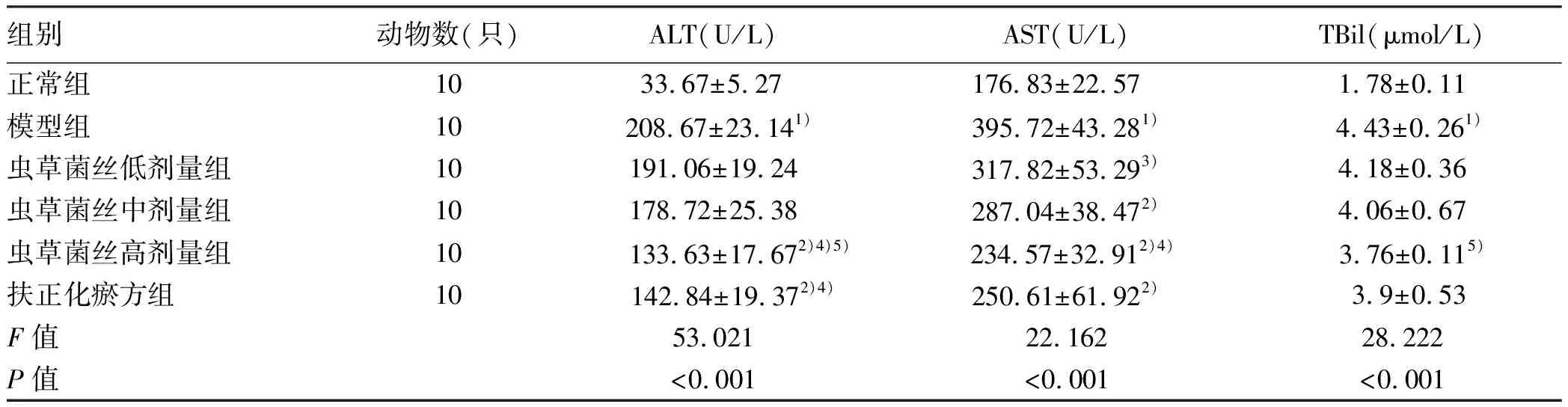
表2 各组小鼠血清生化结果比较
2.2 对CCl4肝纤维化小鼠肝组织病理学及HYP含量的影响 肝组织病理染色结果见图1。HE染色结果显示,正常组肝脏肝小叶结构清晰,无炎性细胞浸润;模型组小鼠肝小叶结构严重破坏,可见存在大量的炎性细胞浸润;各药物组均有不同程度改善,其中以虫草菌丝高剂量组改善效果最为显著。SR染色结果显示,正常组小鼠仅在汇管区可见少量胶原纤维;模型组小鼠肝组织以汇管区为中心出现大量胶原沉积;与模型组相比,各药物组胶原沉积均有不同程度地减少,其中以虫草菌丝高剂量组的效果最为显著。HYP和SR半定量结果见表3。与正常组相比,模型组HYP含量显著增加(P<0.01);与模型组相比,虫草菌丝高剂量组和扶正化瘀方组HYP含量均显著下降(P值均<0.05)。SR半定量结果显示,与正常组相比,模型组小鼠肝组织胶原面积显著增加(P<0.01);虫草菌丝中、高剂量组和扶正化瘀方组胶原面积较模型组均显著下降(P值均<0.05)。
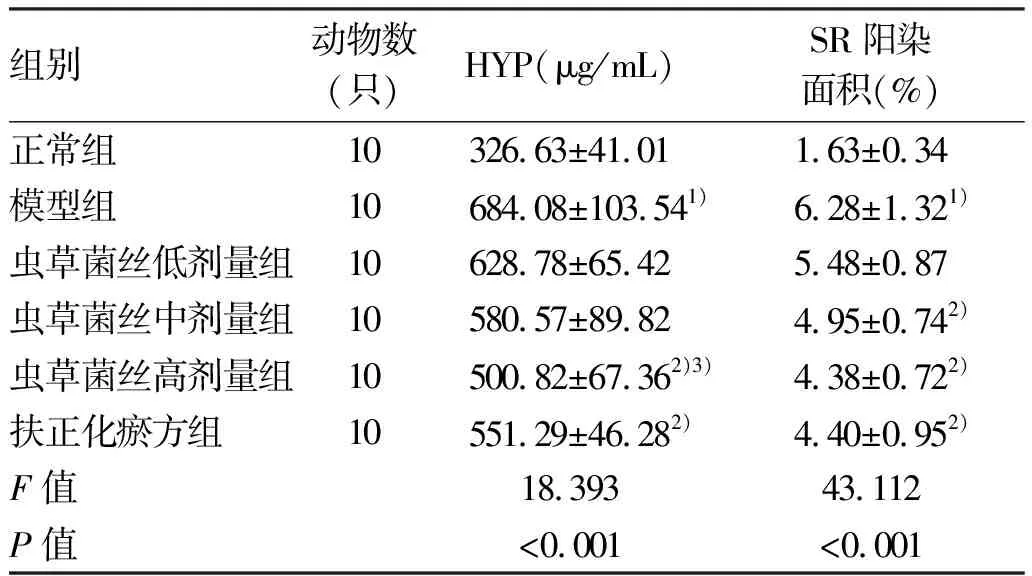
表3 HYP含量和SR阳染面积
2.3 对CCl4肝纤维化小鼠α-SMA和Col-Ⅰ表达的影响 免疫组化结果见图2。正常组于汇管区少量表达α-SMA;半定量结果显示,模型组较正常组α-SMA表达明显增多(P<0.01)(表4);虫草菌丝高剂量组改善效果最佳(P<0.05)(表4),可见纤维间隔带明显变窄。正常组小鼠肝组织内Col-Ⅰ少量表达于小静脉壁,半定量结果示模型组较正常组Col-Ⅰ表达明显增多(P<0.01)(表4),可见大量胶原纤维表达于肝窦壁和纤维间隔,与模型组相比,虫草菌丝不同剂量组肝组织内胶原表达显著减轻,半定量结果显示虫草菌丝高剂量组效果最佳(P<0.05)(表4),肝组织胶原沉积明显减少。
Real-time PCR结果见表5,与正常组相比,模型组小鼠肝组织α-SMA、Col-Ⅰ mRNA表达水平均显著升高(P值均<0.01);虫草菌丝中、高剂量组下降效果最为显著(P值均<0.05)。
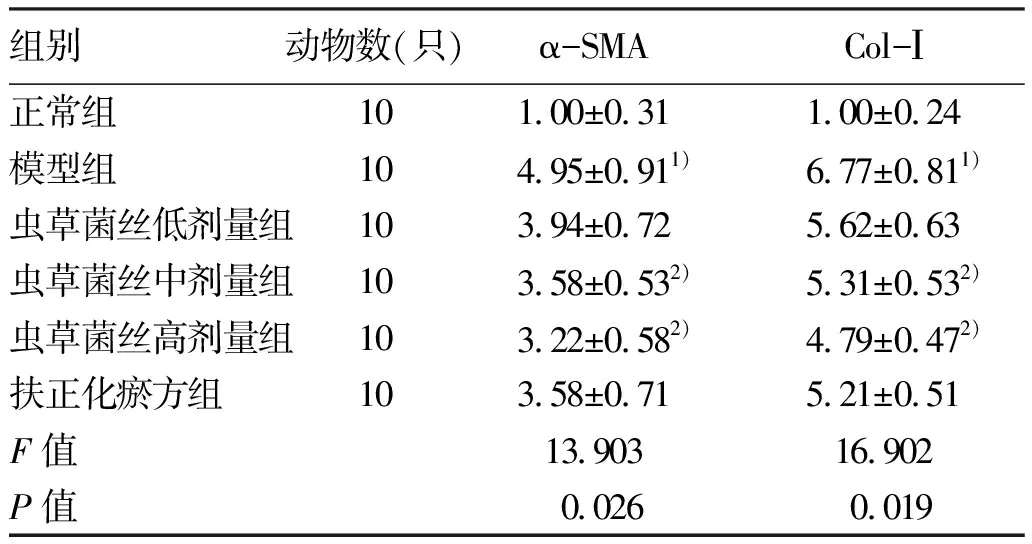
表5 α-SMA和Col-Ⅰ mRNA表达
Western Blot结果见图3,与正常组相比,模型组小鼠肝组织α-SMA蛋白表达水平显著升高(P<0.01),虫草菌丝高剂量组和扶正化瘀方组改善效果最为显著(P值均<0.05)(表6)。

表6 α-SMA蛋白表达
2.4 对CCl4肝纤维化小鼠ANGPTL4及TLR4/NF-κB信号通路相关蛋白表达的影响 免疫组化结果见图4。正常组小鼠肝组织内ANGPTL4少量表达于肝实质细胞周围。半定量结果显示,模型组较正常组ANGPTL4表达明显增多(P<0.05),主要表达在汇管区和胆管细胞周围;虫草菌丝高剂量组改善效果最佳(P<0.05)(表7)。

表7 ANGPTL4免疫组化阳染面积

注:N,正常组;M,模型组;CS(400 mg/kg),虫草菌丝低剂量组;CS(800 mg/kg),虫草菌丝中剂量组;CS(1600 mg/kg),虫草菌丝高剂量组;FZGY(2000 mg/kg),扶正化瘀方组。箭头所示为ANGPTL4蛋白的表达。

注:CS,虫草菌丝;FZHY,扶正化瘀方。
Western Blot结果见图5。与正常组相比,模型组小鼠肝组织ANGPTL4、TLR4蛋白均显著升高(P值均<0.05),P-NF-κB/NF-κB、CD163蛋白均明显升高(P值均<0.01);与模型组相比,高剂量组ANGPTL4、TLR4、P-NF-κB/NF-κB和CD163改善效果最为显著(P值均<0.05),扶正化瘀方组ANGPTL4改善效果明显(P<0.05)(表8)。

表8 ANGPTL4、TLR4、P-NF-κB、NF-κB、CD163蛋白表达
3 讨论
肝纤维化是以活化的HSC分泌大量的细胞外基质、胶原表达增多及过度沉积为特征,被认为是肝硬化和肝癌进展的关键因素[13]。尽管在过去的几十年里,肝纤维化的发病机制得到了广泛的研究,但目前还没有有效的化学与生物药物。本研究结果表明,虫草菌丝能够显著改善CCl4诱导的小鼠肝组织的纤维化程度、血清肝功能异常,显著减少α-SMA和Col-Ⅰ等纤维化指标的mRNA和蛋白的表达,显著减少ANGPTL4、TLR4、P-NF-κB/NF-κB和CD163蛋白的表达。

注:CS,虫草菌丝;FZHY,扶正化瘀方。
ANGPTL4属于血管生成素样蛋白家族的一员,全长ANGPTL4(fANGPTL4)蛋白含一个nANGPTL4结构域和一个cANGPTL4结构域,肝脏能产生nANGPTL4片段[14]。肝脏是人体内脂肪代谢的场所,它在维持血糖稳定和正常脂质代谢中起着关键作用,肝脏功能障碍容易引起血糖和脂质代谢紊乱[15-16]。特异性地敲除ANGPTL4基因可以改善小鼠模型中因饮食引起的肥胖、葡萄糖不耐受和肝脏脂肪变性等问题[17]。最新研究[18]发现ANGPTL4在肝硬化患者和HBV诱导的肝损伤细胞模型中明显上调,向肝硬化模型小鼠的尾静脉注射sh-ANGPTL4慢病毒载体,发现干扰ANGPTL4的表达可以抑制HSC的活化,减少α-SMA、Col-Ⅰ、TLR4、NF-κB和CD163的mRNA和蛋白的表达,提示ANGPTL4通过TLR4/NF-κB通路调节CD163表达来改善Kupffer细胞极化诱导的肝硬化。ANGPTL4在本实验CCl4诱导的小鼠肝纤维化模型中显著升高,这和文献报道的在肝硬化模型中升高相一致,并且高剂量组虫草菌丝能够显著降低ANGPTL4的表达。
在纤维化肝脏中,巨噬细胞对肝纤维化的影响主要通过细胞因子旁分泌影响HSC的活化[19],进而促进肝纤维化的进展[20]。CD163是一种M2型巨噬细胞的标志物,过往研究表明CD163是一种抗炎分子,在促炎因子的刺激下会受到抑制。但有文献[21]报道在缺血损伤后的肝再生组织区域中会发现大量CD163高表达的巨噬细胞。同时既往研究[17]发现ANGPTL4是巨噬细胞的一个重要调控因子,能调节巨噬细胞的极化和造血干细胞的激活,并促进肝硬化的发生发展。本实验研究结果发现在CCl4肝纤维化模型小鼠中CD163蛋白表达显著升高,这也提示CD163蛋白不仅是一种抗炎分子,同样也会在促炎因子的刺激下高表达。
TLR4/NF-κB信号通路是肝脏疾病反应的关键通路,它广泛存在于各种组织和细胞中,是介导炎症因子和细胞之间相互作用的重要信号途径之一[22-23]。同时TLR4也可以通过与下游MyD88信号分子结合,来快速激活NF-κB炎症分子,从而上调包括Col-Ⅰ等在内的促纤维化细胞因子的释放,进而促进纤维化的进程[24-25]。除能调节肝纤维化疾病进展外,还有报道[26]表明TLR4/NF-κB信号通路在肝脏免疫功能紊乱、HSC的激活和肝癌的进展等机制方面发挥着重要作用。本研究发现虫草菌丝能够显著减少肝脏胶原沉积,并且能剂量依赖性地降低肝脏α-SMA和Col-Ⅰ的表达以及TLR4/NF-κB信号通路相关的蛋白表达。因此抑制TLR4/NF-κB信号通路可能是缓解肝纤维化进展的有效途径之一。
综上所述,虫草菌丝对CCl4诱导的小鼠肝纤维化具有显著的治疗作用,其可能通过降低ANGPTL4的表达来下调CD163表达,进而抑制肝纤维化进程,这可能主要是通过调节TLR4/NF-κB信号通路来实现。
伦理学声明:本研究方案于2021年1月15日通过上海中医药大学实验动物伦理委员会审查,伦理编号PZSHUTCM210115005,符合实验室动物管理与使用准则。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:张霖璋负责课题设计,资料分析,撰写论文;张定棋、徐莹、杨海琳、戚胜兰、张聪聪、陈佳美参与收集数据,修改论文;刘平、刘伟负责拟定写作思路,指导撰写文章并最后定稿。

