HBV感染者外周血自然杀伤样B淋巴细胞、自然杀伤细胞、B淋巴细胞亚群的变化及临床意义
杨晓飞, 申焕君, 黄高铂, 连建奇, 张 野
1 空军军医大学第二附属医院(第四军医大学唐都医院) 传染病科, 西安 710038;2 西安交通大学第一附属医院 肝胆外科, 西安 710061
急性HBV感染可诱导多克隆病毒特异性细胞毒性T淋巴细胞增殖分化,杀伤病毒感染的肝细胞,在清除HBV的同时可造成严重肝损伤。慢性HBV感染可诱导机体免疫耐受,造成免疫逃逸,无法有效清除病毒,导致感染慢性化[1]。因此,HBV感染的临床结局是病毒感染与机体免疫应答复杂相互作用的结果[2]。自然杀伤(natural killer,NK)样B淋巴细胞是一类新鉴定的免疫细胞亚群,NKB淋巴细胞兼具NK细胞和B淋巴细胞的表型,通过分泌IL-12和IL-18调控NK细胞和固有淋巴样细胞功能,在病原体感染早期即可发挥有效免疫调控和抗感染活性[3]。但有关NKB淋巴细胞在HBV感染中的分布和临床意义罕见相关报道。本研究分析了HBV感染者中NKB淋巴细胞、NK细胞和B淋巴细胞亚群的变化和临床意义。
1 资料与方法
1.1 研究对象 选取2017年1月—2018年12月就诊于唐都医院传染科的HBV感染者,包括急性乙型肝炎(acute hepatitis B,AHB)患者、慢性乙型肝炎(chronic hepatitis B,CHB)患者、无症状HBV携带者(asymptomatic HBV carrier,ASC)。AHB纳入标准:(1)既往无乙型肝炎病史;(2)HBsAg阳性、HBV DNA阳性;(3)ALT水平升高超过5倍正常值上限;(4)抗-HBc IgM 阳性;(5)6个月内HBsAg和HBV DNA均阴转。CHB患者纳入标准符合《慢性乙型肝炎防治指南(2015更新版)》[4]的诊断标准:(1)HBsAg阳性大于6个月;(2)HBV DNA阳性;(3)ALT水平超过2倍正常值上限。ASC纳入标准:(1)HBsAg阳性、HBeAg阳性、HBV DNA阳性;(2)ALT水平在正常范围内。所有患者既往均未接受抗病毒治疗,年龄>18岁。对照组纳入标准:(1)同时期在唐都医院行健康查体者;(2)年龄>18岁;(3)既往无HBV感染病史和乙型肝炎家族史。排除标准:(1)合并其他嗜肝病毒感染或HIV感染者;(2)合并自身免疫性疾病、酒精性肝硬化、药物性肝损伤者;(3)合并恶性肿瘤者;(4)合并失代偿期肝硬化、肝衰竭、肝癌等终末期肝病者;(5)妊娠或哺乳期妇女。
1.2 研究方法
1.2.1 主要试剂和仪器 淋巴细胞分离液购自美国Sigma公司。小鼠抗人CD3-FITC、小鼠抗人CD19-APCH7、小鼠抗人CD16-APC、小鼠抗人CD56-PerCP Cy5.5均购自美国BD公司。人IL-18和IFNγ酶联免疫吸附试验(ELISA)检测试剂盒购自武汉华美生物技术公司。IFNγ酶联斑点吸附试验(ELISPOT)检测试剂盒购自瑞典Mabtech公司。FACS Aria Ⅱ流式细胞仪为美国BD公司产品。ELISA微孔读板仪为美国伯乐公司产品。ELISPOT读板仪为德国AID公司产品。
1.2.2 血浆和外周血单个核细胞(PBMC)的分离 清晨、空腹采集EDTA抗凝外周血静脉血10 mL,于4 ℃、1000 r/min离心10 min分离血浆,冻存于-80 ℃备用。剩余血细胞立即使用淋巴细胞分离液、采用Ficoll密度梯度离心法分离PBMC。使用0.4%台盼蓝对PBMC计数,以5×106个/管分装在冻存管中,加入90%胎牛血清+10%二甲基亚砜冻存于液氮中备用。
1.2.3 流式细胞检测免疫细胞亚群比例 复苏PBMC,取106个PBMC,转入FACS管中,洗涤2次后加入小鼠抗人CD3-FITC、小鼠抗人CD19-APC H7、小鼠抗人CD16-APC、小鼠抗人CD56-PerCP Cy5.5进行表面染色,4 ℃避光孵育30 min,洗涤后进行流式检测。使用FACS Aria Ⅱ流式细胞仪检测,BD FACS Diva软件获取细胞,FlowJo V10软件分析结果。NKB淋巴细胞、NK细胞和B淋巴细胞的流式分析策略:首先根据前向角散射和侧向角散射对淋巴细胞进行圈门,在淋巴细胞门内分析CD3-CD19+细胞,即为B淋巴细胞。在CD3-CD19+门内,分析CD16+CD56+细胞,即为NKB淋巴细胞。在淋巴细胞门内分析CD3-CD19-细胞,在CD3-CD19-门内,分析CD16和CD56表达,分析不同NK细胞亚群,包括:CD3-CD19-CD56highCD16-NK细胞、CD3-CD19-CD56+CD16+NK细胞、CD3-CD19-CD56-CD16+NK细胞(图1)。

图1 外周血NKB淋巴细胞、NK细胞、B淋巴细胞的流式分析策略
1.2.4 ELISA检测血浆IL-18和IFNγ水平 使用商品化的ELISA试剂盒对血浆中IL-18和 IFNγ水平进行检测,操作按说明书要求进行。
1.2.5 ELISPOT检测HBV特异性CD8+T淋巴细胞分泌 IFNγ水平 使用抗IFNγ(0.5 μg/mL)包被96孔PVDF膜板,4 ℃孵育过夜,向每孔中加入105个PBMC(100 μL)和HBV全基因组多肽(15肽,每条多肽之间有5个氨基酸重叠,共313条;10 μg/mL)[5],37 ℃、5%CO2条件下刺激培养16 h,洗涤后每孔加入100 μL生物素标记的抗IFNγ单抗,室温孵育60 min,洗涤后每孔加入100 μL碱性磷酸酶标记的链球菌亲和素,室温避光孵育45 min,洗板后加入显色剂反应15 min,终止反应后读板,以斑点形成细胞数(spot forming cells, SFC)/106PBMC为单位计数产生IFNγ的细胞。
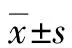
2 结果
2.1 一般资料 共纳入AHB患者15例,CHB患者30例,ASC 29例,对照者12例。入组受试者一般资料见表1。

表1 入组受试者一般资料比较
2.2 HBV感染者外周血NKB淋巴细胞、NK细胞、B淋巴细胞比例和IL-18、IFNγ水平变化 CD3-CD19+CD16+CD56+NKB淋巴细胞占淋巴细胞的比例在AHB患者、CHB患者、ASC和对照者之间的差异有统计学意义(F=16.42,P<0.000 1),CHB患者NKB淋巴细胞比例[(0.79±0.13)%]显著低于AHB患者[(0.94±0.15)%]、ASC[(1.02±0.12)%]和对照者[(1.11±0.27)%](P值均<0.001)(图2a)。CD3-CD19-CD56highCD16-NK细胞、CD3-CD19-CD56+CD16+NK细胞、CD3-CD19-CD56-CD16+NK细胞以及B淋巴细胞占淋巴细胞的比例在AHB患者、CHB患者、ASC和对照者之间的差异均无统计学意义(F值分别为0.598、0.505、1.950、1.676,P值均>0.05)(图2b~e)。血浆IL-18水平在AHB患者、CHB患者、ASC和对照者之间的差异有统计学意义(F=5.733,P=0.001),CHB患者IL-18水平[(259.30±70.09)pg/mL]显著低于AHB患者[(336.00±103.00)pg/mL]和对照者[(319.30±64.80)pg/mL](P值均<0.05),ASC IL-18水平[(258.60±59.82)pg/mL]亦显著低于AHB患者和对照者(P值均<0.01),但血浆IL-18水平在CHB患者和ASC之间的差异无统计学意义(P=0.965)(图2f)。血浆IFNγ水平在AHB患者、CHB患者、ASC和对照者之间的差异有统计学意义(F=4.737,P=0.004),CHB患者IFNγ水平[(11.79±2.47)pg/mL]显著低于AHB患者[(14.55±3.81)pg/mL]、ASC[(13.79±2.82)pg/mL]和对照者[(14.50±2.42)pg/mL](P<0.01)(图2g)。

注:a,CD3-CD19+CD16+CD56+NKB淋巴细胞;b,CD3-CD19-CD56highCD16-NK细胞;c,CD3-CD19-CD56+CD16+NK细胞;d,CD3-CD19-CD56-CD16+NK细胞;e,B淋巴细胞;f,IL-18;g,IFNγ。
2.3 HBV感染者中NKB淋巴细胞与临床指标相关性 AHB患者、CHB患者和ASC中NKB淋巴细胞和IL-18与HBV DNA定量、ALT水平均无相关性(P值均>0.05)。AHB患者和ASC中NKB淋巴细胞与IL-18水平无相关性(P>0.05),CHB患者中NKB淋巴细胞占淋巴细胞的比例与血浆IL-18水平呈正相关(r=0.432,P=0.017)(图3a),CHB患者中NKB淋巴细胞占淋巴细胞的比例与血浆IFNγ水平无相关性(r=-0.018,P=0.923)(图3b),但CHB患者中NKB淋巴细胞比例与病毒特异性CD8+T淋巴细胞分泌IFNγ水平呈显著正相关(r=0.493,P=0.006)(图3c)。

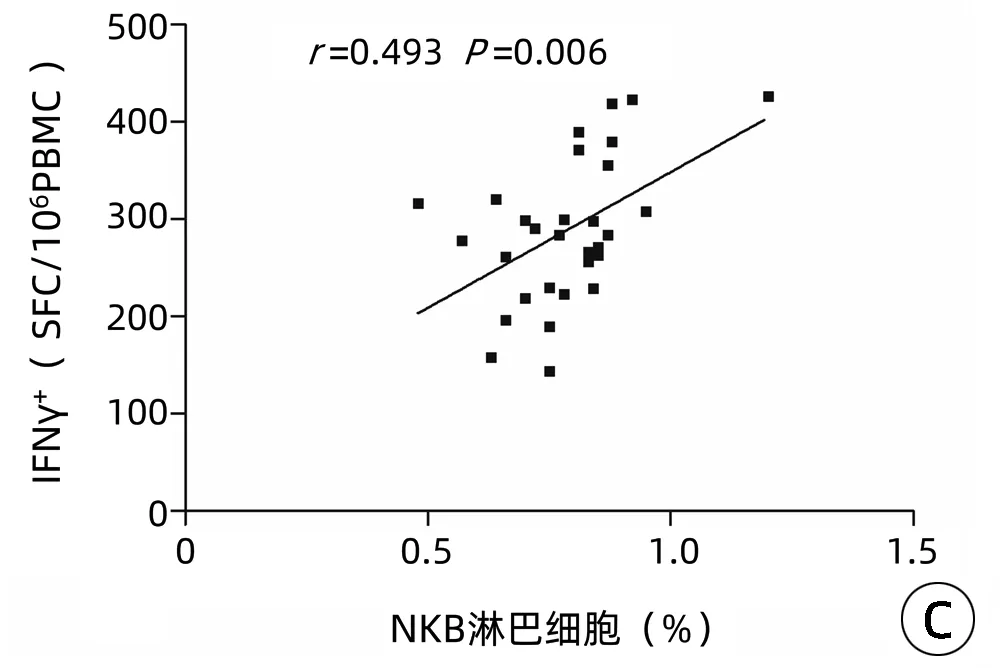
注:a,NKB淋巴细胞比例与血浆IL-18水平相关性分析;b,NKB淋巴细胞比例与血浆IFNγ水平相关性分析;c,NKB淋巴细胞比例与病毒特异性CD8+T淋巴细胞分泌IFNγ水平相关性分析。
3 讨论
本研究首次对新近鉴定的淋巴细胞亚群——NKB淋巴细胞在HBV感染者中的变化进行分析。NKB淋巴细胞虽然兼具NK细胞和B淋巴细胞的标记,在小鼠中的表型为CD3-CD19+NK1.1+[3],在人类中的表型为CD3-CD19+(或CD20+)NKp46+[3,7-8],但NKB淋巴细胞的功能却尚未完全阐明。Kerdiles等[9]认为,虽然NKB淋巴细胞具有NK细胞的表型,但在功能上与传统B淋巴细胞基本相似。但Wang等[3]则认为,NKB淋巴细胞主要通过分泌IL-18和IL-12在微生物感染早期阶段活化NK细胞和固有淋巴样细胞,发挥抗感染免疫活性,这一功能活性亦在猴免疫缺陷病毒感染中得到证实[10]。本课题组前期研究[8]发现,NKB淋巴细胞在牙周炎患者外周血和牙周组织中的水平均显著升高,并主要通过分泌IL-18发挥促进牙周组织炎症应答的作用。新近的研究[11]发现,原发性肝癌患者外周血和肿瘤浸润NKB淋巴细胞比例及其分泌的IL-18水平均显著降低。但有关NKB淋巴细胞在HBV感染中的数量和功能的变化尚未见相关报道。本研究应用经典NK细胞表型(CD3-CD16+CD56+)和B淋巴细胞表型(CD3-CD19+)对HBV感染者外周血中CD3-CD19+CD16+CD56+NKB淋巴细胞进行了检测,结果发现,AHB患者和ASC外周血NKB淋巴细胞比例与对照者无显著差异,但CHB患者中NKB淋巴细胞比例则显著低于对照者。在对NKB淋巴细胞的标志性细胞因子IL-18的表达水平进行分析时亦发现,CHB患者和ASC中IL-18表达水平下降,这与既往研究[12]基本一致。
NKB淋巴细胞比例和IL-18水平与病毒复制、肝脏炎症均无显著相关性。由于既往的研究主要集中在NKB淋巴细胞在急性病毒感染中的作用,本研究未发现AHB患者中存在NKB淋巴细胞数量变化,提示NKB淋巴细胞可能并未直接参与急性HBV感染的病程。而ASC和CHB是慢性HBV感染自然史的2个不同阶段,多数患者在青少年阶段处于免疫耐受期,病毒处于高水平复制,肝脏炎症应答轻,随着疾病进展,机体免疫系统对感染病毒的肝细胞进行杀伤,清除病毒的同时诱导肝脏炎症损伤[13-14]。因此,本研究入组的ASC较CHB患者年龄小,但NKB淋巴细胞和IL-18与年龄无显著相关性。NKB淋巴细胞仅在CHB患者中降低,在ASC中无明显变化,而IL-18在CHB患者和ASC中均显著降低,但仅在CHB患者中NKB淋巴细胞与IL-18呈显著正相关。这可能说明由于ASC患者处于免疫耐受阶段,NKB淋巴细胞活性尚未受到抑制,ASC患者中其他分泌IL-18的细胞(如单核细胞、角质形成细胞等)亦可能被抑制,导致IL-18水平下降。而进入免疫清除期后,长期病毒持续感染仍可能导致免疫细胞失能,造成NKB淋巴细胞水平下降,其分泌的IL-18水平亦降低,不能清除病原体和诱导抗病毒免疫应答,加重病毒持续感染。因此,NKB淋巴细胞水平下降可能与HBV感染自然史密切相关。此外,CHB患者外周血中NKB淋巴细胞降低亦可能与疾病过程中NKB淋巴细胞向肝脏的募集浸润有关。新近的研究[15]发现,肝癌患者中NKB淋巴细胞可通过分泌IL-18调控CD8+T淋巴细胞活性。本研究发现,NKB淋巴细胞比例与分泌IFNγ的HBV特异性CD8+T淋巴细胞水平呈显著正相关,提示在CHB疾病过程中,NKB淋巴细胞也可能参与了病毒特异性CD8+T淋巴细胞功能调控。但本研究未纳入ASC和CHB患者的肝穿刺标本,仍需要使用HBV转基因小鼠模型进行研究加以证实。
本课题组既往研究[16]发现,HBV质粒高压尾静脉注射诱导的HBV感染小鼠模型肝脏中NK细胞比例与对照小鼠无显著差异,本研究在HBV感染者中亦发现了相似的结果。NK细胞根据CD16和CD56表达水平可分为CD56highCD16-NK细胞、CD56+CD16+NK细胞、CD56-CD16+NK细胞。CD56highCD16-NK细胞通过分泌多种细胞因子参与机体免疫调控;CD56+CD16+NK细胞是成熟的、具有细胞毒性的NK细胞亚群,通过CD16发挥抗体依赖的细胞介导的毒性作用;CD56-CD16+NK细胞则是失能的NK细胞,分泌细胞因子和细胞毒性作用均显著降低,增殖能力亦低下[17]。本研究发现,HBV感染者中三类NK细胞亚群比例与对照者均无显著差异,这与既往发现NK细胞在AHB患者和CHB患者中受到抑制的趋势不尽相同[18],这可能与分析NK细胞不同亚型时采用的细胞表面标志不同有关。NK细胞通过分泌IFNγ介导后续适应性免疫活化促进HBV清除[19],因此本研究亦对血清中IFNγ水平进行检测,结果发现,CHB患者血浆IFNγ水平显著降低,这与本课题组既往研究[20]结果一致,但与NK细胞亚群变化趋势不尽相同,这可能由于NK细胞并非为血浆中IFNγ的唯一细胞来源有关。既往有研究[21-22]发现HBsAg和HBeAg可诱导成熟的NK细胞功能活性下降,导致HBV感染者疾病进展,促进失代偿期肝硬化、肝癌等终末期肝病发生。B淋巴细胞在HBV感染过程中发挥诱导抗病毒抗体产生、抗原提呈等多种功能[23],但本研究中亦未发现HBV感染者和对照者外周血B淋巴细胞比例存在明显差异。因此,HBV感染者中NK细胞和B淋巴细胞功能的变化仍有待进一步研究。同时,本研究为横断面研究,针对AHB患者和CHB患者未进行治疗前后不同免疫细胞亚群的比较,这也是本研究的薄弱环节之一。
综上所述,慢性HBV感染可能诱导NKB淋巴细胞水平下降,NKB淋巴细胞及其分泌的IL-18参与HBV感染慢性化,与慢性HBV感染自然史相关。
伦理学声明:本研究方案于2015年5月21日经由空军军医大学第二附属医院(第四军医大学唐都医院)伦理委员会批准,批号:TDLL-201505-013,所有入组受试者均签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:杨晓飞、申焕君、黄高铂负责实验操作和论文撰写;杨晓飞、连建奇、张野负责数据分析;连建奇、张野负责入组患者、课题设计、指导论文撰写并最后定稿。

